
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:3个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:心包积液 | |
01 主诉
及病史发病前一周从收容所领养,领养后一直存在腹泻。由于嗜睡和持续腹泻的情况不断恶化,遂就诊。
02 检查
体重1.6千克。侧卧位,呼吸急促,体温严重偏低,无法测量。初步生化分析表明,该猫患有高钾血症、低钠血症、低氯血症、尿素增加、高磷血症和丙氨酸氨基转移酶升高(下表)。血浆白蛋白、碱性磷酸酶、葡萄糖、γ-谷氨酰转移酶、胆红素、淀粉酶和脂肪酶以及血液学参数均在正常范围内。
在静脉恒速输注生理盐水(5 mL/kg/h)和补充葡萄糖约15分钟后,发生了心肺骤停。利用单次心内注射低剂量肾上腺素(0.01 mg/kg)进行心肺复苏,再通过静脉注射给药,同时进行8分钟的胸外按压并补充氧气,最终成功复苏。在逐渐升温并稳定病情后,进一步转诊治疗。
转诊入院后,患者处于侧卧位,严重昏睡,但对疼痛有反应,严重心动过速(心率300 bpm),脉搏质量差,高热(直肠温度40°C)。呼吸频率轻度增快(呼吸频率44 bpm),呼吸力度正常,粘膜略显粘稠,呈淡粉色,毛细血管再充盈时间为1.5秒。心肺听诊显示肺音轻微减弱,心音正常。
心脏超声检查显示轻度低回声心包积液,伴有小的高回声颗粒,无心包填塞。腹部柔软无痛,腹部超声检查显示有少量无回声腹腔积液。膀胱很小。
静脉血气分析显示碳酸氢根离子中度下降,pH值轻度下降。其他结果包括低钠血症、低氯血症、轻度高乳酸血症。血浆肌酐浓度在正常范围内(上表)。
03 治疗
由于心包积液量较小,没有心包填塞,而且患者体型较小,因此决定不进行诊断性心包穿刺。当时的初步诊断是腹泻引起的低血容量,导致失代偿性低血容量性休克。兽医怀疑心包积液是由于心肺复苏和心内注射后的心包出血造成的。
最初的治疗包括补充氧气(2 L/min)、注射5 mL/kg生理盐水,然后以2 mL/kg/h的速度静脉注射生理盐水以维持体液。
在病情稳定期间,心率降至200 bpm,体温恢复正常(38.6°C)。为预防高钾血症,在36小时内恒定输注特殊配制的溶液:25 mL 8.4%碳酸氢钠、12.5 mL 50%葡萄糖和12. 5 mL无菌水,配制成含有1 mmoL/mL NaHCO3和1.5 g/mL葡萄糖的溶液,以0.25 mL/kg/h的速度给药。
为了预防恶心,还接受了0.3 mL/kg昂丹司琼静脉注射。猫被关在氧气笼中,氧气吸入量为40%。
在随后的几个小时里,整体状况明显好转。如期排尿,没有排便迹象,食欲旺盛。在接下来的24小时内,患者的临床症状一直很稳定,仍有中度心包和胸腔积液,但没有明显的呼吸或心血管受损迹象。输液治疗根据电解质变化进行了定期调整。
入院约38小时后,出现了轻微的呼吸窘迫症状,呼吸频率正常,但呼吸强度明显增加。血气分析表明,之前的代谢性酸中毒已经缓解,出现了轻度低碳酸血症,电解质失衡情况相对不变(上表)。
胸部超声显示有中量胸腔积液。在镇静状态下进行了胸腔穿刺(0.2 mg/kg丁吗啡酚静脉注射),抽出30 mL渗出液。随后整体状况和呼吸迅速得到改善,呼吸频率和力度恢复正常。
3小时后,猫突然侧卧,反应微弱,体温严重过低(32.6°C)。再次进行血气分析发现,出现轻度代谢性酸中毒、中度高乳酸血症、轻度低钠血症和低氯血症(上表)。
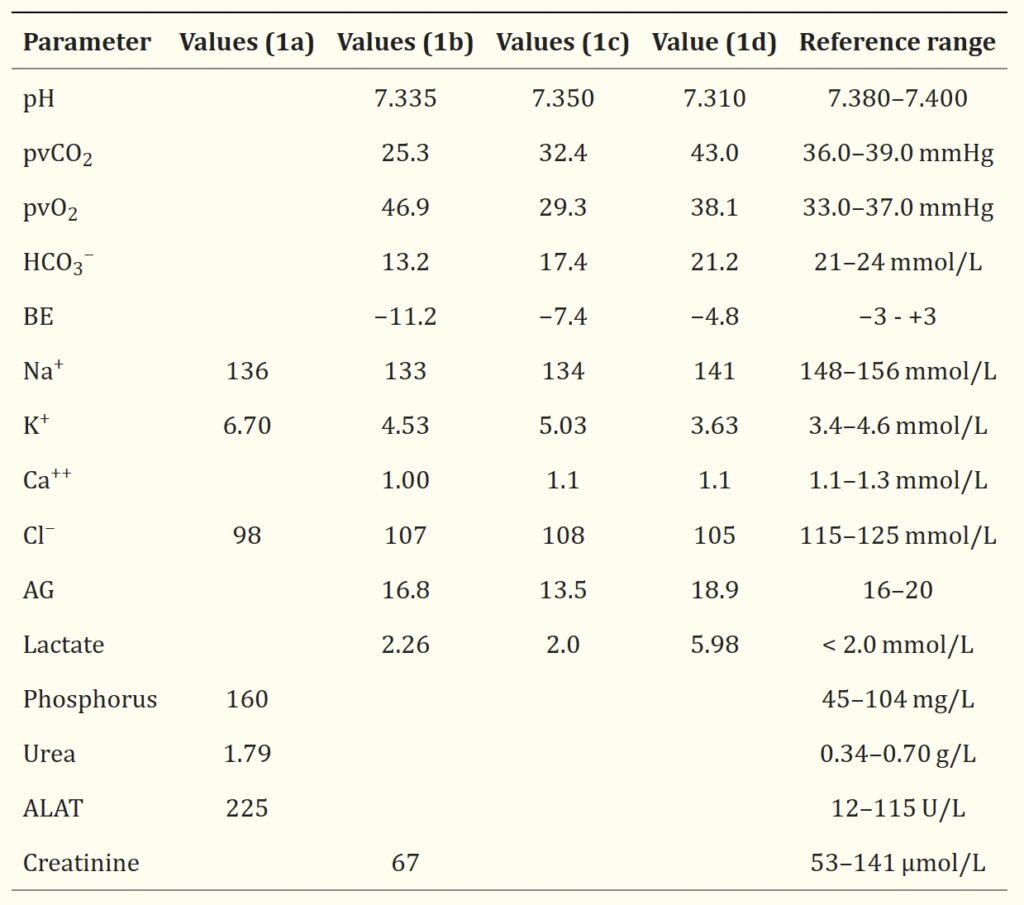
超声显示中度心包积液、大量胸腔积液和轻度腹腔积液(下图)。由于患者临床病情恶化,对其进行了心包穿刺(6 mL)、胸腔穿刺(75 mL)和诊断性腹腔穿刺。
心包积液分析表明是近期出血(PCV 29%),而胸腔和腹腔积液符合渗出液(细胞贫乏、透明、比重1.018、总固形物30 g/L),细胞为58%非变性中性粒细胞、4%小淋巴细胞、38%巨噬细胞,还观察到罕见的反应性间皮细胞,但未发现微生物。
清除心包和胸腔积液后,心血管状况立即得到了改善。为了防止可能出现的纤溶亢进和出血,注射了氨甲环酸(10 mg/kg,静脉注射20分钟)。
在接下来的8小时内,心血管状况稳定(心率180 bpm,呼吸频率32 bpm,粘膜呈粉红色且湿润,血压108 mmHg),超声检查显示有轻微胸腔和心包积液。
第二天进行了全面的检查,并使用超声重新检查了心脏、胸部和腹部,结果显示有轻度至中度的心包和胸腔积液以及轻度腹水。目前没有心包填塞的迹象。由于猫的临床状况良好,没有再进行胸腔或心包穿刺。除了持续的轻度低钠血症、低氯血症和轻度低白蛋白血症外,全血细胞计数和生化分析结果均无异常。粪便样本进行了寄生虫学检测,结果显示感染了欧氏等孢子虫(Cystoisospora ohioensis-burrowsi)。
12小时后,猫出现急性呼吸困难。肺部听诊发出低沉的声音,超声检查显示大量胸腔积液。随后通过胸腔穿刺术排出了总计70 mL的渗出液。心包轻度至中度充盈,没有进行心包穿刺。
又过了2小时,侧卧,心音低沉,呼吸紊乱,心动过缓。立即进行了气管插管和心包穿刺术,但还是出现了心肺骤停。心肺复苏工作包括胸外按压、人工通气以及注射肾上腺素(0.01 mg/kg IV)和阿托品(0.05 mg/kg IV),短时间内出现了室性无脉性心动过速。在准备安装除颤器的过程中,心律转为缓慢性心律失常,并转为间歇性心律失常。未能恢复自主循环,最终死亡。
04 尸检
死后48小时内进行了全面尸检。大体检查发现胸腔积液(20 mL)、心包积液(2 mL)和腹腔积液(15 mL)。胸腔积液和腹腔积液呈轻度淡黄色和浆液性,心包积液呈出血性。
心包弥漫性增厚,外观粗糙。在心外膜和心肌表面发现了一个3×10 mm不规则切口,被认为是破裂的原因(可能是心内注射导致)(下图)。腹部出现轻度至中度皮下水肿,肺泡出现中度水肿。

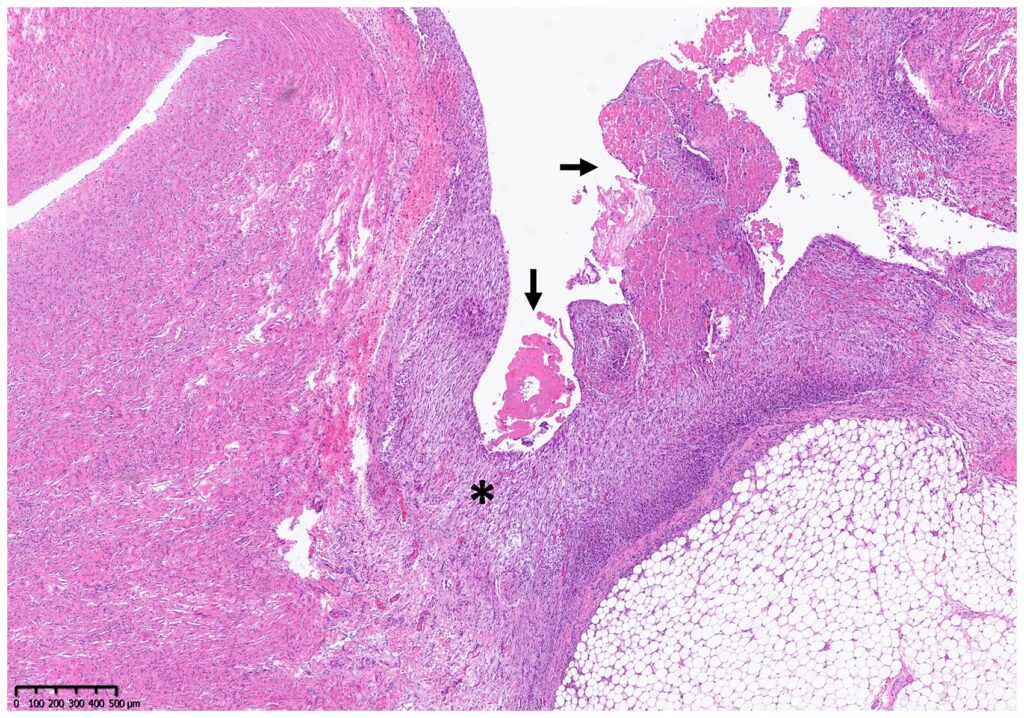
组织学检查显示,患者患有弥漫性慢性活动性心包炎,有突出的肉芽组织形成、部分中性粒细胞浸润、纤维蛋白渗出和少量出血(下图)。肝脏显示轻度至中度急性多灶性肝细胞坏死,多为中心旁坏死。
为了排除是否为猫传染性腹膜炎,对心脏、大脑和肝脏组织进行了猫冠状病毒免疫组化检查,结果呈阴性。
05 讨论
心包炎和心包积液是猫科动物中罕见的疾病[1]。猫传染性腹膜炎[2,3]、充血性心力衰竭[4]、肿瘤(如淋巴瘤[5]或肉瘤[6])以及炎症性疾病[7]都是导致心包积液的潜在原因。此外,心肺复苏,尤其是心内注射是已知的对犬心脏和心包造成先天性损伤的危险因素,有可能导致心包积液[8]。
心包炎可能与细菌感染[9-11]、猫传染性腹膜炎[2]、异物移位[12,13]、嗜酸性粒细胞过多综合征[14]、淋巴瘤[15]和腹膜心包膈疝修补术[16]等疾病有关。心包炎可以是渗出性的,也可以是缩窄性的。不过,在人类和兽医领域还发现了一种混合型心包炎,即渗出性-缩窄性心包炎(ECP)[17-19]。
据报道,ECP在人类心包炎中并不常见,发病率为1.3%-14.8%[20]。人类最常见的病因是特发性、放疗后、结核性心包炎和肿瘤性疾病[21]。在兽医学中,有关ECP的报告很少见。
第一份病例报告发表于1996年,描述了一只继发于心包骨化增生的渗出性-缩窄性心包疾病的狗[18]。Heinritz等人[19]发表了一篇17只狗的ECP系列病例,这些狗继发于粗球孢子菌(Coccidioides immitis)感染。Woolley等人[22]发表了一篇7岁杰克罗素梗犬的病例报告,该犬腹水病史长达5周,第二年被诊断为ECP。
猫心包炎的主要感染原因是猫传染性腹膜炎,但通过对多个组织样本进行免疫组化检查,本病例排除了这一可能性。细菌感染或败血症等其他感染性疾病也可能导致心包炎,但在本病例中这种可能性不大。
虽然没有进行血液培养,但这只小猫的临床(血压正常、体温正常、心率正常、呼吸正常、粘膜呈粉红色)、实验室(白细胞计数正常,无左移、血清淀粉样蛋白A偏低、胆红素浓度正常)和死后检查结果都不符合败血症患者的特征。
由于该猫接受了心肺复苏术和心包穿刺术,因此不能排除外伤的可能。由于死后检查发现了慢性心包炎的迹象,这只猫在转诊前就有可能患有临床意义不明的慢性心包炎,而在心肺复苏术后的几天里,心内注射又导致了反复出血,临床症状恶化并出现心包填塞。
总之,本病例是一只3个月小猫在心肺复苏术(包括心内注射)成功后转诊的病例。患者表现出反复出血性心包积液以及右侧心功能受损的体征,心包穿刺术间隔期为心血管稳定期。
尽管对患者进行了严密的临床观察和定期的超声复查,但患者的临床症状再次迅速恶化,最终导致再次心肺骤停,并最终死亡。患者的临床表现和病理结果均提示其为缩窄性心包炎合并复发性心包积液。
这些渗出物是与心内注射后持续出血有关,还是可能由ECP引起的,目前仍不得而知,本病例强调了颈静脉评估、CVP测量、超声心动图和心导管检查等诊断方法在猫复发性心包积液检查中的重要性。
文献来源:Weingand N, He C, Grau-Roma L, Adamik KN. Chronic pericarditis and recurrent pericardial effusion of unknown origin in a kitten: a case report. Front Vet Sci. 2024 Jun 17;11:1347083.
参考文献
1. Ware WA. Pericardial disease In: Silverstein DC, Hopper K, editors. Small Animal Critical Care Medicine. St Louis: Elsevier; (2023). 271–8.
2. Araujo GA, Matta EC, Lallo MA, Machado GF, Rocha PRD. Epicarditis in a cat caused by feline infectious peritonitis virus: case report. Arq Bras Med Vet Zootec. (2020) 72:823–6.
3. Kim J, Kim Y, Choi J, Yoon J. Ante-mortem diagnosis of an atypical mixed form of feline infectious peritonitis through pericardial effusion analysis in a cat. J Veterin Clin. (2023) 40:308–13.
4. Davidson BJ, Paling AC, Lahmers SL, Nelson OL. Disease association and clinical assessment of feline pericardial effusion. J Am Anim Hosp Assoc. (2008) 44:5–9.
5. Zoia A, Hughes D, Connolly DJ. Pericardial effusion and cardiac tamponade in a cat with extranodal lymphoma. J Small Anim Pract. (2004) 45:467–71.
6. Stone MD, Davies RK, Kridel HA. Pericardial effusion secondary to epicardial undifferentiated pleomorphic sarcoma in a young cat. J Feline Med Surg Open Rep. (2023) 9:205511692311624.
7. Wheatley MA, Shamoun J, Maggi R, Breitschwerdt EB, Sommer SL, Cullen JM, et al.. Eosinophilic pericardial effusion and pericarditis in a cat. J Feline Med Surg Open Rep. (2023) 9:20551169231213498.
8. Quesada J, Londoño L, Buckley GJ, Dark MJ, Colee JC, Farina LL. Retrospective study of gross and histopathologic lesions associated with closed chest cardiopulmonary resuscitation in dogs. J Small Anim Pract. (2021) 62:750–5.
9. Leblanc N, Scollan KF. Bacterial pericarditis in a cat. J Feline Med Surg Open Rep. (2015) 1:205511691560307.
10. Tagawa M, Kurashima C, Shimbo G, Omura H, Koyama K, Horiuchi N, et al.. Fibrinous pericarditis secondary to bacterial infection in a cat. J Vet Med Sci. (2017) 79:957–61.
11. White M, Miller R, Locquet L. Bacterial pericarditis associated with a hepatic abscess in a cat. J Feline Med Surg Open Rep. (2023) 9:20551169231208896.
12. Denroche K, Fox PR, Prittie J, Crecraft C. Septic pericarditis caused by a migrating grass awn in a cat. J Vet Cardiol. (2021) 36:14–9.
13. Bahlmann KN, Kennedy CR, Bandt C. Septic pericardial disease and mediastinal abscessation in a cat with an intrathoracic needle foreign body. J Vet Emerg Crit Care. (2022) 32:670–4.
14. Prado Checa I, Woods GA, Oikonomidis IL, Paris J, Culshaw GJ, Martinez Pereira Y, et al.. Eosinophilic pericardial effusion in a cat with complex systemic disease and associated peripheral eosinophilia. J Vet Cardiol. (2021) 35:55–62.
15. Amati M, Venco L, Roccabianca P, Santagostino SF, Bertazzolo W. Pericardial lymphoma in seven cats. J Feline Med Surg. (2014) 16:507–12.
16. Murphy LA, Russell NJ, Dulake MI, Nakamura RK. Constrictive pericarditis following surgical repair of a peritoneopericardial diaphragmatic hernia in a cat. J Feline Med Surg. (2014) 16:708–12.
17. Hancock EW. Subacute effusive-constrictive pericarditis. Circulation. (1971) 43:183–92.
18. Wright KN, DeNovo RC, Jr, Patton CS, Sackman JE, Wilkens B, Gompf RE. Effusive-constrictive pericardial disease secondary to osseous metaplasia of the pericardium in a dog. J Am Vet Med Assoc. (1996) 209:2091–5.
19. Heinritz CK, Gilson SD, Soderstrom MJ, Robertson TA, Gorman SC, Boston RC. Subtotal pericardectomy and epicardial excision for treatment of coccidioidomycosis-induced effusive-constrictive pericarditis in dogs: 17 cases (1999-2003). J Am Vet Med Assoc. (2005) 227:435–40.
20. Sagristà-Sauleda J, Angel J, Sánchez A, Permanyer-Miralda G, Soler-Soler J. Effusive-constrictive pericarditis. N Engl J Med. (2004) 350:469–75.
21. Miranda WR, Oh JK. Effusive-constrictive pericarditis. Cardiol Clin. (2017) 35:551–8.
22. Woolley RM, Devine CB, French AT. Left ventricular flow propagation using color M-mode echocardiography in the diagnosis of effusive-constrictive pericardial disease. Veterin Radiol Ultrasound. (2006) 47:366–9.