
| 一般情况 | |
|---|---|
 | 品种:贵宾犬 |
| 年龄:8岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:颅内肿物 | |
01 主诉及病史
6周前,主人发现左眼出现眼球混浊,2周后右眼也出现眼球混浊,导致双眼失明。
02 检查
体重5.7千克。精神状态、身体姿势、步态和本体感觉均正常。血液化验(包括全血细胞计数、血清化学和电解质)和胸片检查均未发现异常。
除了右眼的直接对光反射呈阳性以及从右眼到左眼的一致对光反射呈阳性外,双眼的其他测试均呈阴性。双眼的角膜反射、眼睑反射和眼前庭反射均正常。
右眼眼压为14 mmHg,左眼眼压为15 mmHg。裂隙灯生物显微镜检查和眼部超声检查未发现可导致视力受损的眼内异常。
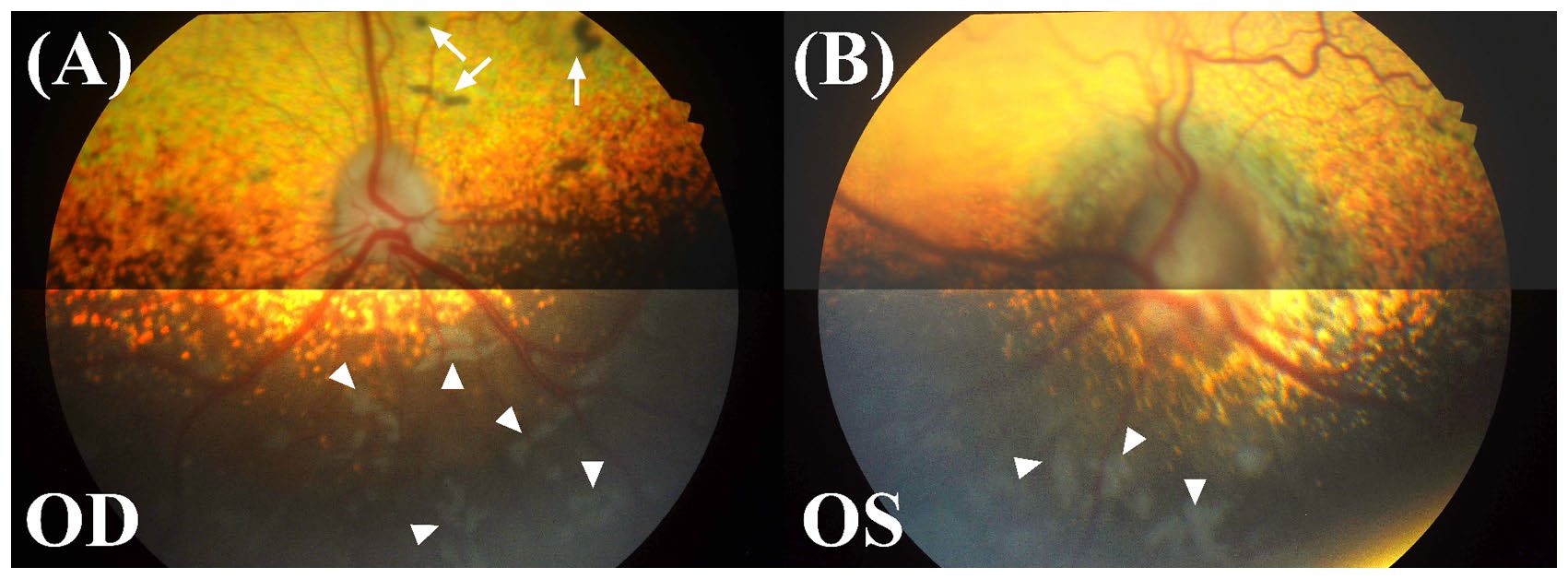
眼底病变的评估采用了带20屈光度镜片的双眼间接眼底镜和数字眼底照片。在右眼眼底观察到多灶性色素沉着区和几个色素斑,其中一些周围有暗淡的反射区,边界模糊。其他特征,如血管迂曲度和直径、整体锥体反射率和视盘形状均正常(下图A)。左眼眼底也有多灶性色素沉着区。左眼视网膜静脉血管迂曲增加。左眼视盘比右眼大,肿胀明显,边缘模糊,没有清晰的视杯或生理凹陷。此外,虹膜周围视网膜色调较暗,显得模糊不清(下图B)。
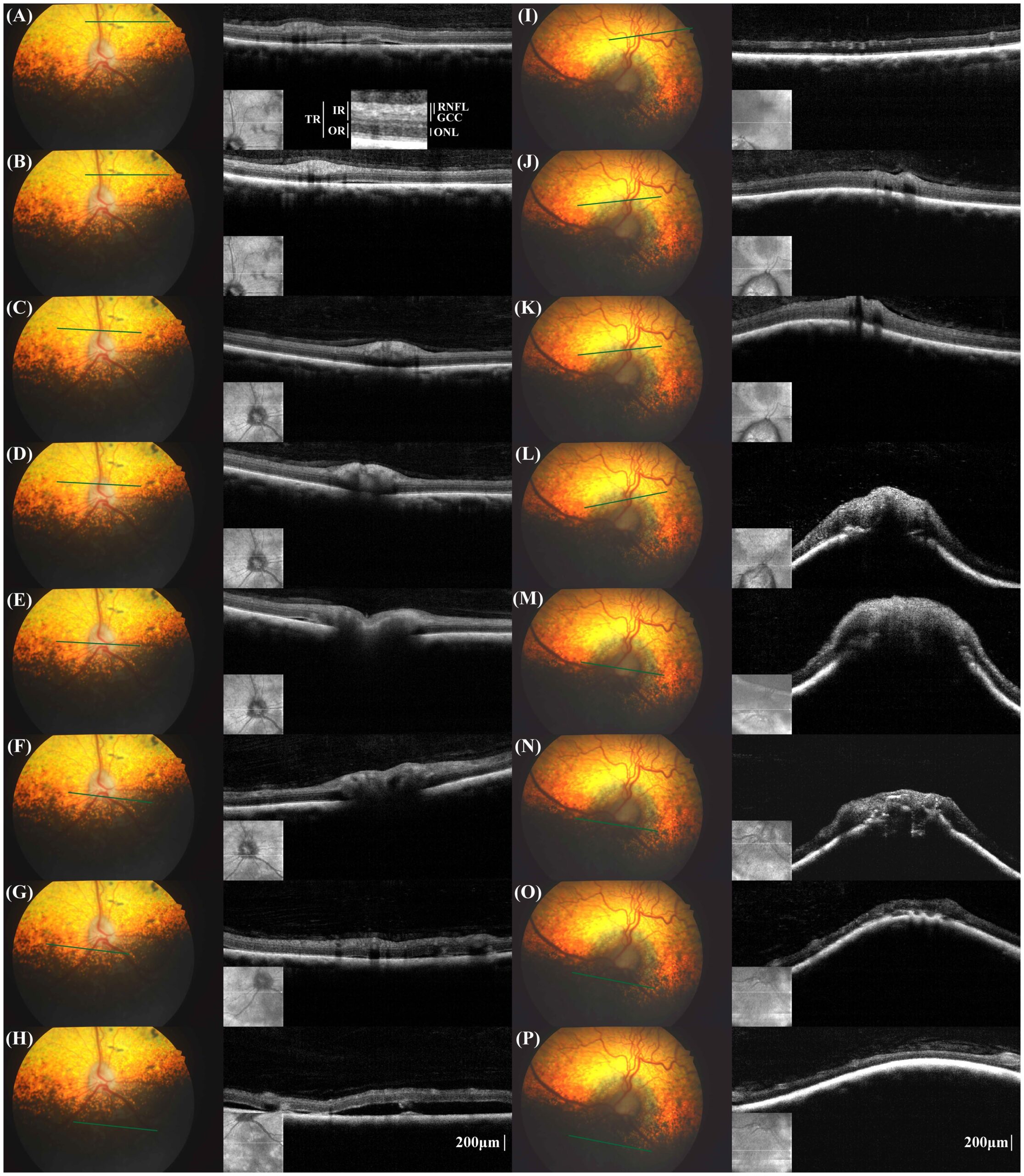
光学相干断层扫描(OCT) 显示在视网膜上部,左眼视网膜内层(包括视网膜神经纤维层和神经节细胞复合体)的厚度比右眼薄。在视网膜下部,左眼视网膜各层的厚度均比右眼薄。然而,由于且图像质量较低,某些位置的测量结果不一致,因此无法得出统计结论。
右眼视网膜上部和虹膜周围区域出现多个小的视网膜脱离,每个宽度约为0.5-2 mm(下图A-G)。但在视网膜下部,发现了一个超过6×6 mm的大面积视网膜脱离(下图H)。左眼的视网膜上皮和毛细血管周围布鲁氏膜出现严重的前部变形(下图I-P)。左眼视网膜下部有两个局部视网膜脱离区域,每个宽约2 mm。
经过20分钟的暗适应后,在静脉注射10 μg/kg盐酸美托咪啶镇静剂的情况下,记录了对3 cd s/m2单次明亮刺激的视网膜电图。视网膜电图显示双眼的a波和b波均正常。然而,左眼的视网膜电图a波和b波振幅比右眼略低(左眼a波84.50 μV,b波188.50 μV;右眼a波139.00 μV,b波225.00 μV)。
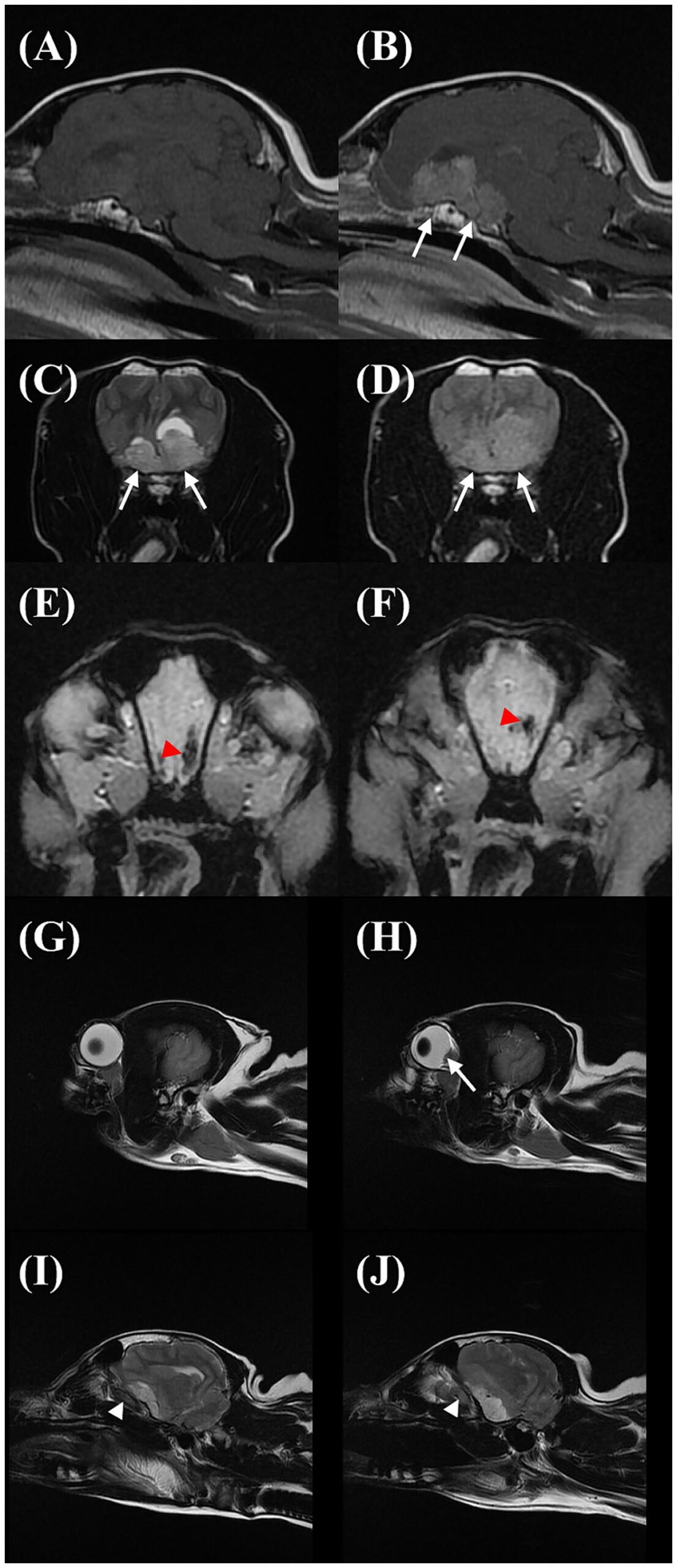
全麻下进行了脑部MRI扫描。显示鞍上区域有一个不规则的宽基底肿块,最小长度为2.68 cm,高度为1.42 cm,宽度为2.34 cm(下图AB)。在T2W、FLAIR和T2*图像上,肿块与灰质呈异质高密度,在T1W图像上呈等密度至低密度,并呈中度对比增强(下图B)。肿块与垂体前侧相连,但垂体后侧在T1W图像上显示正常的高信号。肿块使第三脑室向背侧移位,并导致大脑镰轻度右移(下图CD),同时还观察到横隔脑疝。在肿块实质周围发现一个界限清晰的病灶。在肿块最左侧,T2W和T1W呈灰质低密度,FLAIR呈低密度,中度对比增强。T2*序列可见信号空洞伪影,提示出血(下图EF)。肿块边缘的FLAIR图像上有轻度高密度,可能代表间质水肿。观察到后巩膜变平(下图GH)。左侧视神经鞘直径比右侧轻度增大(右侧2.4 mm,左侧3.0 mm;下图IJ)。
初步诊断为巨大、宽基底的鞍上肿块,伴有颅内压升高和脑出血。
03 预后
患者拒绝接受治疗和后续评估。
1年后,通过电话与主人进行了随访,结果表明这只狗仍然失明,但还活着,没有出现其他神经症状。
04 讨论
视乳头水肿是一个专业术语,用于描述颅内压升高引起的视盘水肿[1,2]。颅内压升高会导致颅内和眶内蛛网膜下腔的脑脊液压力升高,从而改变层间压力梯度。这种压力变化会影响轴浆流动,最终导致轴突和椎间盘肿胀[1,3]。
在人类中,特发性颅内高压是导致乳头水肿的最常见原因[3]。此外,视乳头水肿可由多种病因引起,包括空间占位性病变、脑脊液生成过多、脑脊液流出减少、脑静脉引流受损和颅腔缩小[3]。
在人类脑肿瘤患者中,乳头水肿的发生率高达15%,但发生率会因肿瘤类型而异[3,4]。兽医文献中有关视乳头水肿的报道很少。现有的有限研究表明,视乳头水肿主要与脑肿瘤有关,其发生率各不相同,在受脑肿瘤影响的犬中,视乳头水肿的发生率高达50%[5-8]。
在人类中,如何将真正的视乳头水肿与其他原因(如假性视乳头水肿)引起的视盘肿胀区分开来一直是一个巨大的挑战[3]。弗里森量表是一种标准化的分期系统,用于根据眼科视网膜征象对人类视乳头水肿进行诊断和分类[9,10]。然而,存在局限性,研究人员不得不寻求一种更客观、更准确的诊断方法,如光学相干断层扫描(OCT)进行诊断[3,10,11]。
在临床实践中,如果怀疑是视乳头水肿,通常会通过腰椎穿刺测量压力来评估颅内压[3]。虽然直接测量颅内压是准确可靠的黄金标准,但其侵入性和高昂的费用促使人们开始探索非侵入性的间接方式,如MRI、血管造影术和超声造影术,以评估人类和动物的颅内压[3,7,8,13,14]。
之前的研究表明,MRI的特征(如横隔、枕骨大孔或椎弓根下疝、四脊膜尾部移位、第三脑室受压、椎周水肿、镰刀移位、后巩膜变平/突出以及视神经鞘直径增大)与犬颅内高压有显著相关性[7,8,13]。虽然没有直接测量颅内压,但在本病例中发现了上述6种MRI推定颅内高压的标志性特征。因此有理由推测本患者确实出现了颅内压升高。
OCT在精确区分人类视乳头水肿和其他形式的视盘肿胀(如假性视乳头水肿)方面的作用已得到证实。OCT特征包括视网膜神经纤维层增厚、视神经头体积膨胀和毛细血管周围布鲁氏膜前部变形[10,11,15-17]。
在人类视乳头水肿的早期阶段,神经节细胞层或复合体保持相对正常[16,17]。然而,随着病情的发展,轴突丢失会导致视网膜神经纤维层和神经节细胞层厚度的减少。值得注意的是,假性眼底水肿不会出现这些变化[11,16,17]。
在本病例中,左眼的神经节细胞层和视网膜神经纤维层厚度较薄。鉴于患者左眼在6周前丧失视力,且脑肿瘤侵犯了视交叉,神经节细胞层和视网膜神经纤维层变薄可能是由于慢性乳头水肿和/或视神经损伤导致的神经元损失。
在虹膜周围区域,视网膜神经纤维层与相邻层没有明显的分离。在人体中,OCT设备通常无法分辨严重视乳头水肿的视网膜神经纤维层,据推测,这是由于视网膜水肿导致视网膜层紊乱造成的[11,16]。相反,在严重视神经萎缩的病例中,视盘水肿不会发生,因为在这种情况下,视神经乳头内没有完整的轴突残留[1,4]。在OCT图像上精确划分视网膜神经纤维层是一项相当大的挑战,即使在正常狗身上也是如此[18],而视网膜水肿的存在可能进一步加剧了这一困难。
总之,本病例的OCT结果有力地证明了不对称视乳头水肿,尤其是在疾病的晚期。值得注意的是,迄今为止,兽医学中关于视乳头水肿的报告很少,而且没有客观的诊断标准。因此,相信本报告能为犬视乳头水肿的诊断提供更详细的眼底和OCT 诊断依据。
文献来源:Cho H, Choi M, Yoo S, Jeong M, Park SA. Case report: Unilateral papilledema in a dog with a large suprasellar mass and suspected intracranial hypertension: insights from funduscopy, optical coherence tomography, and magnetic resonance imaging. Front Vet Sci. 2024 Jun 12;11:1372802.
参考文献
1. Hayreh SS. Pathogenesis of optic disc edema in raised intracranial pressure. Prog Retin Eye Res. (2016) 50:108–44.
2. Tao B, Vosoughi A, Margolin E, Micieli JA. Inappropriate use of the term “papilledema” in the medical literature: a systematic review of case reports across specialties. Ophthalmology. (2023) 130:129–36.
3. Xie JS, Donaldson L, Margolin E. Papilledema: a review of etiology, pathophysiology, diagnosis, and management. Surv Ophthalmol. (2022) 67:1135–59.
4. Donaldson L, Margolin E. Absence of papilledema in large intracranial tumours. J Neurol Sci. (2021) 428:117604.
5. Palmer AC, Malonowski W, Barnett KC. Clinical signs including papilloedema associated with brain tumors in twenty-one dogs. J Small Anima Pract. (1974) 15:359–86.
6. Davidson MG, Nasisse MP, Breitschwerdt EB, Thrall DE, Page RL, Jamieson VE, et al. Acute blindness associated with intracranial tumors in dogs and cats: eight cases (1984–89). J Am Vet Med Assoc. (1991) 199:755–8.
7. Bittermann S, Lang J, Henke D, Howard J, Gorgas D. Magnetic resonance imaging signs of presumed elevated intracranial pressure in dogs. Vet J. (2014) 201:101–8.
8. Giannasi S, Kani Y, Hsu FC, Rossmeisl JH. Comparison of direct measurement of intracranial pressures and presumptive clinical and magnetic resonance imaging indicators of intracranial hypertension in dogs with brain tumors. J Vet Intern Med. (2020) 34:1514–23.
9. Frisén L. Swelling of the optic nerve head: a staging scheme. J Neurol Neurosurg Psychiatry. (1982) 45:13–8.
10. Scott CJ, Kardon RH, Lee AG, Frisén L, Wall M. Diagnosis and grading of papilledema in patients with raised intracranial pressure using optical coherence tomography vs. clinical expert assessment using a clinical staging scale. Arch Ophthalmol. (2010) 128:705–11.
11. Sibony PA, Kupersmith MJ, Kardon RH. Optical coherence tomography neuro-toolbox for the diagnosis and management of papilledema, optic disc edema, and pseudopapilledema. J Neuroophthalmol. (2021) 41:77–92.
12. Ekesten B, Komáromy AM, Ofri R, Petersen-Jones SM, Narfström K. Guidelines for clinical electroretinography in the dog: 2012 update. Doc Ophthalmol. (2013) 127:79–87.
13. Scrivani PV, Fletcher DJ, Cooley SD, Rosenblatt AJ, Erb HN. T2-weighted magnetic resonance imaging measurements of optic nerve sheath diameter in dogs with and without presumed intracranial hypertension. Vet Radiol Ultrasound. (2013) 54:263–70.
14. Ilie LA, Thomovsky EJ, Johnson PA, Bentley RT, Heng HG, Lee HC, et al. Relationship between intracranial pressure as measured by an epidural intracranial pressure monitoring system and optic nerve sheath diameter in healthy dogs. Am J Vet Res. (2015) 76:724–31.
15. Gampa A, Vangipuram G, Shirazi Z, Moss HE. Quantitative association between peripapillary Bruch’s membrane shape and intracranial pressure. Invest Ophthalmol Vis Sci. (2017) 58:2739–45.
16. OCT sub-study committee for the NORDIC idiopathic intracranial hypertension study. Baseline OCT measurements in the idiopathic intracranial hypertension treatment trial, part I: quality control, comparisons, and variability. Invest Ophthalmol Vis Sci. (2014) 55:8180–8.
17. Jivraj I, Cruz CA, Pistilli M, Kohli AA, Liu GT, Shindler KS, et al. Utility of spectral-domain optical coherence tomography in differentiating papilledema from pseudopapilledema: a prospective longitudinal study. J Neuroophthalmol. (2021) 41:e509–15.
18. Bemis AM, Pirie CG, LoPinto AJ, Maranda L. Reproducibility and repeatability of optical coherence tomography imaging of the optic nerve head in normal beagle eyes. Vet Ophthalmol. (2017) 20:480–7.