
| 一般情况 | |
|---|---|
 | 品种:苏格兰折耳猫 |
| 年龄:8个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:肝血管错构瘤 | |
01 主诉及病史
因腹胀和间歇性呼吸困难1个半月就诊。临床症状包括嗜睡、轻微呼吸困难、粘膜苍白和腹胀,并在1周前加重。由于出现了腹腔积液,之前在另一家诊所接受了猫冠状病毒实时PCR检测,结果呈阴性。
患者是室内猫,使用市售的均衡饲料喂养,接种了疫苗并进行了定期驱虫。
02 检查
体重3千克。体格检查发现腹部明显胀大,触诊腹部时有剧烈疼痛,呼吸困难,体温正常,粘膜苍白,毛细血管再充盈时间延长(超过2秒)。
肺部听诊显示两侧肺部有轻微啰音,呼吸频率为48次/分。心脏听诊显示左心收缩期杂音响亮(4/6级),心率210次/分,股动脉脉搏规律且运动减弱。血压40 mmHg(袖带-足背动脉)。
严重贫血:红细胞3.91×10^12 [5.65-8.87],血细胞比容15.1% [26.0-49.0%],血红蛋白5.0 g/dL [13.1-20.50]。肝酶升高(ALT超过84 μ/L [10-84],碱性磷酸酶71 U/L [8-59]),低蛋白血症(总蛋白3.7 g/dL [5.7-7.8]、ALB 1.7 g/dL [2.3-3.5])、低球蛋白血症(球蛋白2.0 g/dL [2.7-5.2])和轻度氮质血症(血尿素氮53.5 mg/dL [17.6-32.8])。轻度低钠血症(145 mEq/L [147-156])。
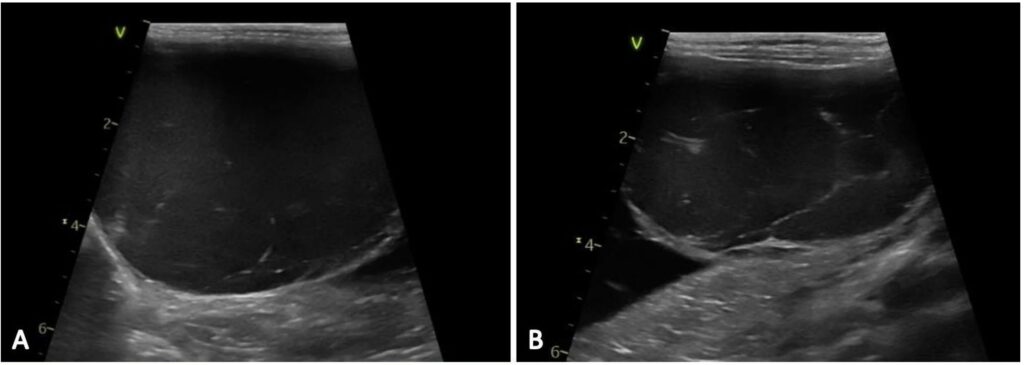
腹部超声显示肝实质萎缩,边界规则,回声不均,肝脏多发性无回声囊性肿块,边界不清,占据了近一半的腹部,其中一个靠近尾状叶,直径为8.0/5.0 mm,第二个与膈肌接触,直径为5.0/4.5 cm,第三个囊性病变直径为4.8/4.5 mm,位于肝脏左侧(靠近左叶内侧)。第一个囊样结构形状不规则、壁薄、充满液体,另外两个肿块无回声,内部有薄隔膜(下图)。这些形态特征提示了三种鉴别诊断:囊肿、血肿或脓肿。腹部没有其他异常,但胃肠道和胰腺因肝脏肿块而移位至腹部尾部。
在输血、吸氧、使用正性肌力药物和止血药物(去甲肾上腺素0.3 μg/kg/min、酸性氨甲环酸10 μg/kg)稳定病情后,医生建议对肝脏囊性肿块进行手术切除。
手术前进行了超声心动图检查,显示左心室壁弥漫性肥厚,主动脉下区域更为突出,左心房中度扩大,被诊断为肥厚型梗阻性心肌病,分类为B2级,属于ASA III级麻醉风险患者。
03 手术
麻醉前静脉注射美沙酮0.2 mg/kg、芬太尼3 μg/kg、丙泊酚1 mg/kg。使用异氟醚1-2%、芬太尼3 μg/kg/h/IV、氯胺酮10 μg/kg/min/IV、去甲肾上腺素0.2 μg/kg/min、乳酸林格氏液5 mL/kg/h进行麻醉。
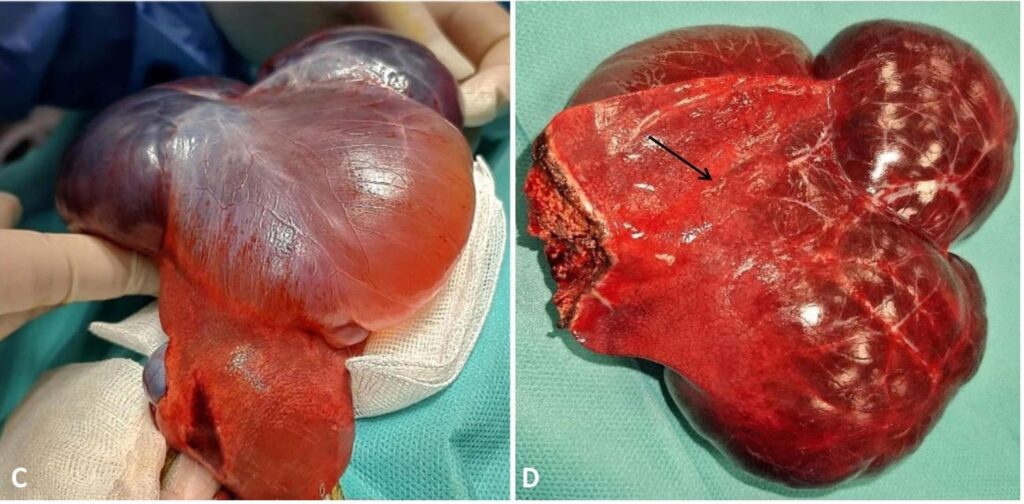
取背卧位,进行腹中线切开术。牵开网膜后,一个多叶囊肿样结构暴露出来(下图C)。囊性结构来自肝脏右内叶。在右内侧叶靠近血管蒂处进行了结扎缝合,并进行了肝叶部分切除(下图D)。按照标准程序进行腹部缝合,样本送往实验室进行组织病理学检查。
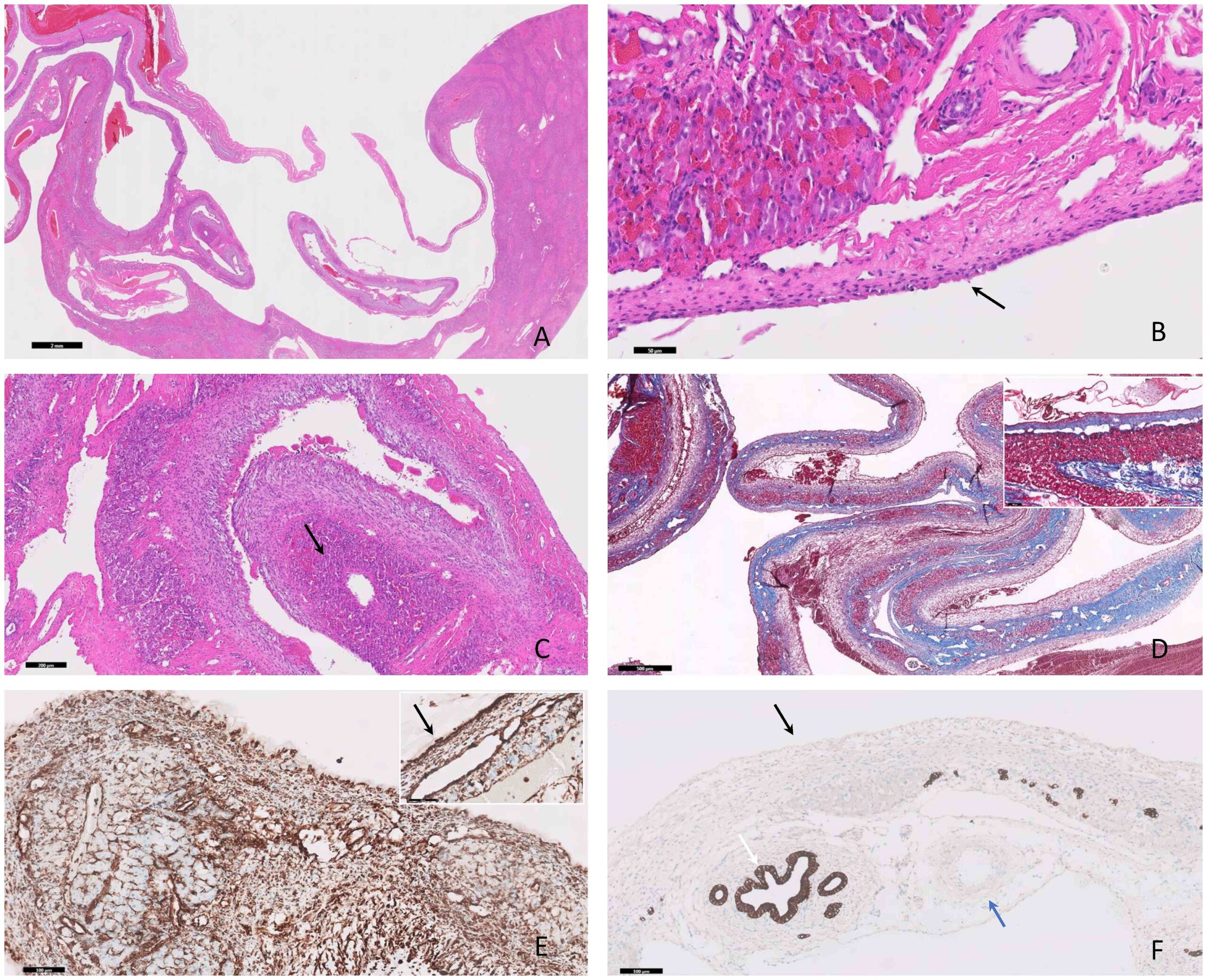
显微镜下,肝脏右内侧叶被三个膨胀、界限清楚、无包膜的红褐色囊样结构撑大。三个区域之间没有沟通。相邻的实质受到囊性结构的机械压迫和萎缩。在切片上,肝脏肿块由多个充血空隙组成,偶尔含有纤维蛋白条。
从组织学角度看,肝实质被一个界限清晰、扩张性、无包膜的空洞肿块局部压迫(下图A),该肿块由大小不一的血道组成。血管腔内偶尔会出现纤维状至均质嗜酸性物质(纤维蛋白),嵌入红细胞和白细胞(血栓)。血管间隙符合分化良好的大小不等的动脉和静脉(下图B)。囊性结构中夹杂着小簇肝细胞,其中混杂着纤维组织,由紧密排列的成纤维细胞和大量胶原纤维组成(下图CD)。肝细胞轻度空泡变性和萎缩,胆管中度增生。免疫组化结果显示,间隙的内衬细胞(可理解为内皮细胞)表现出强烈的弥漫性细胞质波形蛋白阳性(下图E)和PanCK阴性免疫表达(下图F)。
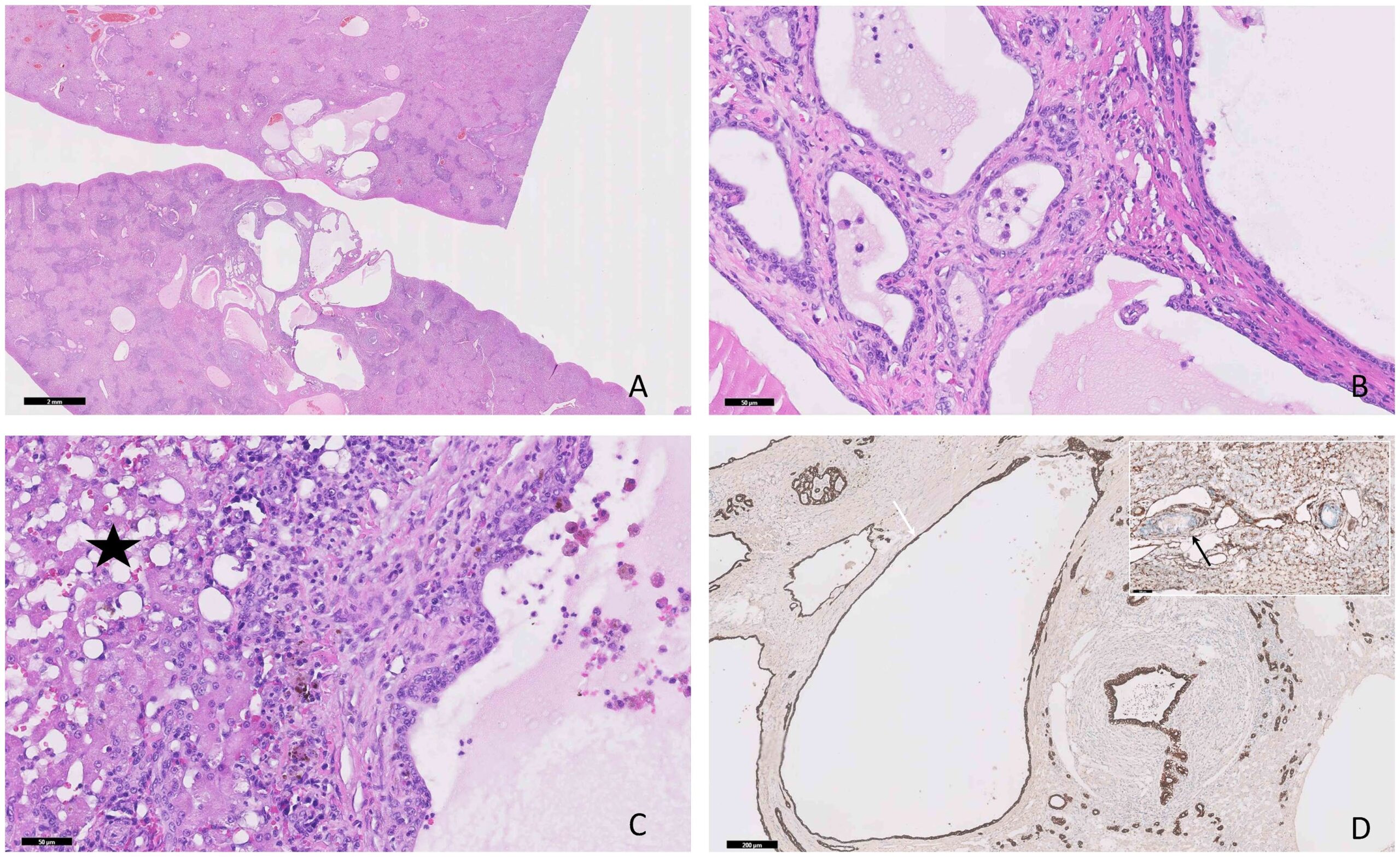
从另一例猫胆管错构瘤(12岁猫)中获得的组织样本也被纳入组织学和免疫组化对比分析中,做出这一决定的原因是猫的胆管错构瘤发病率较高。
相比之下,12岁猫的胆管错构瘤(下图A)的囊性结构中含有淡嗜酸性均质物质,内衬为单层立方体至扁平上皮细胞(下图B),显示出强烈的弥漫性细胞质PanCK阳性(下图D)和波形蛋白阴性。邻近的实质细胞呈中度退行性改变,伴有中度炎症浸润,由淋巴细胞和浆细胞组成,并混有适量纤维组织(下图C)。
04 预后
在术后2周的随访中,ALT水平仍升高至180 μ/L,而红细胞(8.04×10^12)、血细胞比容(39.8%)和血红蛋白(14.1 g/dL)水平均在正常范围内。
2个月后,ALT值恢复正常,为76 μ/L,红细胞(8.50×10^12)、血细胞比容(38.8%)和血红蛋白(12.6 g/dL)值均正常。未发现腹痛、腹胀、肝包块复发或其他临床症状。
05 讨论
增生性血管疾病目前分为血管畸形、反应性血管增生、边缘性肿瘤病变和源自血管组织的肿瘤病变。血管畸形由分化良好的细胞组成,但血管结构紊乱。在这一分类中,有两个难以区分的病变:一个是以发育畸形为代表的错构瘤,另一个是一些良性肿瘤[1]。
错构瘤指的是无序的血管组织的灶性增生,通常在出生时就存在,随着器官的成熟而停止发育[2]。它们可能出现在各种器官中,被认为是介于血管畸形和肿瘤之间的病变。
据报道,猫的中枢神经系统[3,4]、鼻腔[5]、椎管[6,7]、牙龈[8]和下颌骨[9]中都有错构瘤。在兽医领域,也有三只狗[10-12]和一头牛[13]患肝血管错构瘤的报道。
肝血管错构瘤在人类中很少见,主要发生在幼儿身上[14]。以往还没有猫患肝血管错构瘤的病例。本病例报告首次描述了猫肝血管错构瘤的临床表现和病理特征。
先天性血管畸形和肿瘤在动物中并不常见,通常发生在妊娠期或出生后最初几个月内[15]。在人类医学中,国际血管畸形研究学会推出了一套新的血管病变分类系统,然而在人类医学和兽医学中,区分血管肿瘤和血管畸形仍然具有挑战性[16]。
血管畸形可根据内皮起源进行分类,包括动脉、静脉、动静脉、毛细血管、淋巴或联合内皮起源[17]。在肝脏内,主要的血管畸形包括异常的血管连接,特别是门静脉分流和动静脉畸形[18]。
动静脉畸形可因胚胎结构分化失败(先天性),也可因损伤或肿瘤而形成(后天性)。先天性动静脉畸形主要影响年轻人,在兽医学中并不常见。主要临床症状包括门静脉高压,伴有或不伴有腹水。这种情况的特点是高压动脉血管和低压静脉血管之间的沟通。
动静脉畸形通常分为两个阶段:潜伏期和症状期,症状期的特点是逐渐增大。从外观上看,肝脏表面会出现许多迂曲的大血管,主要影响右肝叶和中央肝叶[19]。从组织学角度看,动静脉畸形由大的动脉和静脉组成,通常没有明显的分流。动脉表现出不同的口径、迂曲、增厚的弹性层和不同的碎裂,而静脉则表现出内膜增生、平滑肌增厚和前壁纤维化等变化[20]。
诊断动静脉畸形主要依靠超声、彩色血流多普勒和透视等方法[21,22]。无肝脏受累的血管畸形在不同部位均有报道,包括脊髓[23]、眼眶[24]、四肢[25-30]、耳朵[31]和胃肠道[32]。
虽然本病例与动静脉畸形在年龄、受影响的实质区域和一些组织学特征(如动脉和静脉增生)方面存在相似之处,但差异也很明显。从宏观上看,观察到的是囊性结构,而不是典型的迂曲血管外观,也没有发现动脉和静脉之间的沟通。不过,由于没有进行多普勒分析,这一观察结果的准确性可能会受到影响。
在猫中,胆管错构瘤是最常见的肝脏错构瘤,通常作为主要鉴别诊断[33]。肝脏囊样肿块的其他重要鉴别诊断包括先天性胆管扩张(卡洛里氏病)、多囊肝、胆汁囊腺瘤、肝豆状核变性和肝血管肉瘤。
血管肉瘤、血管瘤和肝盂积液也应作为重要的鉴别指标,这主要是由于它们的宏观外观与血管错构瘤相似。
- 血管肉瘤的特征是纺锤形到多角形的肿瘤性内皮细胞增生,形成新的血道。异形细胞和异形核通常为中度至重度,有丝分裂指数高,细胞多核。
- 血管瘤是由一层分化良好的肿瘤性内皮细胞内衬的大的充血空洞组成,没有恶性标准。动静脉血管瘤是血管瘤的一种亚型,以前曾在四肢、口腔、颈部和头部皮下组织等不同部位发现过[48]。从组织学角度看,动静脉血管瘤表现为多个大小不等的血管结构,其中可能包括动静脉吻合,与毛细血管或海绵状结构混杂在一起。目前还没有报道过猫肝血管瘤的病例。
由于兽医学中缺乏对血管畸形的全面组织学分类,因此要对本病例报告中描述的病变进行准确分类很有难度。此外,在没有正式分类系统的情况下,”血管错构瘤”这一称呼将在兽医学中继续存在。
总之,血管错构瘤是动物体内很少见的良性病变,手术切除后预后良好。本病例报告展示了一只猫血管错构瘤的临床、超声、组织病理学和免疫组化结果,术后2个月随访结果良好。在猫狗肝脏囊性病变的鉴别诊断中应考虑血管错构瘤,尤其是右内叶受累时。
文献来源:Negoescu A, Gal C, Bărbulescu A, Vulcan E, Rădulescu A, Cătoi C, Taulescu M. Hepatic vascular hamartoma in a cat: a case report with literature review. Front Vet Sci. 2024 Jun 4;11:1404164.
参考文献
1. Marr J, Miranda IC, Miller AD, Summers BA. A review of proliferative vascular disorders of the central nervous system of animals. Vet Pathol. (2021) 58:864–80.
2. Koestner A. Histological classification of tumors of the nervous system of domestic animals. Washington, D.C.: World Health Organization. (1999): 25–26.
3. Stalin CE, Granger N, Jeffery ND. Cerebellar vascular hamartoma in a British shorthair cat. J Feline Med Surg. (2008) 10:206–11.
4. Martin-Vaquero P, Moore SA, Wolk KE, Oglesbee MJ. Cerebral Vascular Hamartoma in a geriatric cat. J Feline Med Surg. (2011) 13:286–90.
5. Chambers B, Laksito M, Fliegner R, McCowan C, Beck C, Yates G. Nasal vascular hamartoma in a domestic shorthair cat. Aust Vet J. (2010) 88:107–11.
6. Parkes JD, Kline KL, Riedesel EA, Haynes JS. A vascular hamartoma arising from the cervical spine of a cat. J Feline Med Surg. (2009) 11:624–7.
7. Ito D, Shiozawa N, Sekiguchi N, Ishikawa C, Jeffery ND, Kitagawa M. Repeated surgical treatment and long-term outcome of a cat with vertebral vascular hamartoma. J Vet Med Sci. (2020) 82:721–5.
8. Padgett SL, Tillson DM, Henry CJ, Buss MS. Gingival vascular hamartoma with associated paraneoplastic hyperglycemia in a kitten. J Am Vet Med Assoc. (1997) 210:914–5.
9. Takagi S, Kagawa Y, Hanazono K, Murakami S, Deguchi T, Izumi Y, et al.. Mandibular vascular hamartoma in a cat. J Vet Med Sci. (2018) 80:1456–8.
10. McGavin MD, Henry J. Canine hepatic vascular hamartoma associated with ascites. J Am Vet Med Assoc. (1972) 160:864–6.
11. Castellano MC, Idiart JR, Ortega CF, Ruager J. Multiple hepatic angiomatous hamartomas in a puppy. Canine Pract. (1986) 13:30–3.
12. Gualtieri M, Cocci A, Monti S, Olivero D. Surgical removal of a localised vascular hepatic hamartoma in a dog. Aust Vet J. (2009) 87:360–2.
13. Braun U, Trösch L, Gerspach C, Brosinski K, Hilbe M. Ultrasonographic findings in a cow with vascular hamartoma of the liver: case report. BMC Vet Res. (2011) 7:52.
14. Kamata S, Nose K, Sawai T, Hasegawa T, Kuroda S, Sasaki T, et al. Fetal mesenchymal hamartoma of the liver: report of a case. J Pediatr Surg. (2003) 38:639–41.
15. Alamo L, Beck-Popovic M, Gudinchet F, Meuli R. Congenital tumors: imaging when life just begins. Insights Imaging. (2011) 2:297–308.
16. Rochefort J, Lescaille G, Hervé G, Agbo-Godeau S, Mauprivez C. Les malformations lymphatiques de la cavité orale, cas cliniques et revue de littérature. Médecine Buccale Chirurgie Buccale. (2017) 23:51–9.
17. Gloviczki P, Duncan A, Kalra M, Oderich G, Ricotta J, Bower T, et al. Vascular malformations: an update. Perspect Vasc Surg Endovasc Ther. (2009) 21:133–48.
18. Culp WTN, Griffin MA. Interventional radiology management of vascular malformations: portosystemic shunts and vascular fistulae/malformations. Vet Clin North Am Small Anim Pract. (2018) 48:781–95.
19. Mathews KG, Bunch SK. Vascular liver diseases In: Ettinger SJ, Feldman ED, editors. Textbook of veterinary internal medicine: diseases of the dog and cat. 6th ed.
20. Schimmel K, Ali MK, Tan SY, Teng J, Do HM, Steinberg GK, et al. Arteriovenous malformations—current understanding of the pathogenesis with implications for treatment. Int J Mol Sci. (2021) 22:9037.
21. Chanoit G, Kyles AE, Weisse C, Hardie EM. Surgical and interventional radiographic treatment of dogs with hepatic arteriovenous fistulae. Vet Surg. (2007) 36:199–209.
22. Legendre AM, Krahwinkel DJ, Carrig CB, Michel RL. Ascites associated with intrahepatic arteriovenous fistula in a cat. J Am Vet Med Assoc. (1976) 168:589–91.
23. Cordy DR. Vascular malformations and hemangiomas of the canine spinal cord. Vet Pathol. (1979) 16:275–82.
24. Rubin LF, Patterson DF. Arteriovenous fistula of the orbit in a dog. Cornell Vet. (1965) 55:471–81.
25. Culp WT, Glaiberman CB, Pollard RE, Wisner ER. Use of ethylene-vinyl alcohol copolymer as a liquid embolic agent to treat a peripheral arteriovenous malformation in a dog. J Am Vet Med Assoc. (2014) 245:216–21.
26. Ettinger S, Campbell L, Suter PF, DeAngelis M, Butler HC. Peripheral arteriovenous fistula in a dog. J Am Vet Med Assoc. (1968) 153:1055–8.
27. Furneaux RW, Pharr JW, McManus JL. Arterio-venous fistulation following dewclaw removal in a cat. J Am Anim Hosp Assoc. (1974) 10:569–73.
28. Jones DG, Allen WE, Webbon PM. Arteriovenous fistula in the metatarsal pad of a dog: a case report. J Small Anim Pract. (1981) 22:635–9.
29. Tobias KM, Cambridge A, Gavin P. Cyanoacrylate occlusion and resection of an arteriovenous fistula in a cat. J Am Vet Med Assoc. (2001) 219:785–8.
30. Graziano L, Di Paco S, Avallone G, Roccabanca P. Acquired arteriovenous fistula formation following cephalic vein intravenous catheterisation in a cat. JFMS Open Rep. (2019) 5:205511691983185.
31. Kealy JK, Lucey M, Rhodes WH. Arteriovenous fistula in the ear of a dog: a case report. J Small Anim Pract. (1970) 11:15–20.
32. Gelens HC, Moreau RE, Stalis IH, Niebauer GW. Arteriovenous fistula of the jejunum associated with gastrointestinal hemorrhage in a dog. J Am Vet Med Assoc. (1993) 202:1867–8.
33. Naghi R, Bertran J, Spoldi E, Dark MJ, Hauck H, Souza C, et al. Multiple biliary duct hamartomas in a cat resulting in a hepatic mass: a case report. Vet Med Sci. (2023) 9:1441–5.