
| 一般情况 | |
|---|---|
 | 品种:双松狮犬 |
| 年龄:1.5岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:骨折不愈合 | |
01 主诉及病史
在另一家诊所被诊断为右前肢肱骨(桡骨和尺骨)外伤性骨折。已经接受了两次手术,第一次用克氏针对桡骨进行固定,但因克氏针断裂而失败;两个月后用钢板和螺钉进行了第二次固定,但再次出现术后并发症(骨折不愈合)。
第二次术后1个月,因右前肢跛行、肿胀和前肱骨远端剧烈疼痛就诊。
02 检查
体重1.8千克。临床检查、全血细胞计数和血生化均未发现异常。用0.075 mg/kg盐酸美托咪定和7.5 mg/kg盐酸氯胺酮对股四头肌进行肌肉注射深度镇静后,拍摄了X光片。
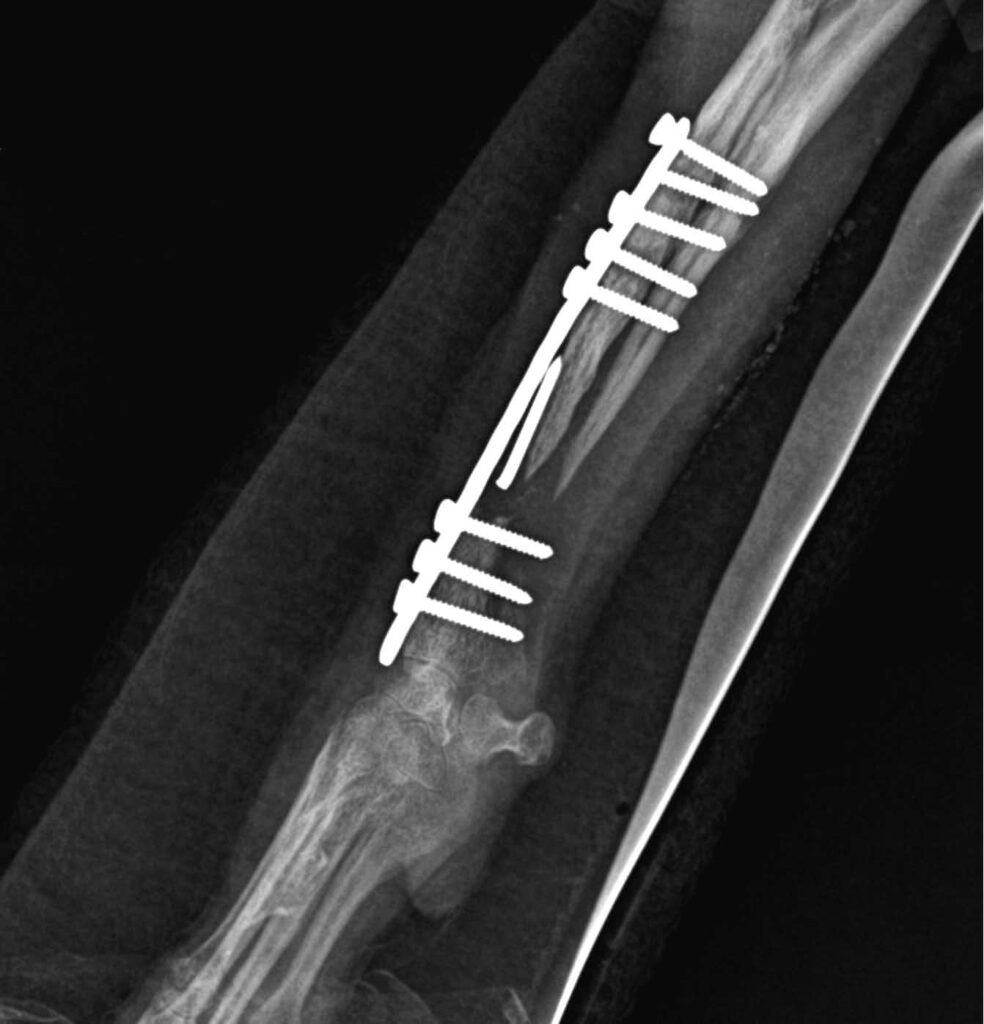
X光片显示钢板和螺钉周围有溶骨区,近端碎片中有部分断裂的克氏针,骨痂稀少,骨折线明显(下图)。骨端萎缩,桡骨近端明显变薄,呈锥形,提示为萎缩性骨折不愈合。在这种骨折不愈合类型中,刺激骨生成的唯一方法是移除钢板螺钉和骨碎片,并进行植骨。
03 手术
为了挽救肢体,进行了第三次手术。由于骨缺损很大(4.7 cm),决定植入从对侧尺骨上采集的自体皮质骨进行移植,并结合浸泡有促红细胞生成素的松质骨自体移植物,以刺激骨生成。
麻醉方案包括0.2 mg/kg马来酸乙酰丙嗪和0.01 mg/kg丁丙诺啡静注预麻醉。间隔30分钟后,静脉注射5 mg/kg丙泊酚进行麻醉诱导。气管插管后,用1.5-2 vol%的异氟醚和100%氧气维持吸入麻醉。液体疗法包括乳酸林格氏液,流速为10 mL/kg/h。
在对肢体进行常规准备并从桡骨远端内侧入路后,将钢板、螺钉和断裂的 克氏针取出。用摆动锯切除桡骨近端和远端。为了确定所需的移植物长度,术中使用卡尺测量了两骨端之间的距离(4.8 сm)。
在获取自体皮质骨移植体时,采用尾侧入路,从对侧尺骨干骺端入路(下图)。钝性剥离皮下组织,然后使用Gelpi牵引器保持牵引。在尺骨和桡骨之间放置了一个Hohmann牵引器,以防止对桡骨造成损伤。
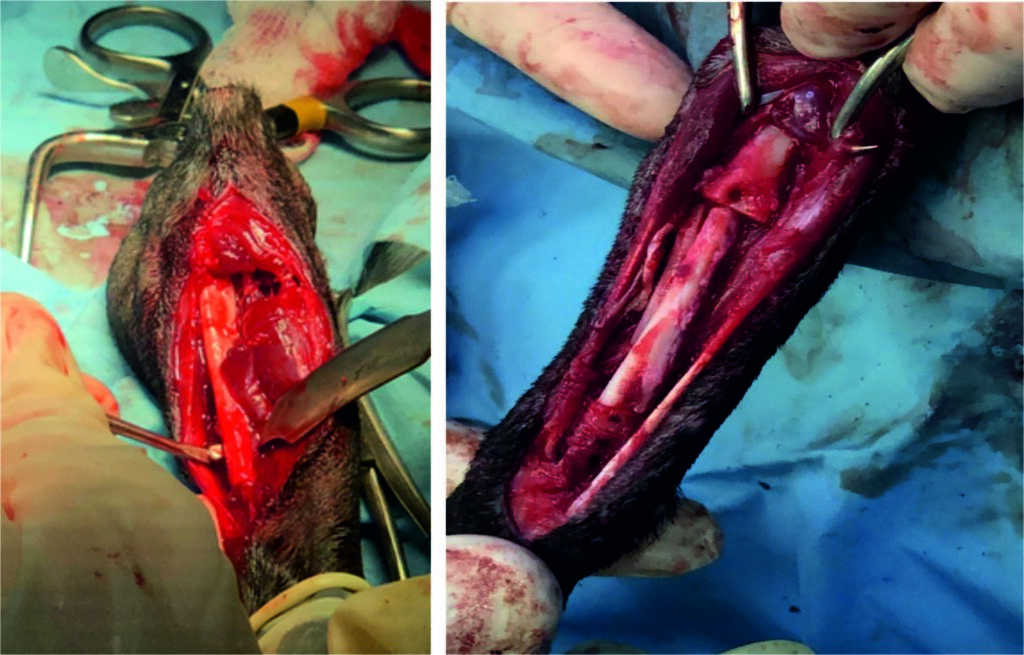
用摆动锯切除尺骨干骺端4.8 cm长的骨段。骨和骨膜被整体切除,并转移到右桡骨的间隙中。在皮质骨自体移植物的两端,应用浸泡有1000 IU重组人促红细胞生成素的松质骨移植物,以优化骨诱导和血管生成。
为了收集松质骨移植物,在大转子颅外侧做一个小切口。用钻头在肱骨近端干骺端钻一个3.5 mm的孔,然后用骨刮刀采集松质骨移植物。然后尽快将其植入受体部位,以减少细胞死亡。
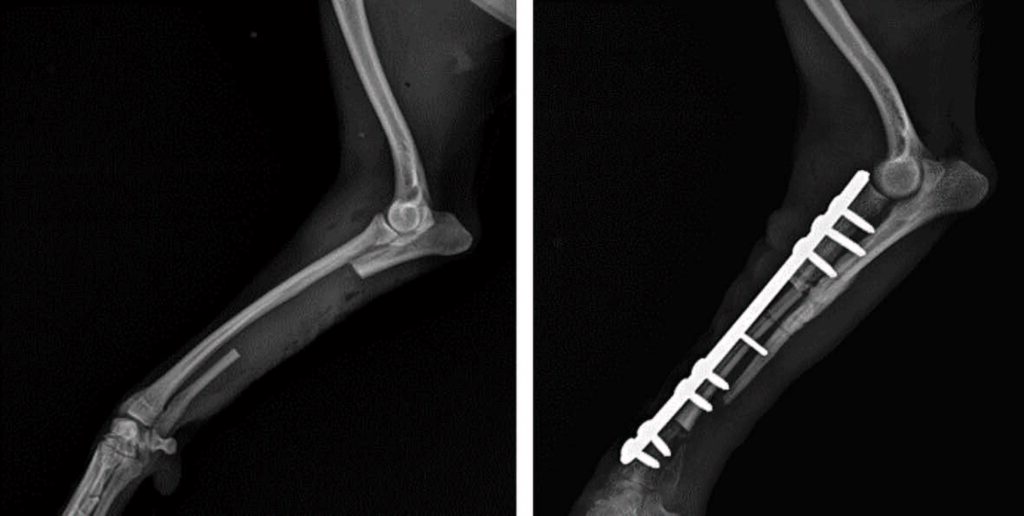
对齐骨片后,用动态加压板(1.5 mm厚)和8颗皮质螺钉固定:桡骨远端骨片2颗,皮质骨移植物3颗,桡骨近端骨片3颗(下图)。用可吸收的单丝缝线缝合皮内层,然后用不可吸收的缝线缝合皮肤。
04 预后
术后被关在笼子里24天。术后疼痛和感染分别通过静脉注射0.3 mg/kg美洛昔康和30 mg/kg头孢曲松得到控制,分别持续输注了3天和7天。
第30天时,患者开始用手术肢体负重,无感染迹象后出院。
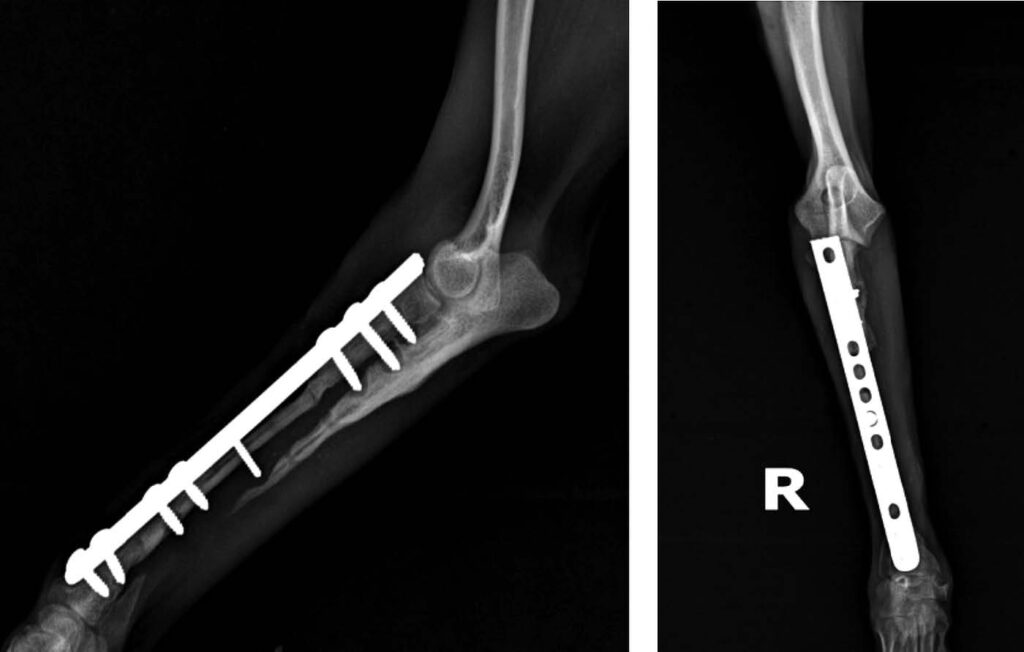
术后第9周复查,肢体负重稳定,无跛行、疼痛和肿胀。放射学检查显示,皮质骨移植物的桥接效果良好,植入物没有松动(下图)。
术后第12周复查,由于放射学检查结果和临床效果良好,皮质骨移植体上的三颗螺钉被移除,只留下近端和远端骨片上的螺钉。
术后第15周,由于临床效果良好,所有植入物均被移除(下图)。
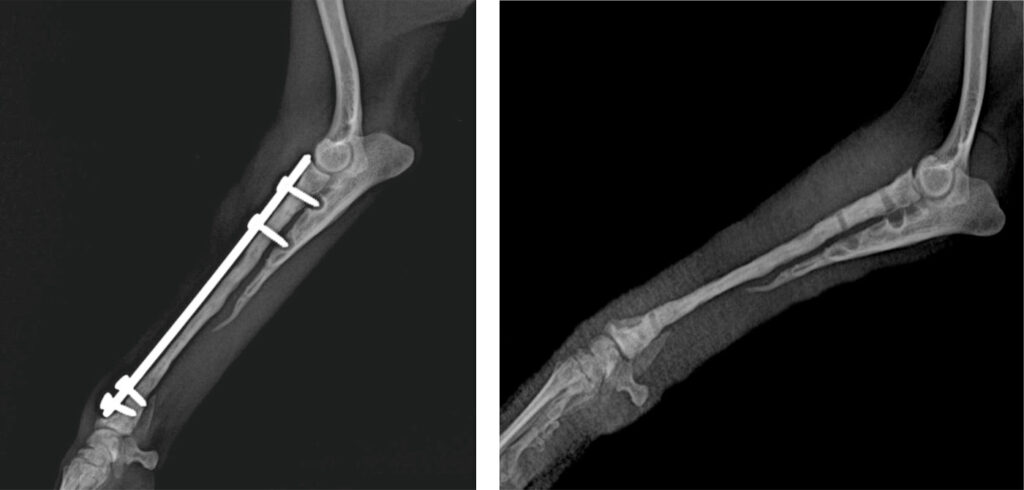
13个月后,主人通过电话报告说这只狗可以行走,没有明显的跛足,他对治疗结果非常满意。
05 讨论
骨折不愈合是犬骨折最严重的并发症之一。据报道,小型犬桡骨骨折的不愈合率高达60%[1],这可能是由于桡骨远端血液供应较差的缘故[2-4]。
手术是所有不愈合骨折的必选治疗方案。在感染未得到控制或骨吸收广泛的情况下,可考虑截肢。另一种选择是应用各种类型的骨移植和/或骨愈合促进剂。
骨移植可加速桥接骨痂的早期形成,促进骨折愈合,并填补骨缺损。由于自体骨具有骨诱导和成骨潜力,因此自体骨移植被认为是金标准治疗方法[4,5]。皮质骨移植物可用于填补大的骨缺损,而松质骨移植物则可用于额外刺激成骨[6]。
有时,在具有所谓临界大小缺损的骨折中,由于自体移植物的固着或吸收,骨移植可能不会顺利愈合。为解决这一问题,人们提出了多种促进成功移植的物质:β-三磷酸钙[7]、重组人骨形态发生蛋白-2[8]和富血小板血浆[9,10]。
促红细胞生成素是一种生长因子,对造血祖细胞和干细胞的分化和增殖具有重要作用[11]。越来越多的骨科研究证实,促红细胞生成素还具有成骨和血管生成特性[12]。独立应用可改善骨愈合,刺激成骨细胞分化、新血管生长和骨折部位矿化[13]。将促红细胞生成素与骨移植物结合可加快移植物与宿主骨的融合[14]。
对骨折愈合产生不利影响的主要因素包括骨折线区域的血液供应受损、存在异物、坏死组织、骨栓、感染、骨片错位以及内固定技术不当[15]。在本病例中,由于不合适的骨接合方法(髓内骨接合无法为桡骨远端/外侧骨折的骨片提供必要的稳定性)、不适当的固定(近端骨片的完整性受损)和植入物断裂,第一次手术后两个月骨折仍未愈合。
在因创伤、感染或不愈合而造成大面积骨缺损的骨折中,骨组织的再生潜力会受到影响[16]。在这种情况下,如果不应用移植物来恢复骨解剖的完整性和加速愈合,骨愈合可能就不会发生。
在狗身上,自体骨移植物最常取自髂骨翼近端、胫骨、肋骨和尾椎[4,9,17]。对于小型犬来说,有时很难获得足够大的移植物来治疗大的骨缺损。对于这名患者,医生使用了健康前肢的尺骨作为供体骨。
之所以选择尺骨,是因为所获得的尺骨皮质自体移植物的形状、大小和直径与桡骨的解剖结构相匹配,对这种骨头的手术方法也很容易,而且采集移植物不会延长麻醉时间。尺骨是一种非负重骨,可以采集到较大的移植物。移植物采集是此类手术的关键阶段之一,因为它需要一支训练有素的团队,否则可能会延长手术时间。
桡骨远端区域的植骨固定可通过外固定器或动态加压板进行[17,18]。然而,外固定并不是一个好的选择,因为在采用外固定治疗的小型犬和玩具犬桡骨骨折中,有高达83%的骨折会出现严重的并发症,包括畸形和不愈合[19]。
这归因于这些犬种桡骨远端三分之一处的骨内血液供应减少、血管密度降低以及干骺端血管树枝化[2]。因此,人们更倾向于采用钢板接骨术,以确保骨碎片更好的稳定性和骨缺损更快的再生,这一点在术后第12周的随访X光片中得到了证实。这些固定技术的良好效果在早期研究中也有报道[20]。
总之,皮质骨自体移植物和松质骨自体移植物混合,并使用红细胞生成素的治疗效果极佳,在15周的时间内成功实现了大面积骨缺损的完全再生。局部应用促红细胞生成素有利于移植和骨结合,第12周时已获得放射学证据,翻修手术15周后临床效果极佳。
文献来源:Garnoeva R, Roydev R, Vasileva R. Erythropoietin as promoter of engraftment for treatment of radius/ulnar non-union fracture in a dog: Case report. Open Vet J. 2024 May;14(5):1302-1308.
参考文献
[1] Munakata S., Nagahiro Y., Katori D., Muroi N., Akagi H., Kanno N., Harada Y., Yamaguchi S., Hayashi K., Hara Y. Clinical efficacy of bone reconstruction surgery with frozen cortical bone allografts for nonunion of radial and ulnar fractures in toy breed dogs.Vet. Comp. Orthop. Traumatol. 2018;31:159–169.
[2] Welch J.A., Boudrieau R.J., DeJardin L.M., Spodnick G.J. The intraosseous blood supply of the canine radius: implications for healing of distal fractures in small dogs.Vet. Surg. 1997;26:57–61.
[3] Della Nina M.I., Schmaedecke A., Romano L., Ferrigno C.R.A. Comparação de osteossíntese com placa e osteossíntese com placa associada a enxerto de proteína morfogenética óssea em fratura bilateral distal de rádio e ulna em cão – relato de caso.Braz. J. Vet. Res. Anim. Sci., 2007;44:297–303.
[4] Decamp C.E., Johnston S.A., Déjardin L.M., Schaefer S.L. Bone grafting. In: Decamp C.E., Johnston S.A., Déjardin L.M., Schaefer S.L., editors.In Piermattei and Flo’s handbook of small animal orthopedics and fracture repair. St. Louis, MO: Elsevier; 2016. pp. 153–162.
[5] Kanczler J.M., Oreffo R.O. Osteogenesis and angiogenesis: the potential for engineering bone.Eur. Cell. Mater. 2008;15:100–114.
[6] dos Santos J.F., Ferrigno A., Ricardo C., dos Santos D.Í., Caquías I., Fabiana D. Nonunion fractures in small animals—a literature review.Semin. Cienc. Agrar. 2016;37:3223–3230.
[7] Szponder T., Wessely-Szponder J., Sobczyńska-Rak A., Żylińska B., Radzki R.Р., Polkowska I. Application of platelet-rich plasma and tricalcium phosphate in the treatment of comminuted fractures in animals.In Vivo. 2018;32:1449–1455.
[8] Castilla A., Filliquist B., Spriet M., Garcia T.C., Arzi B., Chou P.Y., Kapatkin A.S. Long-term assessment of bone regeneration in nonunion fractures treated with compression-resistant matrix and recombinant human bone morphogenetic protein-2 in dogs.Vet. Comp. Orthop. Traumatol. 2023;36:29–38.
[9] Choi J.Y., Yoon H.Y. Use of coccygeal vertebra autograft and platelet-rich plasma for treating a distal radial nonunion fracture in a small-breed dog.Can. Vet. J. 2022;63:689–694.
[10] Cho K., Lee K., Kang K., Kim M. Treatment of a large defect induced by atrophic nonunion of femoral fracture in a dog with autogenous coccygeal bone grafting.Vet Sci. 2023;10:388.
[11] Wang L., Wu F., Song Y., Duan Y., Jin Z. Erythropoietin induces the osteogenesis of periodontal mesenchymal stem cells from healthy and periodontitis sources via activation of the p38 MAPK pathway.Int. J. Mol. Med. 2018;41:829–835.
[12] Jaquet K., Krause K., Tawakol-Khodai M., Geidel S., Kuck K.H. Erythropoietin and VEGF exhibit equal angiogenic potential.Microvasc. Res. 2002;64:326–333.
[13] Rölfing J., Jensen J., Jensen J.N., Greve A., Lysdahl H., Chen M., Rejnmark L., Bünger C. A single topical dose of erythropoietin applied on a collagen carrier enhances calvarial bone healing in pigs.Acta Orthop. 2014;85:201–209.
[14] Wan L., Zhang F., He Q., Tsang W.P., Lu L., Li Q., Wu Z., Qui G., Zhou G., Wan C. EPO promotes bone repair through enhanced cartilaginous callus formation and angiogenesis.PLoS One. 2014;9:e102010.
[15] Marshall W.G., Filliquist B., Tzimtzimis E., Fracka A., Miquel J., Garcia J., Dalla Fontana M. Delayed union, non-union and mal-union in 442 dogs.Vet. Surg. 2022;51:1087–1095.
[16] Mao A.S., Mooney D.J. Regenerative medicine: current therapies and future directions.PNAS, 2015;112:14452–14459.
[17] Goto M., Ikeda H. Use of an autologous bone graft derived from three caudal vertebrae for reconstruction in a dog with radioulnar atrophic nonunion and osteomyelitis.VCOT Open. 2022;05:e93–e97.
[18] Milovancev M., Ralphs S.C. Radius/ulna fracture repair.Clin. Tech. Small Anim. Pract. 2004;19:128–133.
[19] Waters D.J., Breur G.J., Toombs J.P. Treatment of common forelimb fractures in miniature and toy breed dogs.J. Am. Anim. Hosp. Assoc. 1993;29:442–448.
[20] Wingerter S., Calvert G., Tucci M., Tsao A., Russell G., Benghuzzi H. Comparison of two different fixation techniques for a segmental defect in a rat femur model. J. Invest. Surg. 2007;20:149–155.