
| 一般情况 | |
|---|---|
 | 品种:金毛寻回犬 |
| 年龄:10岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:罗库溴铵不良反应 | |
01 主诉及病史
就诊于眼科,准备进行角膜后弹力层脱出的手术治疗。
02 检查
体重38.6千克。心率120次/分,呼吸频率升高。其他生命体征、全血细胞计数和生化检查均无异常。
03 手术
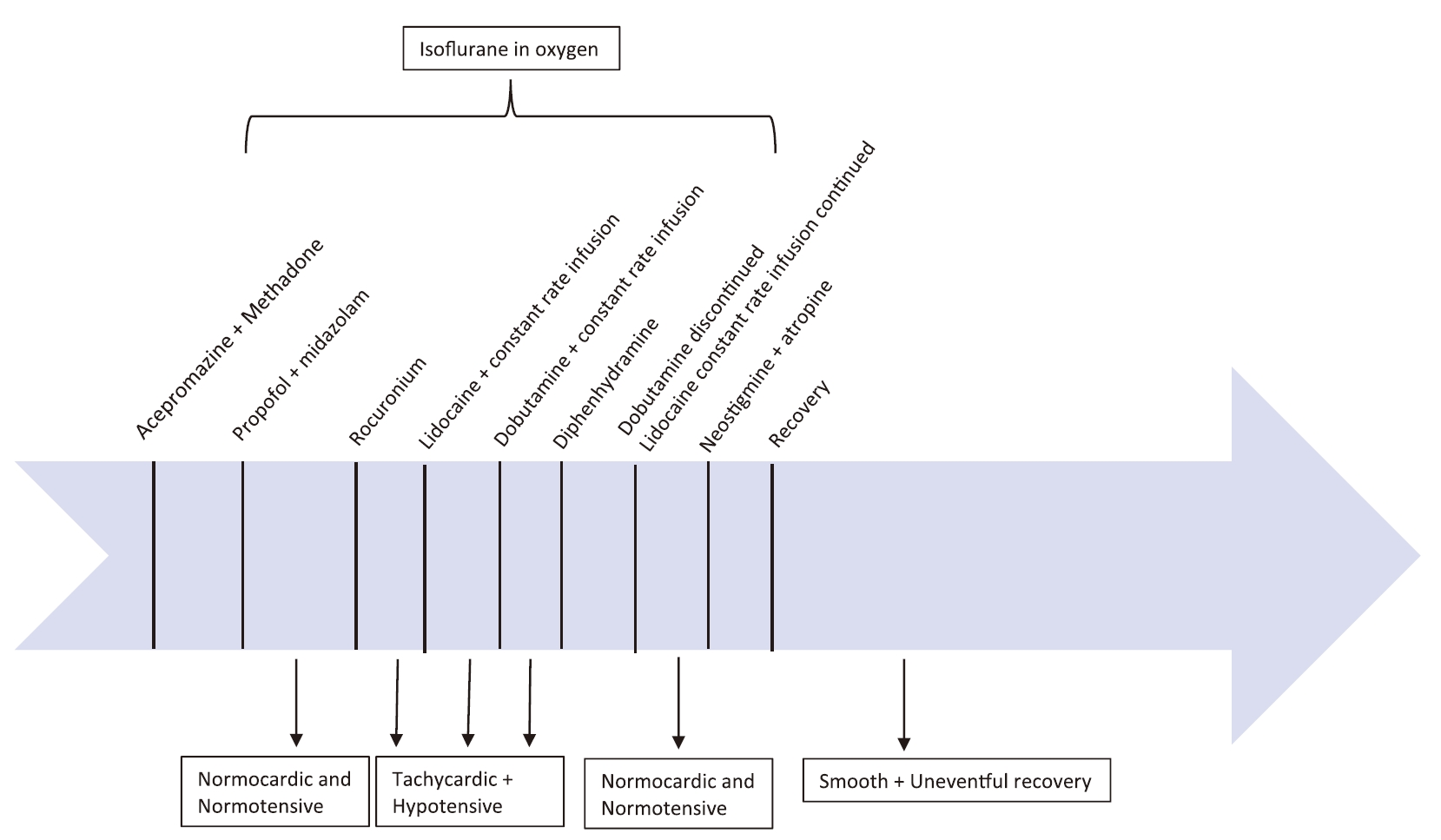
肌肉注射0.02 mg/kg乙酰丙嗪和0.5 mg/kg美沙酮,达到中度镇静,以便于静脉导管置入。约30分钟后,使用2 mg/kg丙泊酚和0.2 mg/kg咪达唑仑作为辅助诱导剂诱导麻醉。然后用内径11 mm的气管插管进行插管。异氟醚在氧气中的浓度为2.5%,麻醉维持了15分钟,由于情况稳定,异氟醚浓度降至2%。以5 mL/kg/h的速度静脉注射乳酸林格氏液。
诱导后立即缓慢静脉注射马罗匹坦(1 mg/kg)和昂丹司琼(0.2 mg/kg),因为这两种药物具有止吐和抗恶心作用。静脉缓慢注射抗生素头孢唑啉(22 mg/kg),此后术中每隔90分钟注射一次。使用多参数监护仪每5分钟进行一次间接血压监测。血压袖带放置在后肢上,测量值为肢体周长的40%。
犬情况稳定,收缩压为100 mmHg,舒张压为45 mmHg,平均动脉血压为60 mmHg。其他生命体征,如体温(37.89℃)、心率(100 bpm)、呼吸频率(12次/分)和潮气末二氧化碳(45 mmHg)均在正常范围内。
此后不久,患者出现间歇性呼吸暂停,于是加用了一台机械呼吸机以维持8次/分的呼吸频率和400 mL的潮气量。
使用外周神经刺激器监测因使用神经肌肉阻滞剂而产生的四联反应。神经刺激器连接在腓总神经附近,正导线位于胫骨结节外侧,负导线位于跗骨外侧正导线远端3英寸处。
诱导后20分钟,缓慢静脉注射0.5 mg/kg罗库溴铵,以达到麻痹眼肌的目的,便于手术时将眼球置于视野中心。
在施用罗库洛铵后的10分钟内,观察到四联反应值为0,因此认为神经肌肉阻断成功。然而,患者出现心动过速,心率160 bpm,血压低,收缩压为50 mmHg,舒张压为15 mmHg,平均动脉压为35 mm Hg。
缓慢静脉注射2 mg/kg利多卡因以缓解可能导致心动过速的潜在疼痛,目的是降低心率,为心脏充盈留出更多时间。然而,该犬的心率仍高达145 bpm,血压持续下降至20 mm Hg。静脉注射了乳酸林格氏液(10 mL/kg,总容量380 mL),以7 mcg/kg/min的速度输注多巴酚丁胺,并以50 mcg/kg/min的速度输注利多卡因。使用多巴酚丁胺是因为它具有正性肌力作用,而使用利多卡因是因为它具有抗痛觉作用。
干预后10到15分钟,生命体征如下:心率150 bpm,潮气末二氧化碳浓度42 mmHg,血压45 mmHg,SpO2为99%。在心率和血压没有明显改善的情况下,静脉注射了0.8 mg/kg苯海拉明,以防罗库溴铵引起组胺反应。
在注射苯海拉明15分钟内,生命体征有所改善,心率110 bpm,潮气末二氧化碳浓度52 mmHg,血压65 mmHg,SpO2为99%。随后停用了多巴酚丁胺,但继续使用利多卡因恒速输注以提供额外的镇痛效果。
手术的其余部分进展顺利,生命参数保持在正常范围内。手术结束时,静脉注射了0.04 mg/kg新斯的明和0.02 mg/kg阿托品,以拮抗神经肌肉阻滞剂的作用。恢复自主呼吸后,停止机械通气并关闭吸入剂。30分钟后顺利苏醒。
04 预后
术后生命体征如下:体温38℃,心率94 bpm,呼吸64 bpm,胸腔听诊未发现异常,粘膜呈粉红色,毛细血管再充盈时间小于2秒(下图)。
由于动物已经清醒并能走动,所有监控设备均已移除。建议今后不再对该犬施用罗库溴铵。
05 讨论
神经肌肉阻滞剂(Neuromuscular blocking agent,NMBA)通常被纳入麻醉计划中,以促进肌肉放松[1]。非去极化NMBA分为两类:①苄基异喹啉鎓化合物,如阿曲库铵和顺阿曲库铵,②氨基类固醇,如罗库溴铵。
这两类药物都含有季铵离子,已被证明会导致过敏反应和组胺释放[2]。人体内的免疫球蛋白E会将季铵识别为外来分子,从而导致大量组胺释放,并可能导致血管扩张,继而引起低血压和代偿性心动过速[3]。
对人类的研究表明,苄基异喹啉鎓化合物可能导致低血压和心动过速[4]。另据报道,苄基异喹啉化合物会导致组胺血浆浓度增加200%或更高[2]。
罗库溴铵一般不会引起心血管改变或血浆组胺浓度的显著变化[2]。当动物处于麻醉状态时,组胺反应的主要负面临床结果是血管扩张和随后的低血压,在某些情况下还会导致支气管收缩。人和狗在低血压状态下会出现代偿性心动过速,试图缓解血压下降[5-7]。组胺释放有时还会出现其他临床症状,如荨麻疹和发热[8]。
兽医学文献中缺乏有关氨基甾体结构(如罗库洛铵)导致组胺反应的信息以及处理此类事件的方法[9]。本病例描述了一只狗在麻醉状态下静脉注射罗库洛铵后出现的明显组胺反应,通过使用苯海拉明成功控制了这一反应。
既往研究怀疑罗库溴铵存在非过敏反应,患犬表现出心动过速、高血压和支气管收缩[10],而本病例中观察到的是心动过速和低血压。虽然本病例中使用了具有α1-肾上腺素受体拮抗作用的乙酰丙嗪和美沙酮作为术前用药,这些药物可能会导致低血压和心动过速,但血液动力学变化直到施用罗库溴铵后不久才出现[11]。
在施用罗库溴铵后的10分钟内,神经肌肉阻断成功,然而,该犬出现明显心动过速和低血压。由于放置了手术帘和保暖装置,没有观察到可能与疑似组胺反应同时发生的皮肤变化,如红斑和荨麻疹。
虽然肾上腺素是过敏性休克的推荐治疗方法,但该病例中出现的症状并不严重,也没有支气管收缩的迹象,不太可能出现过敏性休克[12]。
苯海拉明是一种H1受体拮抗剂,常用于抑制对药物、食物、血液制品和其他过敏原的超敏反应[13]。由于没有报道称罗库溴铵会引起犬的组胺反应,因此这些病例通常不会预先使用抗组胺药,因此当本病例的心率和血压发生变化时,医生最初认为它们应该与NMBA无关。
在该病例中,与诱导后的生命体征相比,注射NMBA后10分钟,该犬的心率升高了1.6倍,血压降低了1.7倍。最初怀疑心动过速是由有害的手术刺激引起的。然而,最初的药物干预未能成功缓解心动过速和低血压。
由于心动过速与低血压同时出现,而且最初的干预措施也未见改善,因此这些变化被认为是组胺反应的结果,而非对手术刺激的反应。心动过速和低血压与施用罗库溴铵的相关性,以及施用苯海拉明后不良临床症状的缓解,都高度提示了组胺反应。
总之,苯海拉明似乎成功地治疗了这只狗在使用罗库溴铵后不久出现的不良反应。虽然在确定明显的心动过速和低血压的原因时存在混杂因素,但这些变化很可能是由于与使用罗库溴铵相关的组胺反应引起的[14,15]。
文献来源:Calus M, Muñoz KA. Occurrence of hemodynamic changes following administration of rocuronium in a dog presenting for an ophthalmic procedure. Vet Med Sci. 2024 Jul;10(4):e1531.
参考文献
[1] Dugdale, H. A., Adams, W. A., & Jones, R. S. (2002). The clinical use of the neuromuscular blocking agent rocuronium in dogs. Veterinary Anaesthesia and Analgesia, 29, 49–53.
[2] Naguib, M., Samarkandi, A. H., Bakhamees, H. S., Magboul, M. A., & el-Bakry, A. K. (1995). Histamine-release haemodynamic changes produced by rocuronium, vecuronium, mivacurium, atracurium and tubocurarine. British Journal of Anaesthesia, 75, 588–592.
[3] Mills, A., Sice, P., & Ford, S. (2014). Anaesthesia-related anaphylaxis: Investigation and follow-up. BJA Education, 14, 57–62.
[4] Lieberman, P. (1998). Anaphylaxis and anaphylactoid reactions. In E. Middleton, C. E. Reed, E. F. Ellis, N. F. Adkinson, J. W. Yunginger, & W. W. Busse (Eds.), Allergy principles and practice ( 5th ed., pp. 1079–1092). Mosby.
[5] Chrusch, C., Sharma, S., Unruh, H., Bautista, E., Duke, K., Becker, A., Kepron, W., & Mink, S. N. (1999). Histamine H3 receptor blockade improves cardiac function in canine anaphylaxis. American Journal of Respiratory and Critical Care Medicine, 160, 1142–1149.
[6] Moss, J., & Rosow, C. E. (1983). Histamine release by narcotics and muscle relaxants in humans. Anesthesiology, 59, 330–339.
[7] Shmuel, D. L., & Cortes, Y. (2013). Anaphylaxis in dogs and cats. Journal of Veterinary Emergency and Critical Care (San Antonio), 23, 377–394.
[8] Shepherd, G. M. (2003). Hypersensitivity reactions to drugs: Evaluation and management. Mount Sinai Journal of Medicine, 70, 113–125.
[9] Savarese, J. J., Caldwell, J. E., Lien, C. A., & Miller, R. D. (2000). Pharmacology of muscle relaxants and their antagonist. In R. D. Miller (Ed.), Anesthesia ( 5th ed., pp. 412–490). Churchill-Livingston.
[10] Küls, N., Rocchi, A., & Larenza, P. M. (2016). Suspected anaphylaxis after intravenous injection of rocuronium in dog. Veterinary Record Case Reports, 4, e000343.
[11] Hall, L. W., Clarke, K. W., & Trim, C. M. (2001). Principles of sedation, analgesia and premedication. In L. W. Hall, K. W. Clarke, & C. M. Trim (Eds.), Veterinary anaesthesia ( 10th ed., pp. 75–112). W. B. Saunders.
[12] Kroigaard, M., Garvey, L. H., Gilleberg, L., Johansson, S. G. O., Mosbech, H., Florvaag, E., Harboe, T., Eriksson, L. I., Dahlgren, G., Seeman-Lodding, H., Takala, R., Wattwil, M., Hirlekar, G., Dahlén, B., & Guttormsen, A. (2007). Scandinavian clinical practice guidelines on the diagnosis, management and follow-up of anaphylaxis during anaesthesia. Acta Anaesthesiologica Scandinavica, 51, 655–670.
[13] Helgeson, M. E., Pigott, A. M., & Kierski, K. R. (2021). Retrospective review of diphenhydramine versus diphenhydramine plus glucocorticoid for treatment of uncomplicated allergic reaction in dogs. Journal of Veterinary Emergency and Critical Care (San Antonio), 31, 380–386.
[14] Mertes, P. M., & Volcheck, G. W. (2015). All neuromuscular-blocking drugs are not the same. Anesthesiology, 122, 5–7.
[15] Testa, B., Pawson, P., & Bell, A. (2021). A suspected non-allergic anaphylactic reaction to intravenous administration of atracurium in a dog. Veterinary Record Case Reports, 9, e101.