
| 一般情况 | |
|---|---|
 | 品种:雪纳瑞 |
| 年龄:9岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:口腔黑色素瘤 | |
01 主诉及病史
1个月前出现口腔出血、面部肿胀和口臭。
02 检查
体重11.6千克。口腔检查发现右侧上颌骨有一个黑色肿块,并伴有出血。使用细针穿刺术采集了样本。口腔触诊发现疼痛反应明显。尽管使用了多种镇痛药,如吡罗昔康(0.3 mg/kg PO q24h)、加巴喷丁(10 mg/kg PO q24h)和曲马多(3 mg/kg PO q24h),但仍无法有效止痛。此外,由于口腔肿瘤,患者的进食量明显减少。
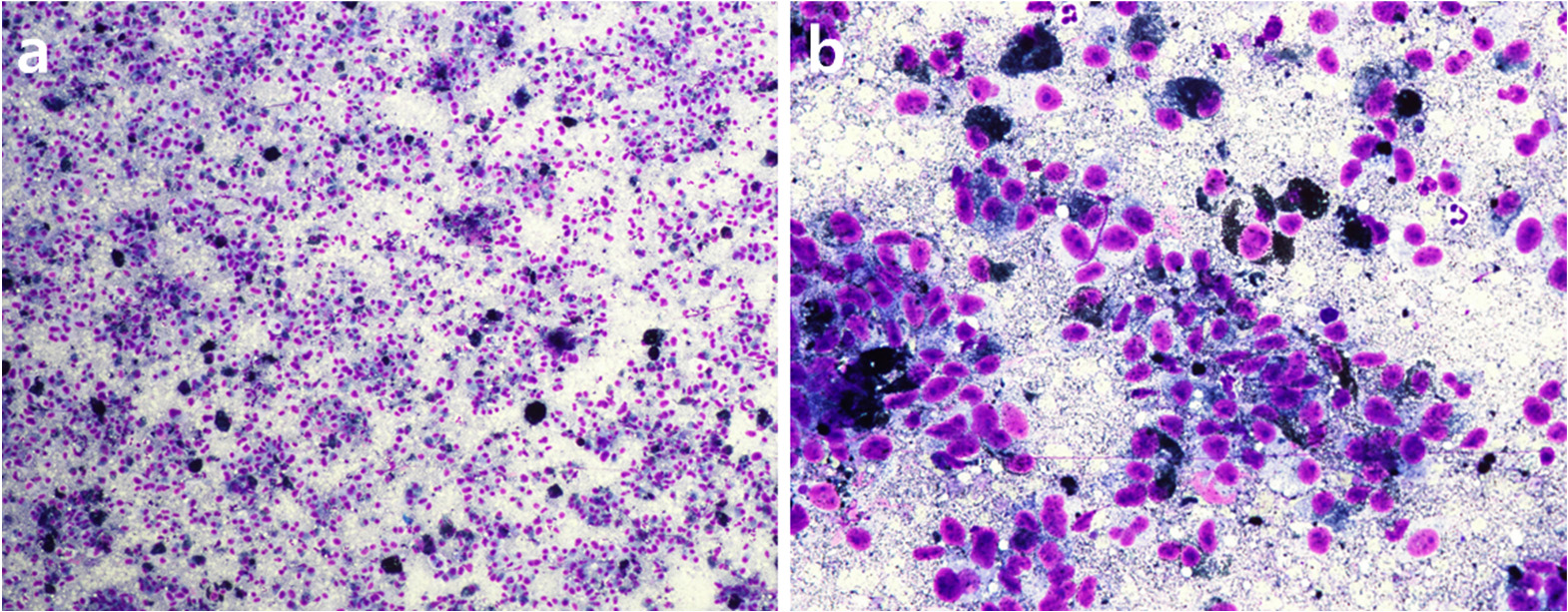
在细胞学检查中,观察到未成熟的间质细胞,胞浆中有深绿色颗粒。还发现了多核、异形细胞增多、异形核分裂以及核质比的变化。口腔肿块被初步诊断为恶性黑色素瘤(下图)。
全血细胞计数显示中度贫血(血细胞比容28.6% [37-55])和网织红细胞增多(4.26% [0.1-2.0])。平均血球容积增加(82 fL [60-74])和平均血球血红蛋白浓度下降(30.2 g/dL [31-36])。
血生化显示白蛋白下降(2.1 g/dL [2.3-3.9]),碱性磷酸酶升高(679 U/L [20-155]),丙氨酸氨基转移酶升高(94 U/L [3-50]),天门冬氨酸氨基转移酶升高(41 U/L [10-37]),淀粉酶升高(2790 U/L [388-1007]),脂肪酶升高(198 U/L [5-90]),C反应蛋白升高(171 mg/L [0-10.0])。
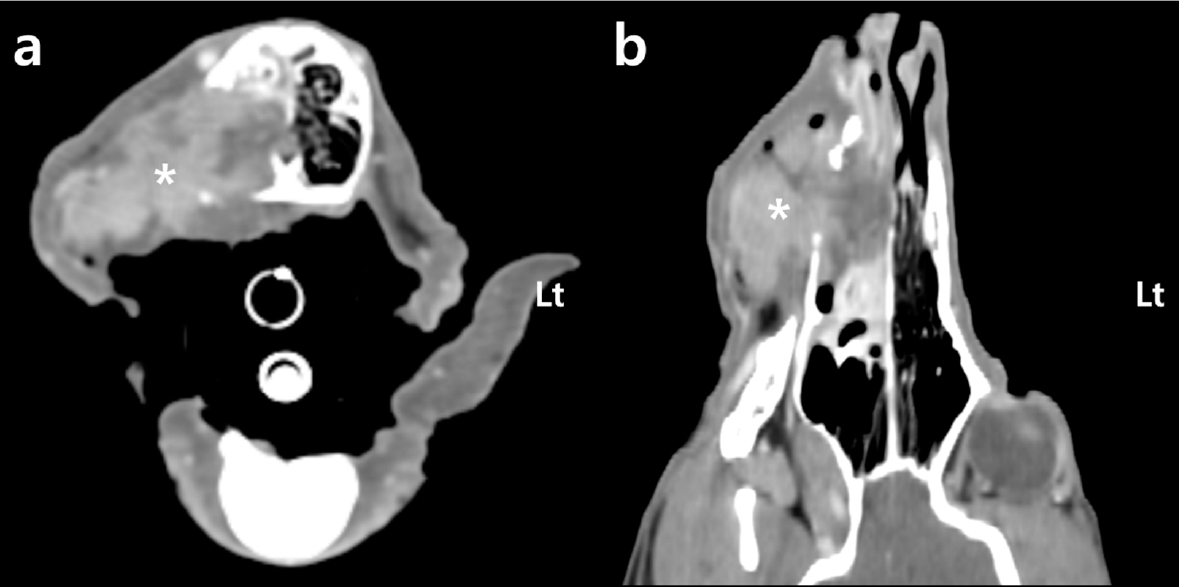
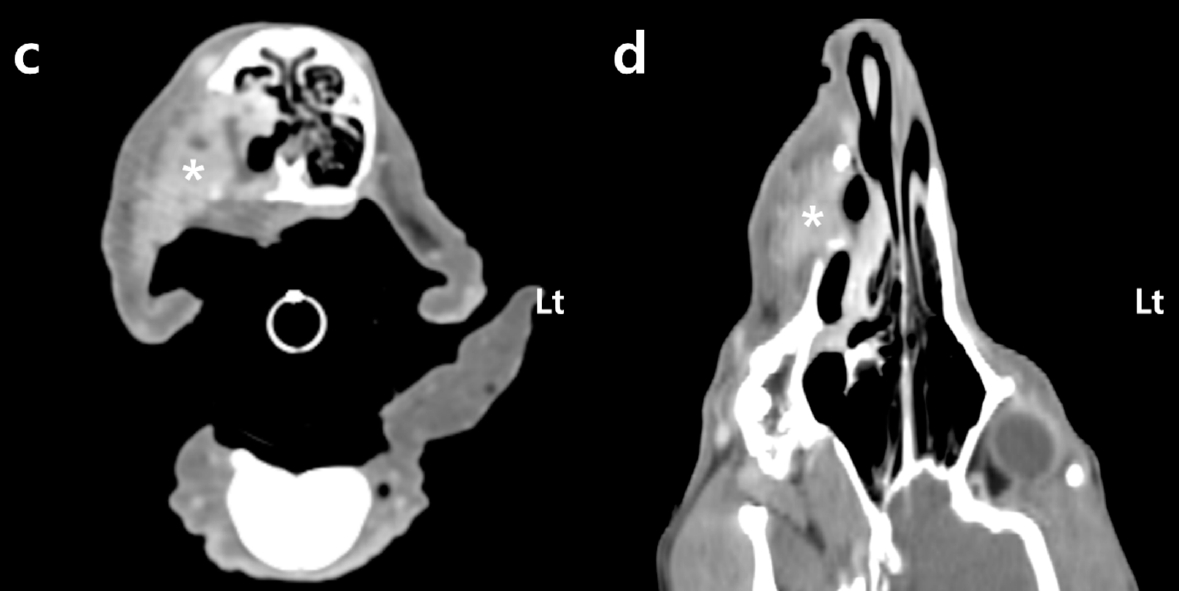
增强CT显示,右上颌骨内有一个异质对比增强的肿块,最大直径达41 mm。在与口腔肿块相邻的上颌骨、鼻甲和硬腭处观察到骨侵蚀(下图)。肿块还侵入了右鼻腔内部。虽然没有确定区域淋巴结和远处器官的转移情况,但通过CT结果,患者被归类为WHO 3/4期。
CT检查后,患者出现持续出血。CT扫描后的第4天,发展为严重贫血(血细胞比容18.2% [37-55]),必须立即输血。虽然输血后两天血细胞比容暂时上升到了23.3%,但第二天又下降到19.9%。
03 治疗
尽管医生建议进行手术切除,但被主人拒绝。于是选择姑息性放疗来控制出血和提高生活质量。对患者进行了容积调强放射治疗(VMAT)。规划剂量为 36 Gy,每周分6次进行,每次6 Gy。
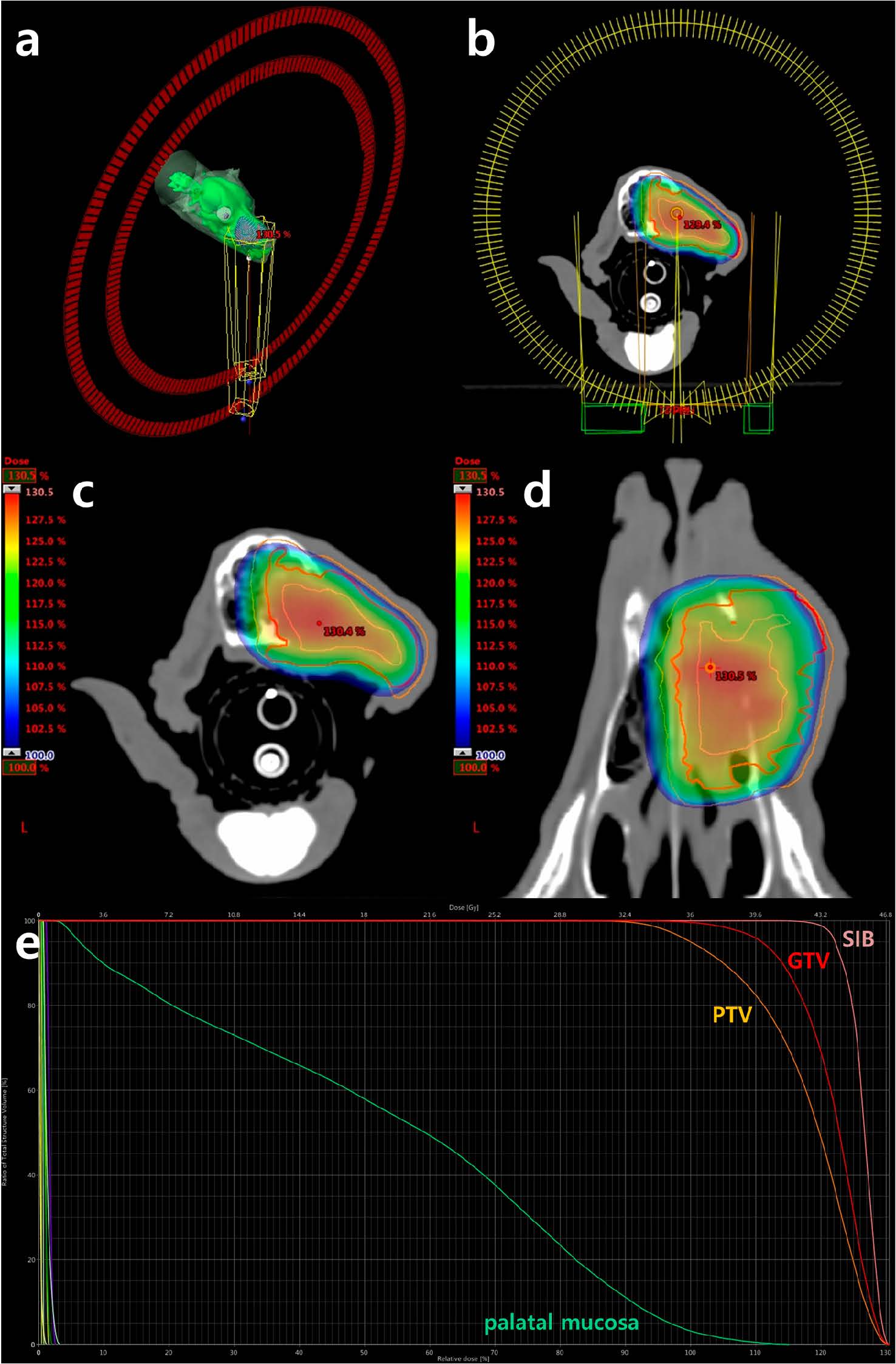
鉴于患者在放疗前患有严重的失血性贫血,因此在第一周进行了两次治疗以达到快速止血的目的,总治疗时间为5周。从肿瘤总体积各方向扩大3 mm作为规划靶体积。剂量学目标是将100%的处方剂量覆盖99%的肿瘤总体积和95%的规划靶体积(下图)。
04 预后
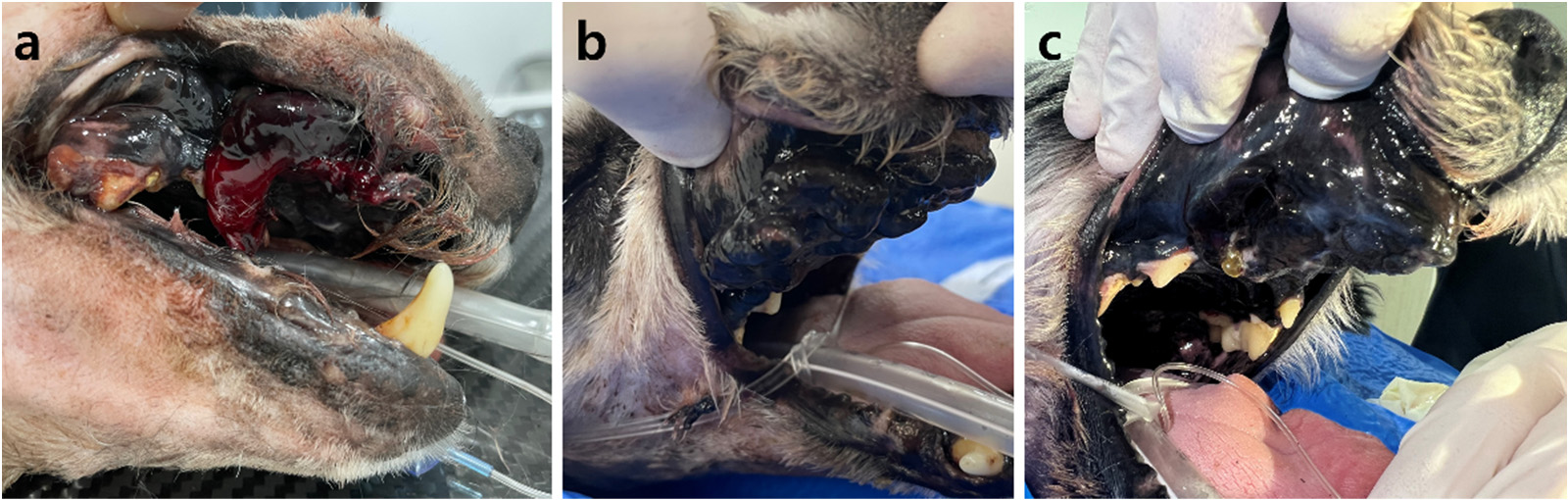
第一个疗程后,出血明显减少,2天后在第二个疗程结束后,出血停止。随后没有再出血(下图)。血细胞比容在第一个疗程当天为19.9%,之后逐渐上升。第二个疗程后,血细胞比容达到25.1%,第三个疗程后增至39.3%。
从第三个疗程开始,贫血得到有效缓解(下图)。第四个疗程后,平均血球容积(69.7 fL [60-74])和平均血球血红蛋白浓度(33.3 g/dL [31-36])均恢复到参考范围内。C反应蛋白水平(1.2 mg/L [0-10])也降至参考范围内,表明炎症有所改善。
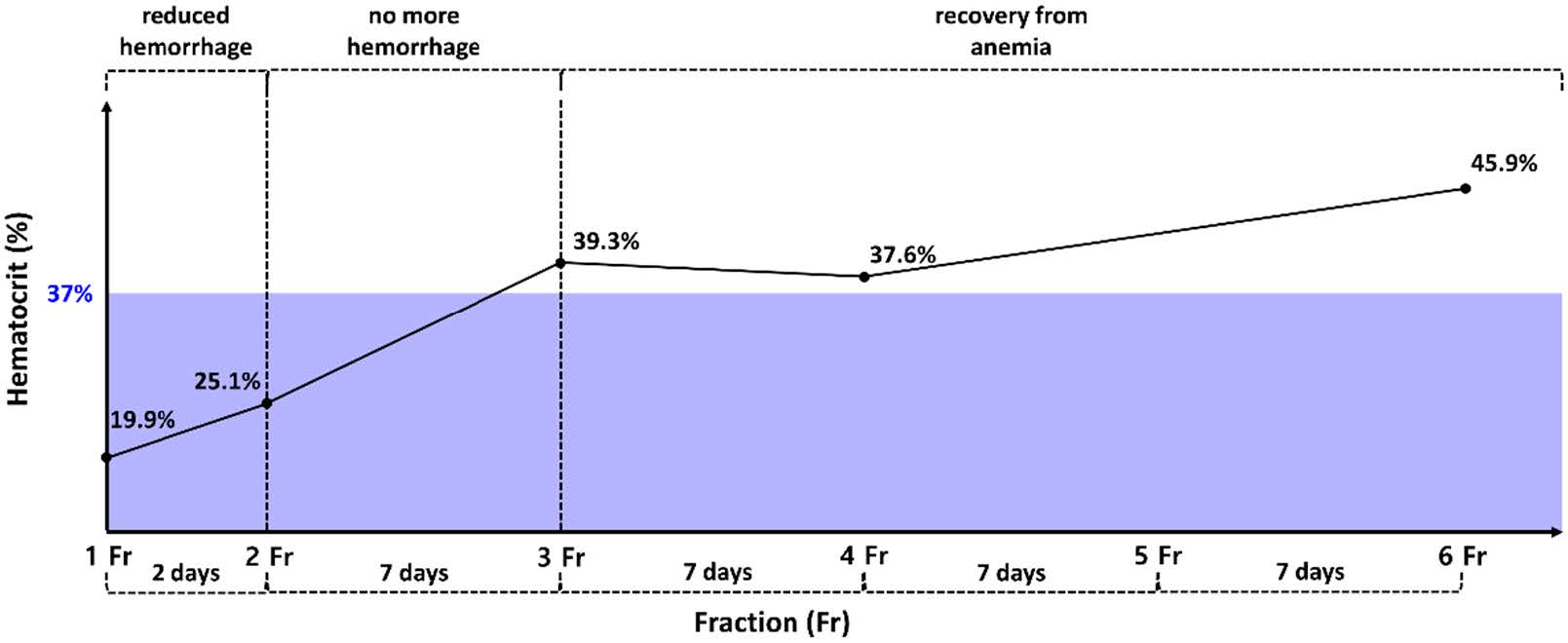
放疗后,之前无法控制的疼痛也减轻了。从第四个疗程开始,即使没有使用镇痛药,口腔触诊疼痛反应也极小。从第二个疗程开始,食物摄入量也有所改善。最后一次治疗后,进行了对比增强CT,观察到肿瘤比治疗前缩小了20.6%(下图)。然而,根据CT结果,强烈怀疑右下颌淋巴结和肺部有转移,导致WHO分期恶化为4/4期。
放疗后未观察到放射毒性。然而,在第一个疗程后的第84天,患者出现了肿瘤恶化和同侧下颌淋巴结肿大。1周内在家中去世。
05 讨论
出血是晚期癌症患者经常出现的并发症,往往会危及生命[1]。出血的处理方法包括一系列干预措施,包括敷料、止血剂和介入手术[2]。姑息放疗已成为人类患者止血的标准模式,在治疗不同部位(如呼吸、消化和生殖系统)的肿瘤出血方面取得了成功,止血效果从73%到100%不等[1,3-6]。
恶性黑色素瘤是犬最主要的口腔肿瘤,常表现为口臭、多涎、面部肿胀、疼痛、吞咽困难和出血等症状[7]。口腔黑色素瘤的特点是侵袭性强、易发生侵犯和转移,给局部治疗带来了挑战。
虽然可以考虑通过手术切除或放疗进行局部控制,但由于该病具有侵袭性,往往需要进行下颌骨部分切除术或上颌骨切除术,这些手术都比较复杂[7-9]。因此,放疗在口腔黑色素瘤患者的治疗中起着举足轻重的作用,通常作为一种非手术治疗方法,可达到姑息治疗的目的[9-12]。
姑息放疗的目的不是延长生存时间,而是通过减轻临床症状(包括疼痛、炎症和出血)来改善生活质量[4]。姑息放疗已被用于各种出血性肿瘤的止血目的,如肺部肿瘤引起的咯血、胃部肿瘤引起的消化道出血、膀胱和前列腺肿瘤引起的血尿、结直肠肿瘤引起的便血以及妇科肿瘤引起的阴道出血[1,5,6,13]。
虽然兽医学中关于肾上腺肿瘤放疗后出血缓解并伴有血腹腔积液以及口腔鳞状细胞癌放疗后出血量减少的报道不多,但还没有将放疗用于止血的报道[14,15]。虽然通过放疗止血的动物病例数量有限,但观察到的与人类相似的止血效果表明,姑息性放疗可能对狗的止血有益。
人类采用了多种止血放疗方案[1]。过去,人们认为止血需要10次分割和大于39 Gy的生物有效剂量。然而最近的报告表明,少于5次分割和小于39 Gy的生物有效剂量就能达到有效止血的目的[1,3,13]。此外,治疗疗程少于5次的短疗程更受青睐,因为治疗次数减少可降低治疗中断的风险。最短的方案是单次剂量为8 Gy,假设肿瘤的α/β比值为10 Gy,则生物有效剂量为14.4 Gy[3]。
在本病例中,单次剂量6 Gy并未达到14.4 Gy的有效止血剂量,因此仅减少了部分出血。在最初的一周,为了达到快速止血的效果,在第一次放疗后2天又进行了一次放疗,使生物有效剂量达到了19.2 Gy,超过了14.4 Gy。结果出血在第二次放疗后就停止了,这表明止血所需的生物有效剂量为14.4 Gy。
虽然在第一周进行两次放疗可能会增加急性放射毒性的风险,但并未观察到急性放射毒性。由于之前的报告并未显示每周一次和每两周一次的治疗方案在疗效和毒性方面存在显著差异,因此在第一周使用两次剂量被认为是可以接受的。
尽管人们对放疗期间止血的确切机制尚不完全清楚,但提出了几种机制假设。首先,受到辐射照射后,血管内皮细胞中的血管性血友病因子(VWF)会增加。释放的VWF就像胶水一样,促进血小板粘附在血管内皮下。这导致血小板聚集和活化,从而形成血凝块并止血[16,17]。
其次,辐照引发内皮细胞炎症,释放转化生长因子-β1(TGF-β1)。释放的TGF-β1会增加凝血酶的生成,促进血液凝固,并激活肌成纤维细胞,促进胶原蛋白分泌和血管纤维化[18]。因此,血管被封闭后止血。
本研究也存在一些局限性。本研究重点关注姑息性放疗对一种动物的止血效果,这限制了更广泛地推广放疗对不同物种动物止血效果的影响。此外,放疗对不同部位和类型的出血性肿瘤的疗效仍有待验证,因此有必要进一步研究。
文献来源:Kim M, Jeong I, Lee G, Park C, Kim Y, Eom K, Kim J. Application of Palliative Hemostatic Radiotherapy in Canine Unresectable Oral Melanoma: A Case Report. Animals (Basel). 2024 Jun 9;14(12):1746.
参考文献
1. Shah A., Suryanarayan U. Hemostatic Radiotherapy. J. Radiat. Cancer Res. 2021;12:108–110.
2. Johnstone C., Rich S.E. Bleeding in Cancer Patients and Its Treatment: A Review. Ann. Palliate Med. 2018;7:265–273.
3. Sapienza L.G., Ning M.S., Jhingran A., Lin L.L., Leão C.R., da Silva B.B., de Assis Pellizzon A.C., Gomes M.J., Baiocchi G. Short-Course Palliative Radiation Therapy Leads to Excellent Bleeding Control: A Single Centre Retrospective Study. Clin. Transl. Radiat. Oncol. 2019;14:40–46.
4. Spencer K., Parrish R., Barton R., Henry A. Palliative Radiotherapy. BMJ. 2018;360:k821.
5. Aljabab S., Cheung P., Dennis K., Morgan S.C. Hemostatic Radiotherapy in Advanced Bladder Cancer: A Single-Institution Experience. J. Radiat. Oncol. 2017;6:379–385.
6. Cihoric N., Crowe S., Eychmüller S., Aebersold D.M., Ghadjar P. Clinically Significant Bleeding in Incurable Cancer Patients: Effectiveness of Hemostatic Radiotherapy. Radiat. Oncol. 2012;7:132.
7. Pazzi P., Steenkamp G., Rixon A.J. Treatment of Canine Oral Melanomas: A Critical Review of the Literature. Vet. Sci. 2022;9:196.
8. Bergman P.J. Canine Oral Melanoma. Vet. Sci. 2007;22:55–60.
9. Kawabe M., Mori T., Ito Y., Murakami M., Sakai H., Yanai T., Maruo K. ; Outcomes of dogs undergoing radiotherapy for treatment of oral malignant melanoma: 111 cases (2006–2012) J. Am. Vet. Med. Assoc. 2015;247:1146–1153.
10. Cunha S.C.D.S., Corgozinho K.B., Silva F.B.F., da Silva K.V.G.C., Ferreira A.M.R. Radiation Therapy for Oral Melanoma in Dogs: A Retrospective Study. Cienc. Rural. 2018;48:e20160396.
11. Proulx D.R., Ruslander D.M., Dodge R.K., Hauck M.L., Williams L.E., Horn B., Price G.S., Thrall D.E. A Retrospective Analysis of 140 Dogs with Oral Melanoma Treated with External Beam Radiation. Vet. Radiol. Ultrasound. 2003;44:352–359.
12. Baja A.J., Kelsey K.L., Ruslander D.M., Gieger T.L., Nolan M.W. A Retrospective Study of 101 Dogs with Oral Melanoma Treated with a Weekly or Biweekly 6 Gy × 6 Radiotherapy Protocol. Vet. Comp. Oncol. 2022;20:623–631.
13. Asakura H., Hashimoto T., Harada H., Mizumoto M., Furutani K., Hasuike N., Matsuoka M., Ono H., Boku N., Nishimura T. Palliative Radiotherapy for Bleeding from Advanced Gastric Cancer: Is a Schedule of 30 Gy in 10 Fractions Adequate? J. Cancer Res. Clin. Oncol. 2011;137:125–130.
14. Mosca A., Gibson D., Mason S.L., Dobson J., Giuliano A. A Possible Role of Coarse Fractionated Radiotherapy in the Management of Gingival Squamous Cell Carcinoma in Dogs: A Retrospective Study of 21 Cases from Two Referral Centers in the UK. J. Vet. Med. Sci. 2021;83:447–455.
15. Linder T., Wakamatsu C., Jacovino J., Hsieh Y.H., Mueller M. Stereotactic Body Radiation Therapy as an Alternative to Adrenalectomy for the Treatment of Pheochromocytomas in 8 Dogs. Vet. Comp. Oncol. 2023;21:45–53.
16. Verheij M., Dewit L.G.H., Boomgaard M.N., Brinkman H.-J.M., Van Mourik J.A. Ionizing radiation enhances platelet adhesion to the extracellular matrix of human endothelial cells by an increase in the release of von Willebrand factor. Radiat. Res. 1994;137:202–207.
17. Fajardo L.F. The Pathology of Ionizing Radiation as Defined by Morphologic Patterns. Acta Oncol. 2005;44:13–22.
18. Yarnold J., Vozenin Brotons M.C. Pathogenetic Mechanisms in Radiation Fibrosis. Radiother. Oncol. 2010;97:149–161.