
动脉血压是指血液在全身循环中对大动脉壁施加的压力。肺循环是一个低压系统,与全身循环有着明显的不同,因此本文将不对其进行讨论。由于心脏充盈和射血产生的血流具有搏动性,因此动脉血压会发生周期性变化。
流向组织的血流理论上也是搏动性的,但由于动脉血管具有弹性,血流基本上是连续的。动脉内的最大压力发生在心脏的收缩期,称为收缩期动脉压(SAP)。相反,动脉内的压力在心肌舒张期时最低,称为舒张期动脉压(DAP)。
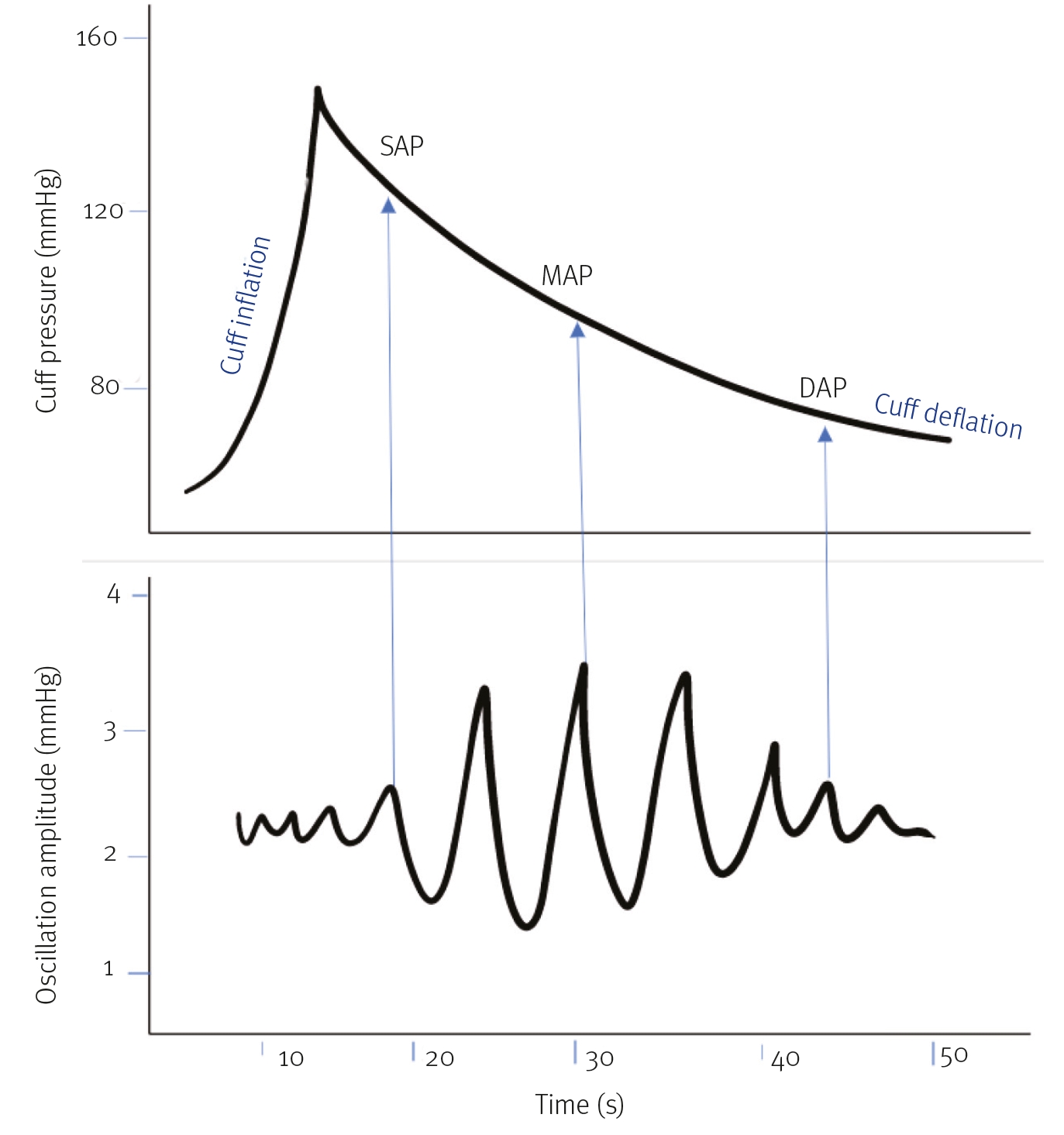
平均动脉压(MAP)指的是一个心动周期内的平均动脉压力,反映了动脉波形曲线下的面积(图1)。大多数测量动脉血压的数字监护仪都会自动计算并显示MAP。但如果没有显示MAP值,则可按以下方式计算:MAP=1/3 (SAP-DAP)+DAP。
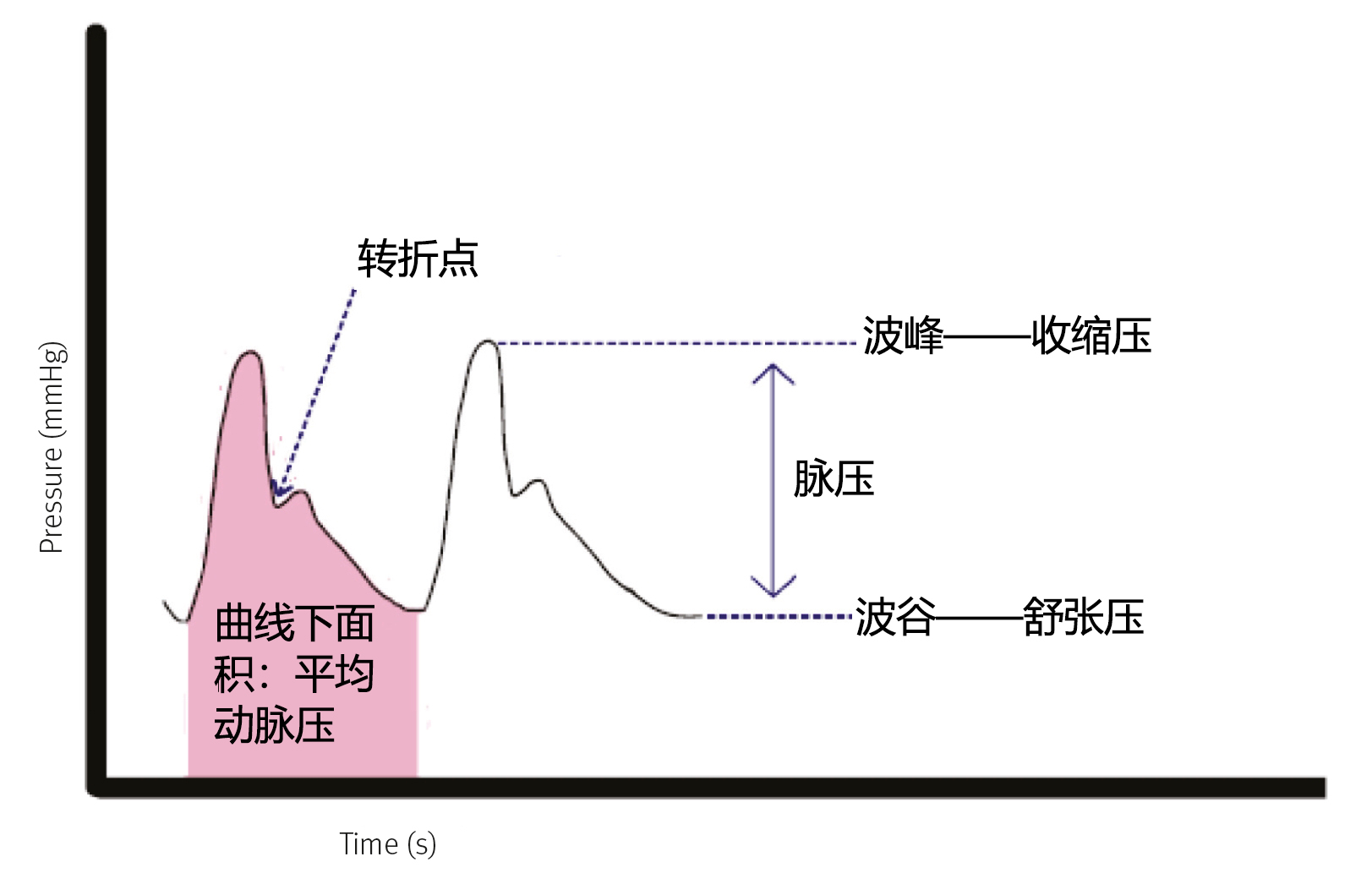
舒张期时间比收缩期时间长,导致静息时MAP值更接近于DAP,而非SAP。随着心率的增加,舒张期时间比收缩期时间缩短得更多,导致MAP值更接近SAP。主动脉的血压最高,腔静脉的血压最低。正是动脉和静脉之间的压力差推动血液流经组织,为其提供氧气和营养物质。
有多种机制可调节这些因素,将动脉血压维持在严格的生理范围内,并为器官提供适当的血流量。下文将介绍相关的解剖结构和这些生理机制。
01 动脉血压的定义和决定因素
心输出量(Qt)的定义是一分钟内每个心室射出的血量,计算公式为心率(HR)乘以每搏输出量(SV)。SV指的是心脏收缩时离开心室的血量——在没有心内分流的情况下,每个心室的SV是相同的。
SV受以下因素的影响:
- 前负荷——宽泛地定义为舒张末期返回右心房的血量或心室内的压力。在正常心脏中,前负荷增加会导致SV增加(心脏斯塔林定律)。
- 收缩力——心肌收缩的力量。收缩力增加会导致SV增加。
- 后负荷——心室收缩射血时必须承受的压力。由于血管收缩加剧而导致高血压的动物,其后负荷会增加。后负荷增加会导致SV下降。
动脉血压的计算方法是Qt乘以全身血管阻力 (SVR)。SVR有时也称为总外周阻力,是血管对血液施加的力的大小,换句话说,就是血管床(尤其是动脉血管)的血管收缩或血管扩张程度。
动脉血压的计算公式如下:
- 公式1:动脉血压 = Qt x SVR
- 公式2:动脉血压 = HR x SV x SVR
尽管Qt与动脉血压密切相关,但要注意动脉血压不能作为Qt的指标,因为这两个因素之间的相关性很差。就向组织输送氧气而言,保持Qt非常重要,但在临床环境中却不容易测量。
举例来说,使用α2肾上腺素能激动剂美托咪定会影响Qt和SVR。起初外周血管强烈收缩,导致SVR和全身血压升高。作为反应,压力感受器会促使心率下降,使血压恢复正常。血管收缩导致后负荷增加。尽管动脉血压接近正常,但后负荷增加和心率下降都会导致Qt显著下降。对于心脏健康的动物来说,这种情况通常能被很好地耐受,但对于有心脏疾病的动物可能会导致并发症。
02 解剖学
1. 动脉
动脉壁中含有大量弹性组织,可在收缩时将能量从心脏传递到动脉壁。这些能量通过动脉弹性组织的拉伸被储存起来,从而产生反冲力,在舒张期推动血液通过血管。通过这种机制(Windkessel 效应),左心室的间歇性射血可转变为血液在血管内的持续流动。
2. 毛细动脉
毛细动脉是动脉的最小分支,具有肌性血管壁,直径小于50 μm。动静脉为毛细血管网络提供血液,由于其直径较小,因此在全身循环中阻力最大。它们将搏动性动脉血压转化为毛细血管内的均匀压力。
毛细动脉血管内的张力是决定动脉血压的最重要血管因素,动脉直径的改变对SVR的影响最大(约60%)。因此,动脉血管能够控制流向组织的血流量。动脉直径受神经激素的调节,包括自主神经系统、肾素-血管紧张素-醛固酮系统和心房利尿钠肽。
3. 自主神经系统
自主神经系统负责调节许多生理过程,包括心率和血压。自主神经系统通过迷走神经和脊神经向中枢神经系统提供感觉信息。自主神经系统的两个主要分支是交感神经系统和副交感神经系统。
中枢神经系统通过迷走神经引起副交感神经对心率的调节。动脉血管张力主要由交感神经系统通过延髓的血管运动中枢进行调节。然而,副交感神经系统也会对血管张力产生一定的影响。血管运动中枢的输出通过交感神经链的神经节传递。交感神经系统还可通过释放儿茶酚胺对心率和血管运动张力产生影响。
03 动脉血压的生理性调节
心血管生理学中的一个重要概念是,血压由3个因素(HR、SV和SVR)决定。因此,血压的任何变化都是由其中一个或多个因素的变化引起的。这些公式有助于诊断全身血压异常的原因,从而决定适当的治疗方法。
必须严格调节动脉血压,以确保足够的器官灌注。只要动脉血压保持在正常范围内,器官血流就由动脉阻力决定。决定动脉阻力的主要因素是动脉直径,它能迅速做出反应,通过血管收缩或血管扩张来维持血流。
为防止动脉血压偏离正常值,并使组织血流与代谢需求相匹配,机体采用了多种保护性生理调节机制,其中一些机制可立即发挥作用(如血管内皮的局部控制和自动调节),另一些机制则需要较长时间才能产生效果(如肾素-血管紧张素-醛固酮系统和抗利尿激素)。
1. 局部调控——血管内皮
动脉血压的局部调控由血管内皮调节。血液中代谢产物(如钾离子、氢离子、二磷酸腺苷和乳酸盐)浓度的增加会放松血管内皮平滑肌。因此,随着代谢率的增加,流向器官中的含有这些产物的血液量也会增加。
此外,其他刺激(如内皮创伤)也会刺激血管内皮释放各种具有血管扩张或血管收缩作用的血管活性因子。血管舒张因子包括一氧化氮和前列环素,可改善组织血流。血栓素和内皮素-1则是血管收缩因子,会降低组织血流量。这些局部调控机制几乎都能立即发挥作用,而且半衰期很短。
2. 化学感受器
位于延髓中央以及主动脉弓和颈动脉壁外周的动脉化学感受器可检测到动脉二氧化碳分压(PaCO2)和氧分压(PaO2)的变化。这些信息会传递给血管控制中心。PaCO2的升高或PaO2的降低会导致交感神经张力的增加,从而导致HR和心肌收缩力的增加以及动脉血管的收缩,进而导致动脉血压的增加。这些效应可改善组织的供氧量。
3. 自主调节
自主调节是指无论动脉血压如何变化,器官血流都能保持接近恒定的一种现象。自主调节在大脑、脊髓、心脏和肾脏中最为有效。这些重要器官能够在MAP为 60-150 mmHg时维持自身血流。
当MAP低于这一自主调节范围时,重要器官的血流灌注就会受到影响,从而可能导致终末器官损伤。血流的自主调节主要通过局部代谢机制实现。消化系统(包括胃、肠、胰腺、肝脏和脾脏)的血流自主调节能力较差,因此在动脉血压波动期间最容易受到损伤。
4. 压力感受器反射弧
压力感受器是位于颈动脉窦和主动脉弓内的神经末梢,它们能检测到动脉血压波动引起的血管舒张变化。这些信息通过舌咽神经和迷走神经传递到血管控制中枢。
血管控制中枢通过改变交感神经和副交感神经的张力来发挥作用,从而使动脉血压恢复正常,这就是所谓的压力感受器反射弧。在动脉血压过低的情况下,压力感受器会检测到动脉伸展性降低,从而导致压力感受器的发射降低。因此,血管控制中枢会降低副交感神经张力,增加交感神经张力,从而导致HR和心肌收缩力增加以及毛细动脉收缩。总体效果是导致动脉血压升高。
而当动脉血压过高时则相反,它会导致毛细动脉舒张,压力感受器的发射增加,刺激血管控制中枢增加副交感神经张力,降低交感神经张力。最终导致动脉血压降低。
5. 儿茶酚胺
通过交感-肾上腺髓质轴,刺激交感神经系统会引发肾上腺释放儿茶酚胺(肾上腺素和去甲肾上腺素)。除其他作用外,这些儿茶酚胺会促进血管收缩(SVR升高)和HR加快,从而导致动脉血压升高。
6. 肾素-血管紧张素-醛固酮系统、抗利尿激素和心房利尿钠肽
动脉血压的长期调节主要由肾脏通过调整血容量来实现(图2)。这些调节机制起效缓慢。动脉血压的显著降低会导致肾脏交感神经张力增强,从而导致肾小球细胞释放肾素。肾素作用于肝脏中的血管紧张素原,形成血管紧张素I,再由血管紧张素转化酶转化为血管紧张素II。血管紧张素II通过直接作用于动脉血管引起血管收缩,从而导致SVR增加。
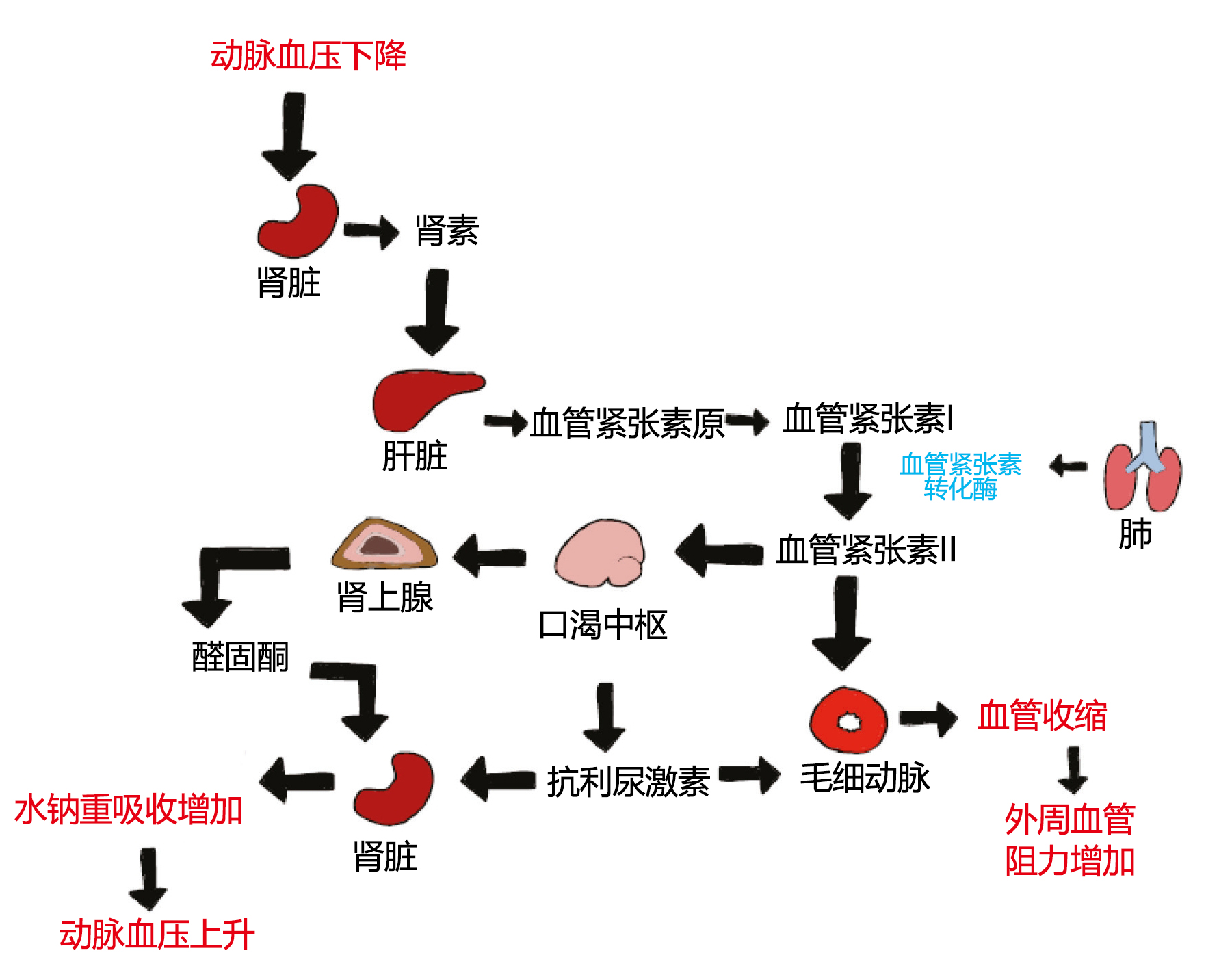
血管紧张素II的其他作用包括刺激口渴中枢、增加抗利尿激素的分泌和刺激肾上腺释放醛固酮。抗利尿激素会增加肾小管对水的渗透性,导致排尿减少。醛固酮是一种矿物皮质激素,作用于肾脏,刺激钠和水的重吸收,从而增加血容量。
在血容量增加的情况下,心房容量感受器会检测到心房壁的拉伸。为此,心房心肌细胞分泌心房利尿钠肽。心房利尿钠肽作用于肾脏,抑制钠的重吸收,导致尿液中钠和水的排泄增加,从而降低血容量。
04 低血压的病理生理学
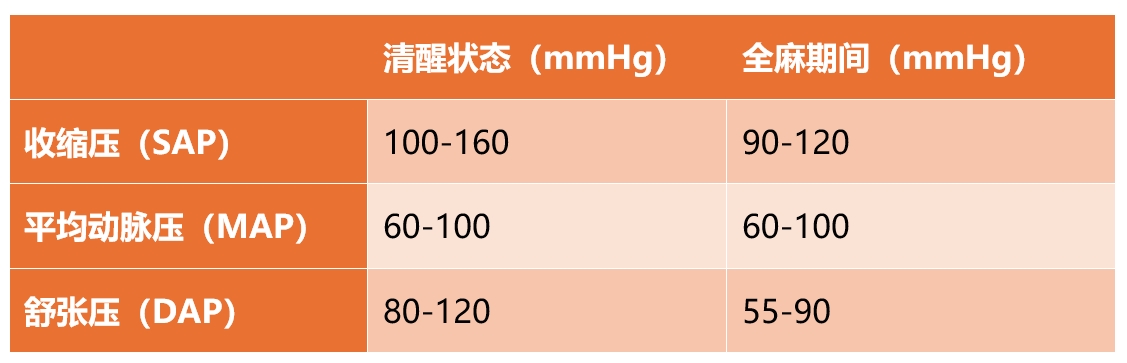
低血压的定义是动脉血压下降到生理上可接受的值以下,并始终被视为病态表现。表1列出了成年犬和猫动脉血压的正常参考区间。
低血压的原因可分为6大类:
- 低血容量性
- 血管舒张性
- 心源性
- 代谢性
- 阻塞性
- 药物/中毒性
人为失误或设备故障也可能导致测量错误。由于低血压时流向器官的血流量减少,组织中的氧气和营养物质供应不足,导致器官受损。最重要的是对重要器官(大脑、心脏、肺、肝脏和肾脏)的损害,严重时可造成永久性损伤或直接威胁生命。
麻醉状态下的低血压是指:
- SAP低于80-99 mmHg
- MAP低于60-70 mmHg
- DAP低于40 mmHg
麻醉患者发生低血压的风险会增加,因为许多麻醉剂会通过各种机制影响血压的生理性调节,包括抑制交感神经系统、抑制血管控制中枢和降低SVR。
在整个麻醉过程中都必须对动脉血压进行监测,以识别和治疗偏离正常值的情况,从而避免低血压对重要器官造成负面影响。有关低血压的病理生理学和治疗的更多详情将在本系列的第二部分中讨论。
05 动脉血压的测量
动脉血压可通过多种技术进行无创测量(无创血压),或通过动脉插管进行有创测量(有创血压)。无创血压测量的优点是相对简单、无痛、无任何感染风险,并可用于神志清醒的患者。建议对所有进行全身麻醉、局部麻醉和镇静的患者进行不间断的无创血压监测。
1. 无创血压监测
(1)听诊(Korotkoff)技术
听诊技术是一种用于人体的无创血压测量方法,自动设备可根据这种方法进行验证。它使用充气袖带、血压计和听诊器来听诊流经桡动脉的血液振动。当充气袖带的压力大于患者的收缩压时,就无法再听诊到脉搏。当袖带慢慢放气时,再次出现声音时的袖带压力为SAP,而当所有声音都消失时,则为DAP。然而,由于猫和狗的血管要小得多,人耳听不到,而且患者需要保持静止,因此该方法在兽医实践中的应用有限。
(2)多普勒超声血流探测器
与听诊技术类似,使用充气袖带和血压计闭塞血管中的血流。不过,声音是通过多普勒检测到的,将其放大到人耳可听到的程度。
对于外周血管收缩的患者来说,很难获得可听见的信号。这种方法被认为在麻醉犬中不可靠,只有66.7%-69.2%的时间能正确识别低血压,而且在从股动脉或足背动脉测量收缩压时总是低估收缩压。有人认为,对于体重小于5千克的狗,使用多普勒获得的值代表的是MAP,而不是之前认为的SAP。
在猫中,使用多普勒进行的测量会低估SAP,而与MAP更为接近,但这取决于袖带的大小。在使用袖带进行测量时,患者的毛发、腿部形状和患者的移动也会导致读数不准确。
多普勒超声血流探测器测量血压的方法如下:
- 如果患者神志清醒,应在安静的地方进行测量,紧张的动物可能会出现血压短暂升高。
- 选择大小合适的血压袖带。
- 选择合适的肢体或尾部,并将袖带放在预定放置探头位置的近端(即比探头更靠近心脏)。
- 在肢体或尾部远端夹一小块毛发,覆盖在血压袖带远端可触摸到脉搏的动脉上。
- 在探头上涂抹导电胶,然后放在所选动脉上检测脉搏。如果患者意识清醒,则应使用耳机,以免噪音造成的压力,这也有助于操作员在嘈杂的环境中识别脉搏。
- 检测到可闻及的脉搏后,使用血压计给血压袖带充气,直到听不到脉搏为止。
- 然后缓慢降低袖带压力,直到再次听到脉搏。此时的血压度数被认为与5千克以上的狗的收缩动脉压和5千克以下的猫狗的平均动脉血压相关。
- 应丢弃第一个读数,再进行5-7次测量,因为运动或焦虑可能导致虚假读数。
- 如果发现测量值有明显变化,应重新开始测量。
- 如果连续测量结果呈下降趋势,则应继续读数,然后计算平均读数。这可能是由于动物正在适应这一过程。
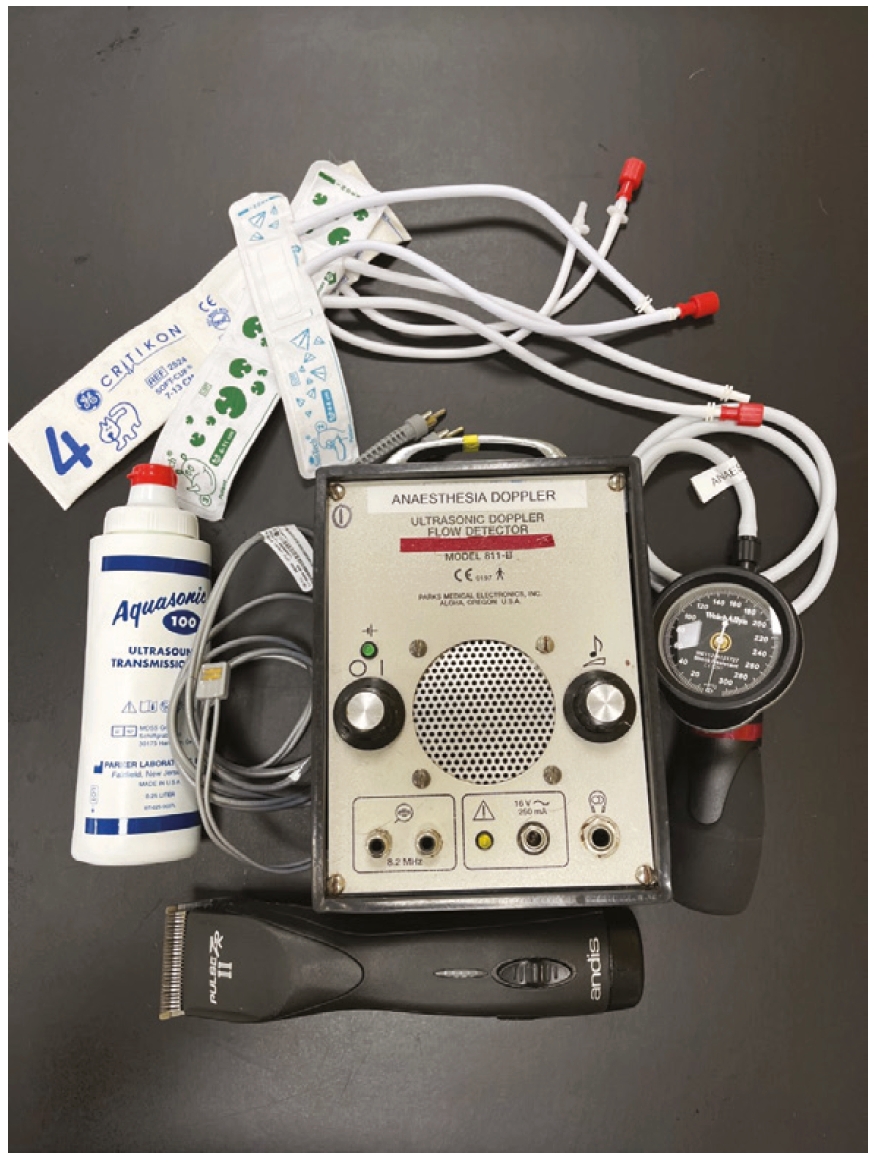
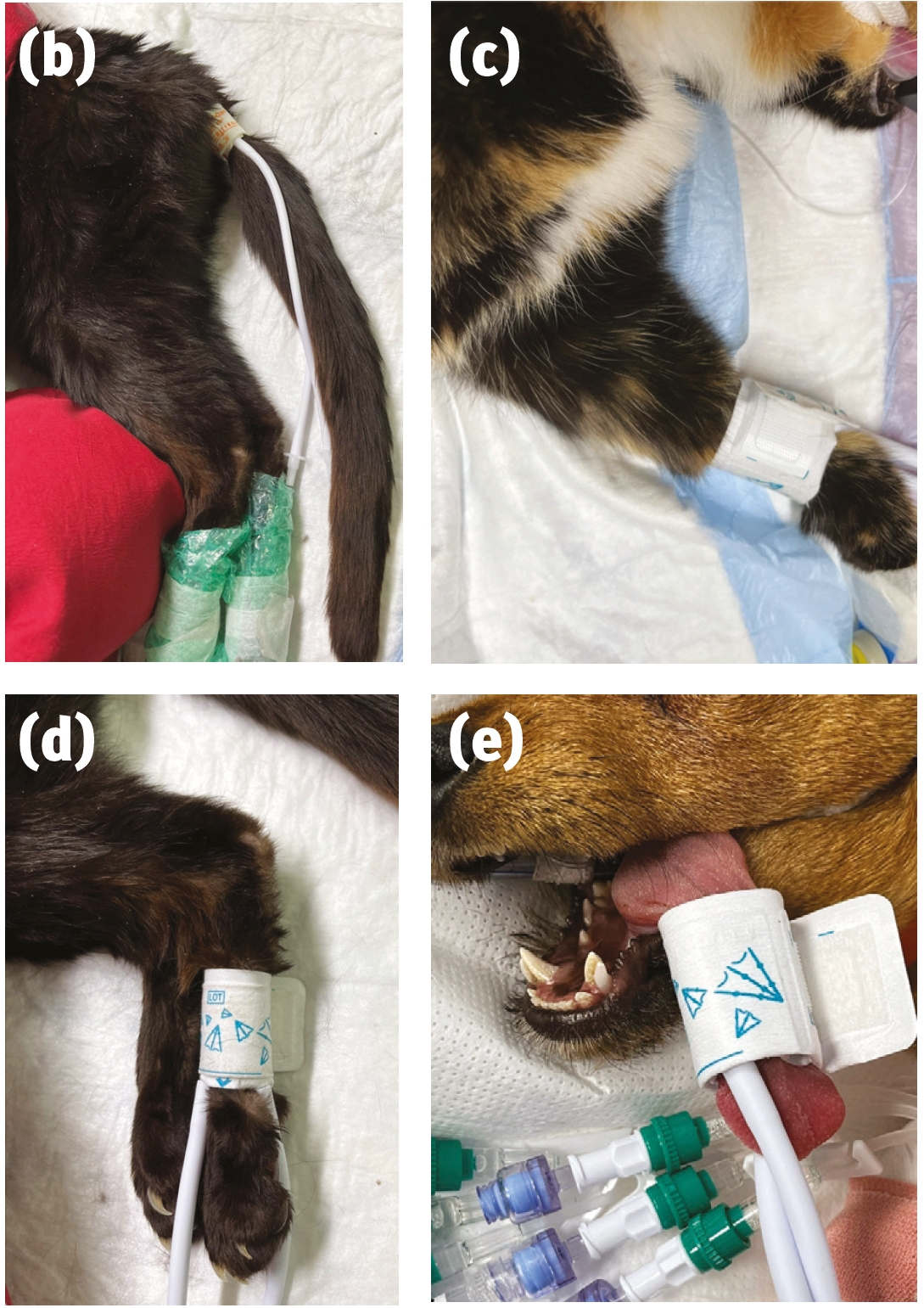
- 在全身麻醉期间,没有必要测量多个读数的平均值。除非读数异常,否则每次检查时只需进行一次读数。使用胶带将多普勒探头固定在适当位置是非常有用的,这样就可以在手术期间进行多次读数。这种胶带在麻醉结束时很容易撕下,不会对患者造成伤害。如果脉搏丢失,可以在胶带下操作探头来重新定位。图3展示了多普勒血压测量所需的设备。
关于使用示波技术测量前肢或后肢血压时,袖带应放置在关节上方还是下方,文献中尚未达成共识。兽医应了解每个特定监护仪的验证研究中袖带的放置位置。注意袖带上的动脉标记。该标记位于充气袖带的中间,应直接放置在用于测量的动脉上方,以提高准确性。图4展示了袖带的放置位置。
(3)光学压力计
光学压力计依靠脉搏血氧仪产生可见的脉压波形。与多普勒方法类似,脉搏血氧仪探头上方放置一个可充气的血压袖带。当使用血压计给袖带充气时,由于动脉搏动血流被阻止,脉压波形图将会消失。慢慢放气袖带,直到波形重新出现。
这种方法在动物身上有很多局限性,包括波形返回延迟和难以将探头放在肢体远端。已发现光学压力计始终低估了SAP值,与多普勒方法一样,有人认为它比SAP更能代表猫的MAP值。这种方法未被广泛使用,也不是动物无创血压测量的推荐方法。
(4)示波仪
动物患者可以使用多种类型的示波仪。制造商之间的价格差异很大,但应注意有些设备可能未经动物群体验证。技术通常是相似的,但不同设备在测量过程中使用的计算机算法会有所不同。
示波测量技术将充气袖带充气至动脉供血闭塞。然后设备以线性或阶梯式方式缓慢放气。当袖带放气时,设备内的压力传感器会检测到袖带内因搏动性血流恢复而产生的压力振荡。MAP被认为是最准确的值,因为它是在袖带下的波动达到最大值时测量的。根据设备的不同,可以测量或计算DAP和SAP。示波压力曲线图见图5。
在心律失常、脉搏缓慢或严重低血压的情况下,示波测量装置可能无法很好地工作。事实上,在使用α2肾上腺素能激动剂进行镇静或预处理的动物中,许多示波仪的功能都不是很好,这主要是因为血管收缩、心动过缓和心律失常会因此而发生。
与有创血压设备相比,间歇监测意味着读数显示在所用设备的屏幕上时是回溯性的。设备将输入信号与预先编程的脉搏波相匹配。然而,由于动物的心率较高、Qt值较低和动脉直径较小,许多设备中的这一脉搏波是基于人体脉搏的,可能与动物的输入信号不同。这可能导致结果不够准确。
示波测量技术的一个优点是可以减少操作员带来的变化。大多数设备都可以通过编程定期进行自动测量。由于存在肢体(或尾部或舌头)缺血的风险,建议测量频率不要超过每三分钟一次。虽然不常见,但人类文献中也有记录因长时间放置无创血压袖带而导致外周神经损伤的病例报告。不过,其发生率仍然未知。
虽然无创血压袖带导致周围神经损伤的确切机制尚不清楚,但已提出了几种可能的促成机制,其中包括:袖带边缘的直接机械压迫导致髓鞘疝出、神经缺血和双重挤压综合征。目前还没有动物患者的此类病例报告。
(5)高清示波仪
高清示波仪可以每隔1-10分钟重复监测一次血压,与计算机连接后可以直观地测量袖带压力放气和测量到的示波。高清示波仪可检测心律失常和伪影(因此可排除异常结果),并且无需使用算法即可测量DAP、MAP和SAP,与基于算法的示波测量设备相比,可提高准确性。
尽管有这些明显的优势,但最近的研究发现,高清示波仪的性能并不比传统的示波测量设备好,而且许多设备的准确性都没有达到美国兽医内科学院 (ACVIM) 的验证标准。
其他值得注意的无创血压检测的局限性和相关故障的排除方法如下所述,可能影响设备读数的患者因素包括:
- 当患者有意识时,患者的顺从性、肌肉张力和焦虑等因素会影响准确性。患者疾病、治疗干预、体型和解剖结构也会影响所用设备的准确性。操作员失误、经验不足、袖带部位和尺寸不正确也都是需要考虑的因素。
- 如果袖带放置在卧位患者的前肢上,前肢屈曲可能会导致读数错误。
- 服用α2肾上腺素能激动剂可能会使设备无法检测到外周脉搏,尤其是在最近服用的情况下。
如果示波仪无法读取,可以进行以下检查:
- 确保示波仪袖带正常工作(是否有袖带松脱、袖带漏气)。
- 如果怀疑袖带漏气,请使用新袖带。
- 尝试将袖带移至其他位置。
- 尝试换用其他示波装置(如有),以排除技术故障。
什么时候才能相信读数结果?
- 大多数示波设备在报告动脉血压的同时会报告脉搏率。验证监护仪上显示的脉搏率是否与实际脉搏率相符。如果脉搏率不匹配,则血压读数可能是假的。
- 确保使用了尺寸合适的袖带和放置部位。袖带尺寸和松紧度不当会导致血压测量值不准确。袖带宽度应约为肢体或尾部周长的40%,长度应足以环绕肢体或尾部而不会过紧。此建议也适用于舌头。袖带过大和(或)过紧会导致血压读数偏低,而袖带过小和(或)过松则会导致血压读数偏高。
- 确保袖带位置与心脏处于同一水平。如果袖带位置高于心脏,则读数会偏低;反之则读数可能偏高。目前的ACVIM指南建议,如果袖带与心脏的垂直距离超过10厘米,则应使用校正数据(±0.8 mmHg/cm)。如果对有意识的动物进行测量,则应将患者轻轻束缚在侧卧位上,以尽量减小这一误差。也可以使用尾根部,并将动物胸部束缚。
如何验证示波装置?
在兽医学中,对有意识和麻醉的动物通常都要进行无创血压测量,这些测量结果是诊断和治疗干预的基础。因此,了解这些方法的准确性非常重要。所有获得医疗仪器认证的无创血压设备都必须符合特定的标准,才能在人体中使用。在验证用于人体的设备时,与使用听诊法获得的数值相比,这些设备必须满足以下标准中的两项:
- 74%的测量值差别必须在5 mmHg范围内
- 至少88%的测量值差别在10 mmHg范围内
- 至少97%的测量值差别在15 mmHg范围内
此外,与听诊值相比,设备必须全部符合以下标准:
- 66%的测量值差别在5 mmHg范围内
- 至少82%的测量值差别在10 mmHg范围内
- 96%的测量值差别在15 mmHg以内
需要注意的是,ACVIM和高血压共识小组以及兽医血压协会建议将间接设备与有创血压测量值进行比较,以进行验证。在动物群体中进行的研究表明,没有任何无创血压设备符合所有验证标准,因此在解释测量结果时应谨慎并结合其他临床症状。
2. 有创血压测量
有创血压测量被认为是动脉血压测量的“金标准”,与无创血压相比,它能提供更精确的测量,可靠、连续、逐搏的信息。在动物体内,动脉置管通常是在镇静或全身麻醉时进行的,但一些重症患者也可以在意识清醒时接受置管。还可通过监护仪上显示的动脉波形推断有关SV、SVR和收缩力的其他信息。
不过,有创血压测量需要昂贵的设备、特定的消耗品和将置管插入动脉的专业技术,这对体型较小的患者尤其是猫来说尤其具有挑战性。
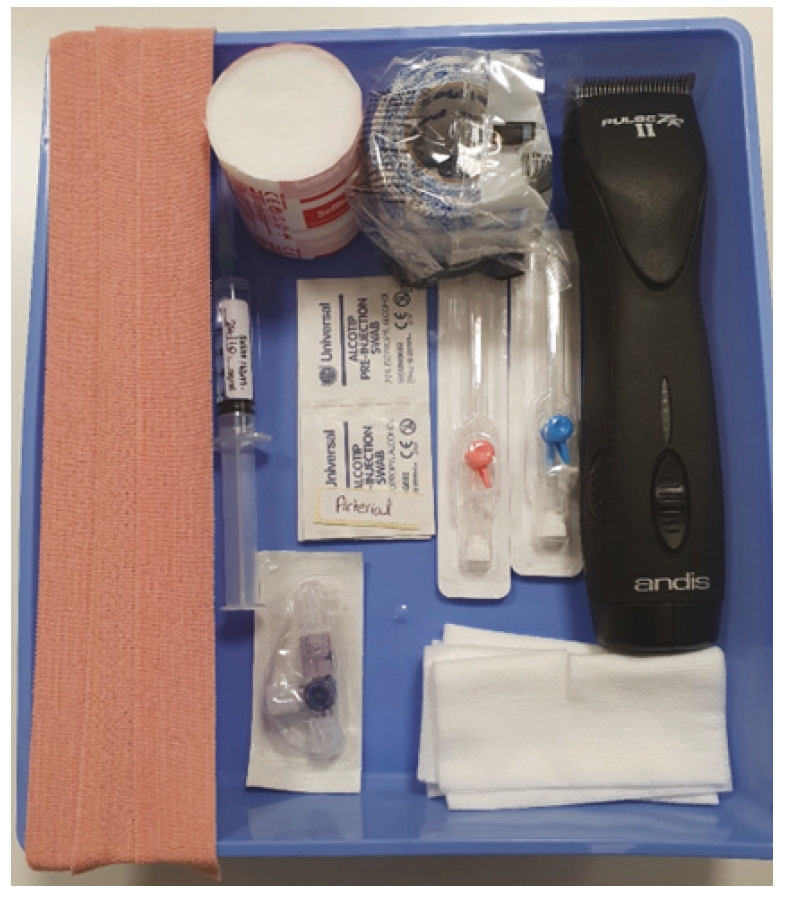
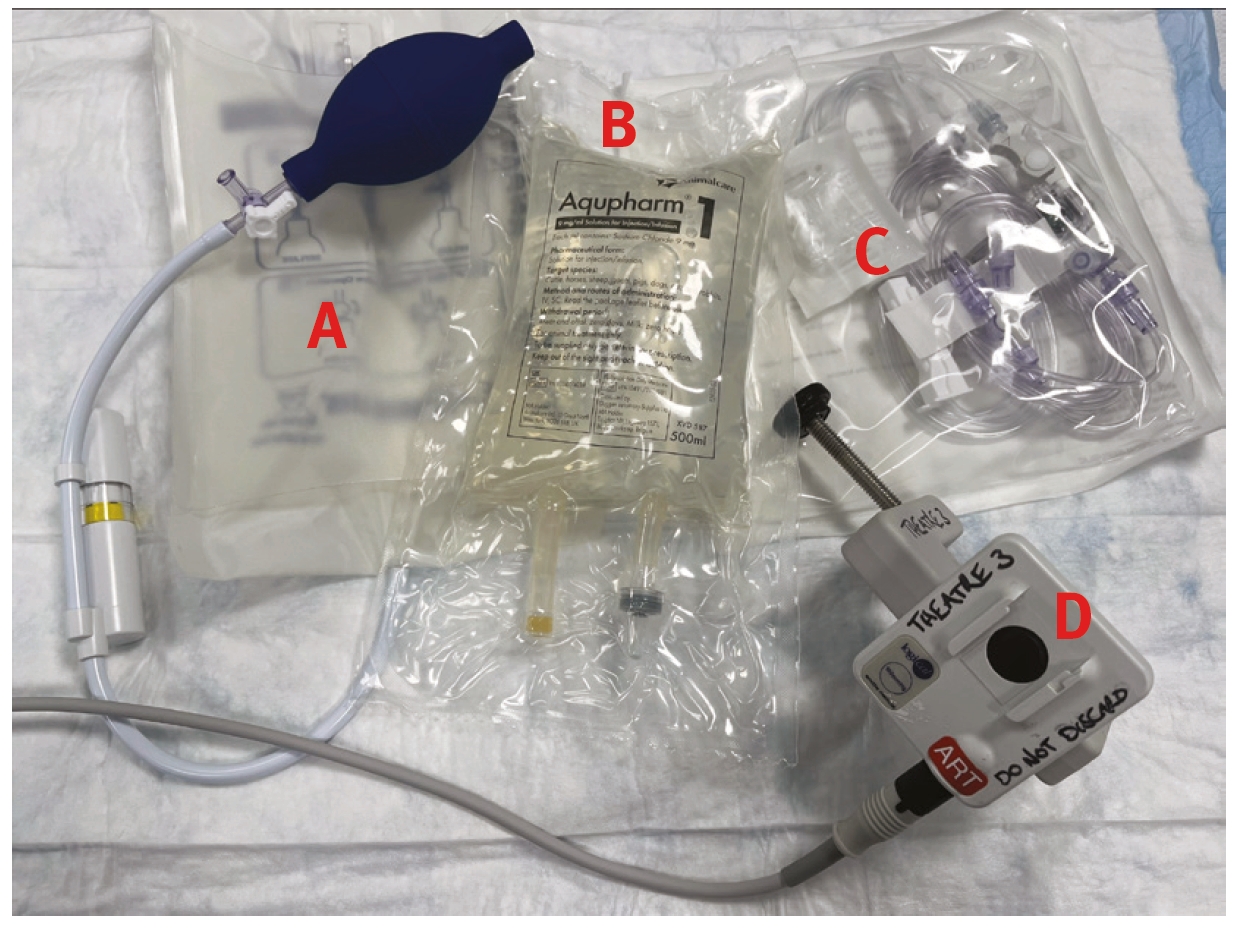
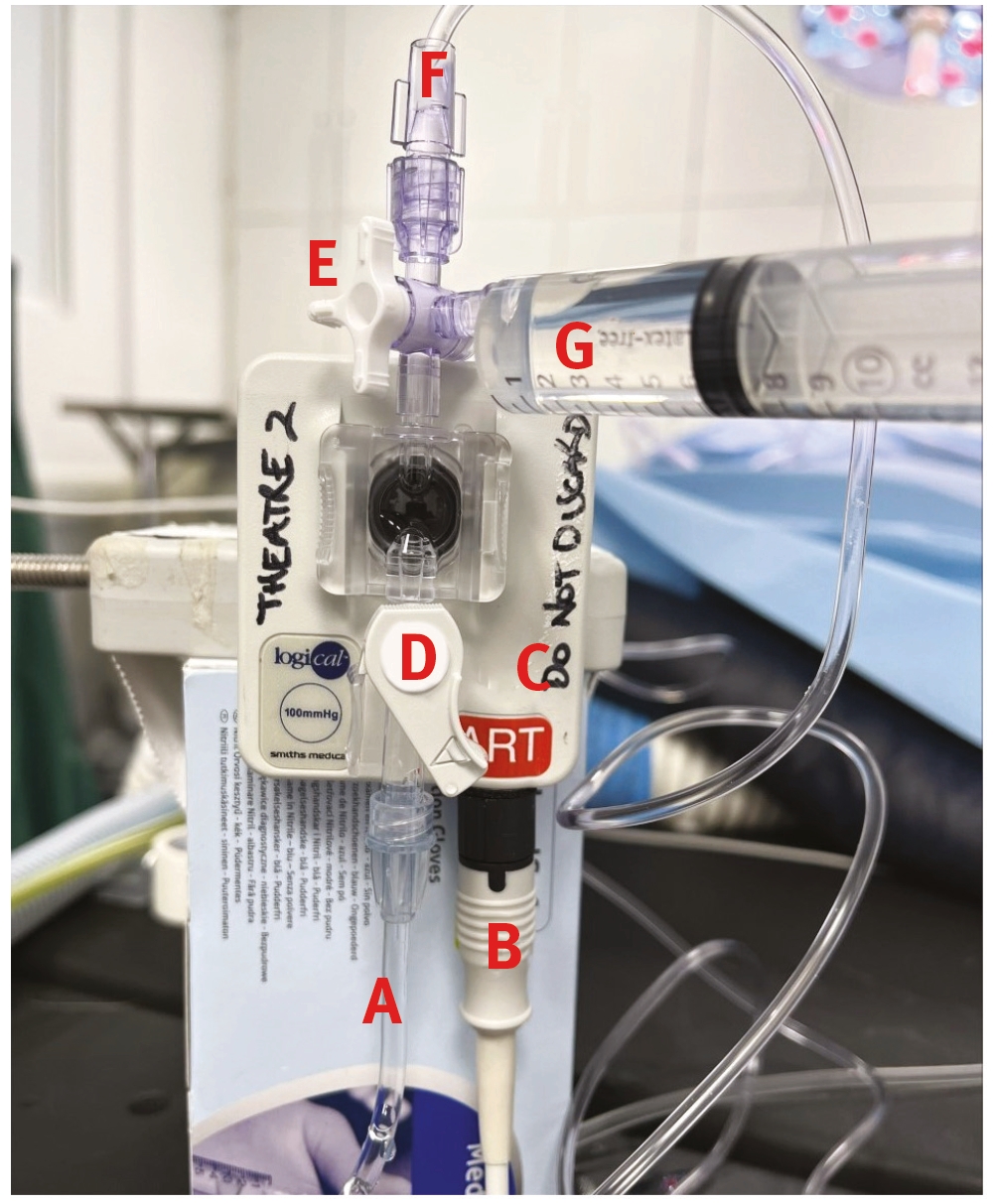
足背动脉是猫狗最常用的动脉通路。其他可能的入路部位包括耳廓中动脉、尾骨动脉、股动脉和桡动脉。动脉置管需要的设备如图6所示。
动脉置管的适应症包括:
- 需要重复抽血(如麻醉期间的连续血糖测量、连续动脉血气分析)
- 预计有大量出血的情况
- 预期血压波动较大的手术(如严重心血管疾病、嗜铬细胞瘤)
- 难以进行无创血压测量的动物(如法国斗牛犬等四肢呈圆锥形的犬、腊肠犬等四肢短小的犬)
- 测量结果可能不可靠时(如心律失常时)
- 重症监护环境中的重症患者
- 需要全身麻醉的心脏病患者
动脉置管的禁忌症包括:
- 凝血功能障碍
- 预期穿刺部位感染
- 该区域侧支循环不畅
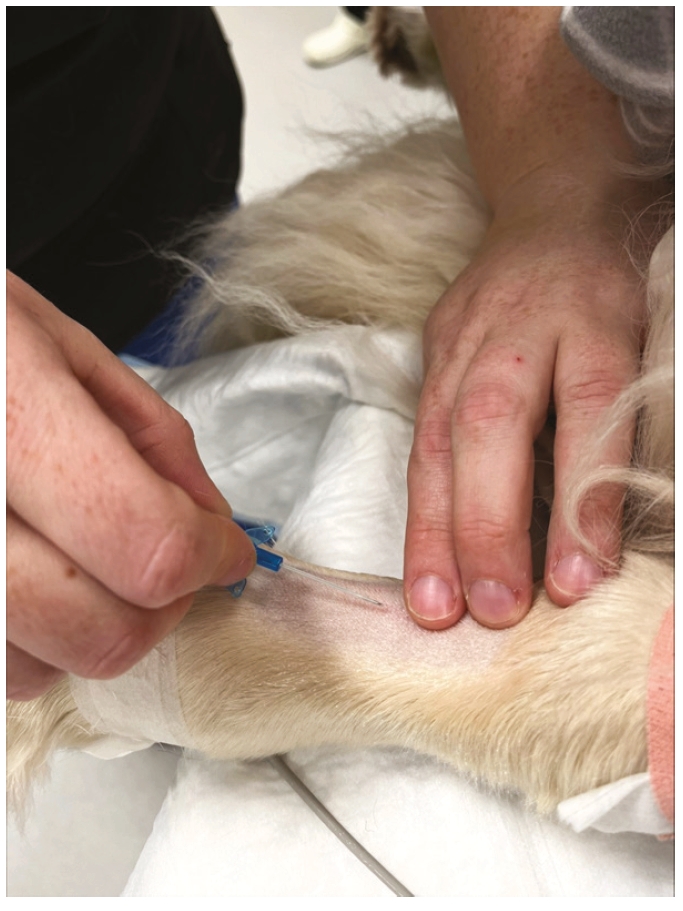
动脉置管的步骤如下所述(图7-12):
- 插入动脉置管时会感到疼痛,置入前应对患者进行麻醉或镇静。如果无法做到这一点,可以考虑使用局部麻醉剂,但这可能会影响小动脉的置管。身体状况极差的动物可以在清醒状态下接受置管。
- 用手触摸所需的外周动脉,并将毛发夹起
- 无菌备皮
- 清洗双手或戴手套
- 经皮肤插入置管,并沿着动脉血流方向(朝向心脏)推进
- 用生理盐水预先冲洗置管可能会有帮助,尤其是使用小口径置管时。如果皮肤较硬或较厚,可以用皮下注射针头或手术刀刀片最锋利的部分划一个小口
- 一旦在管中看到回血,就推进针头。置管中的搏动性血流可确认定位。如有疑问,可使用动脉血气分析,或连接到监视器上检测脉波。
- 套上无菌帽,用胶带固定置管
- 将预先冲洗好的三通管连接到置管上,并用胶带固定
- 用生理盐水冲洗置管以确认通畅,通常可在注射器顶端看到搏动性血流或血液流入注射器中
- 包扎动脉置管
- 贴上标签,标明该部位为动脉置管
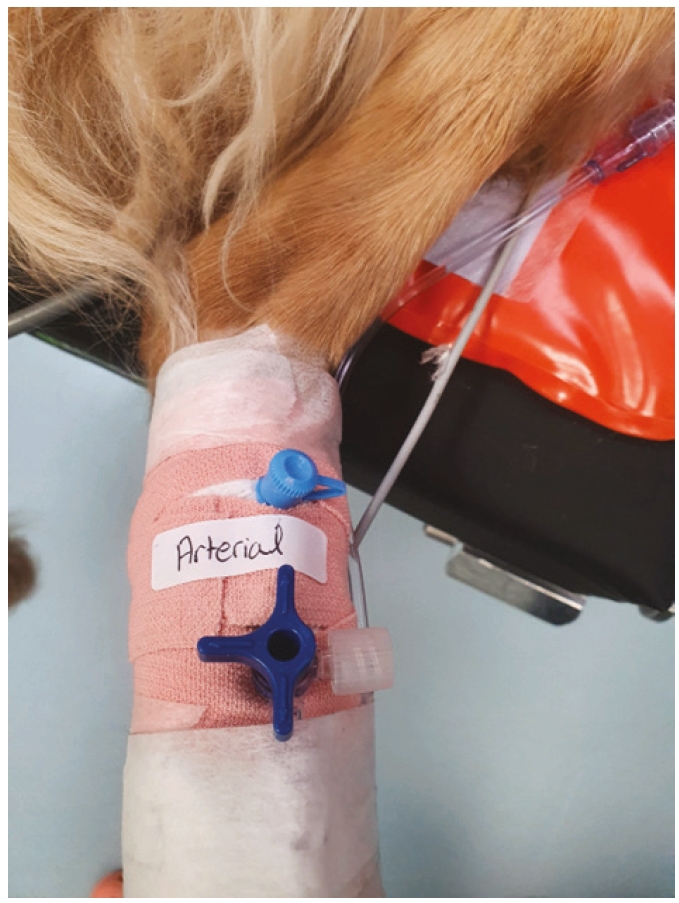
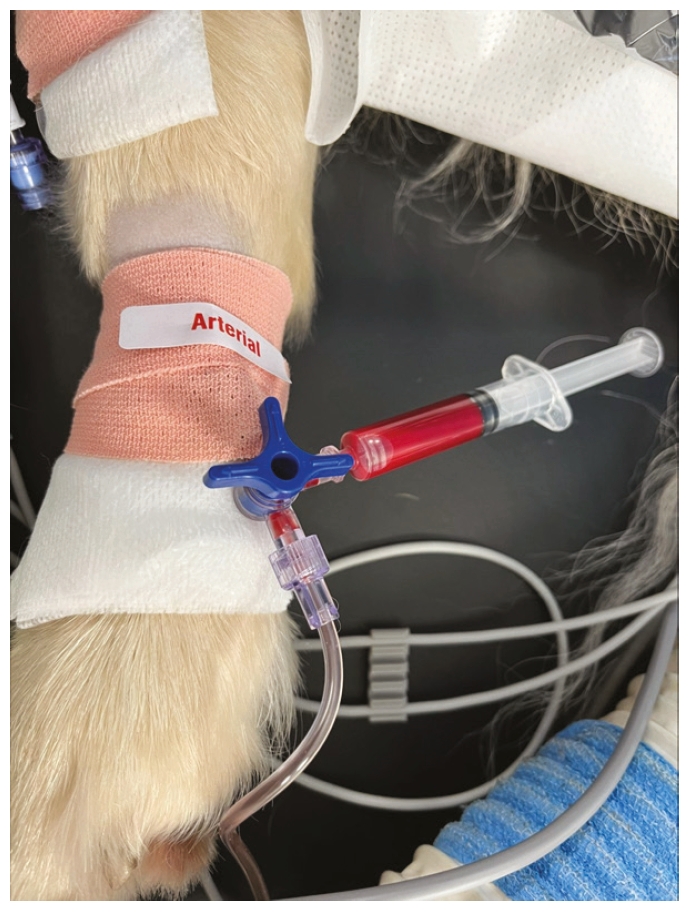
(1)猫的特殊性
由于猫的外周动脉较小,因此在猫身上成功放置动脉置管尤其具有挑战性。由于操作会导致动脉血管痉挛,因此切开技术的效果甚微。此外,由于侧支循环有限,足背动脉或股动脉置管可能会导致猫的足垫缺血。虽然这种情况很少见,但有病例报告过一只猫的足背动脉血栓伴缺血性肢体远端坏死和感染,与动脉置管有关。
(2)并发症
由经验丰富的人员进行动脉插管被认为是相对安全的,主要并发症的风险较低。然而,还需要进一步的研究来评估动物患者的并发症。
动脉置管的轻微并发症包括暂时性动脉闭塞、血肿形成、穿刺部位出血和置管闭塞。主要并发症包括感染、败血症、空气栓塞和永久性缺血损伤。小体型患者的置管出血也会造成严重的临床后果,因此必须对置管进行仔细监测。人为失误导致的意外动脉注射是另一个风险,确保置管的标注正确,可以降低发生这种情况的可能性。
在人类中,外周动脉置管的主要并发症发生率不到1%。有关动物患者动脉置管并发症发生率的文献报道很少。一项前瞻性临床研究回顾了在重症监护病房内对狗和猫使用动脉置管的并发症。报告说19.2%的狗和17.2%的猫出现了轻微并发症(包括因扭结或血块导致置管闭塞,以及因包扎过紧导致置管部位远端肢体肿胀)。
另一项对35只猫进行的回顾性研究报告称,23.7%的病例出现轻微并发症,2.6%的病例出现严重并发症,而且动脉置管维持时间较长的猫出现动脉闭塞的风险显著增加。
(3)有创血压监测的技术问题
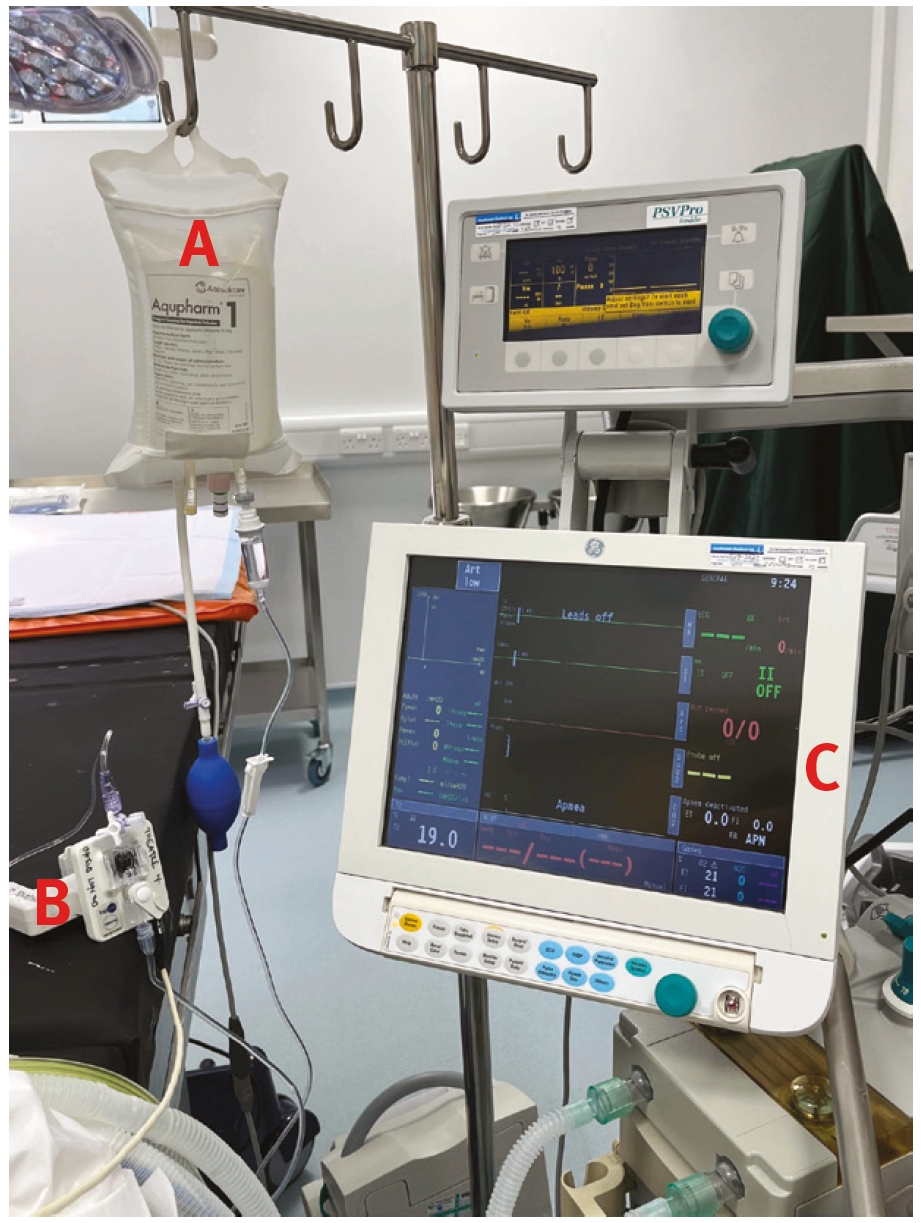
动脉置管置入后,通过注满生理盐水的管道和压力传感器连接到合适的监视器上,压力传感器将生物信号转换成数字信号,并显示在屏幕上。使用相对坚硬的塑料管,这样压力信号就不会在管内“丢失”。该导管连接到一个加压液体袋(通常为含/不含肝素的0.9%生理盐水)上。对液体袋进行加压,使少量液体缓慢通过整个系统(约4 mL/h),以防止血液在置管中凝结或逆向流入管道。
将压力传感器放置在主动脉根部(心脏底部)的近似位置,以消除静水压对传感器读数的影响。在动物体内,当患者处于卧位时,这个位置相当于患者的肩部。当患者处于侧卧位时,这个位置相当于胸骨中部。将传感器定位在心脏水平以下会导致动脉血压被高估,而将传感器定位在心脏水平以上则会因静水压效应而导致动脉血压被低估。
通常情况下,插管上会增加一个三通管(旋钮),以便采血。另一个三通管安装在传感器上,以便将系统归零至大气压。将传感器归零时,三通接头对患者关闭,对大气开放。然后在监视器上选择零压功能。
归零后,重新调整三通管旋钮的方向,使生理盐水柱直接与置管相连。此时必须注意不要将置管连接到大气中,否则会导致血液逆流进入管道。一旦方向正确,压力波形就会显示在监视器屏幕上。换能器上的三通管还可以在信号丢失时更有力地冲洗置管。如果置管在手术帘下无法进入,也可在此时采血。
(4)有创血压监测的物理原理
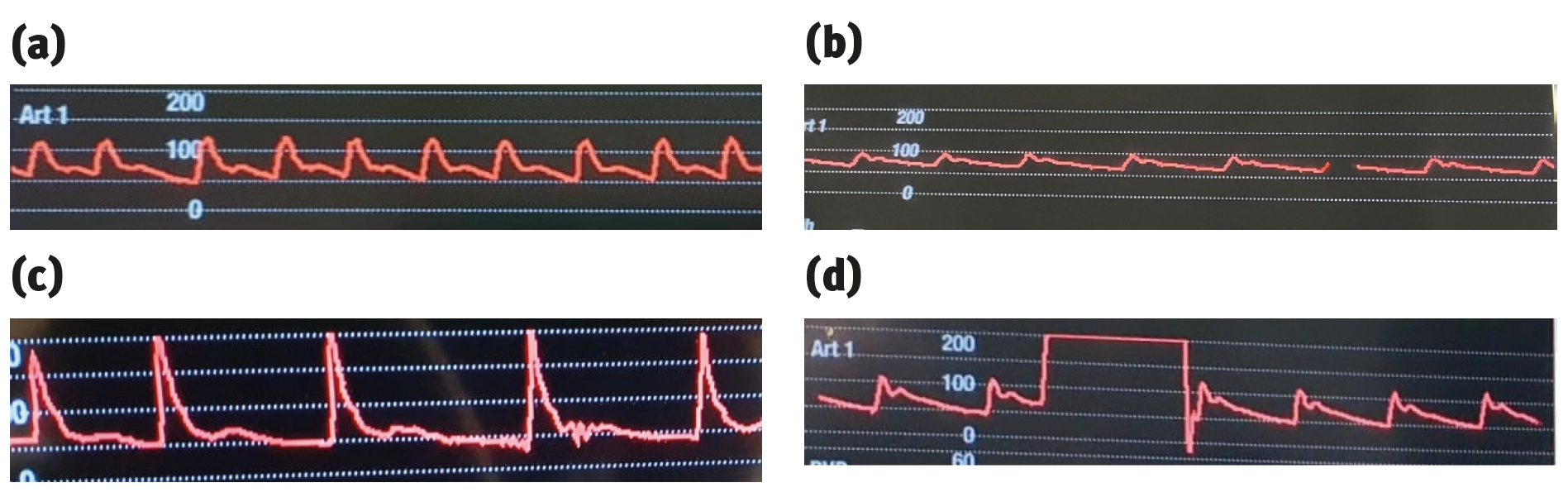
显示波形的质量取决于两个动态因素:共振和阻尼。如果系统中这两个因素不理想,显示的波形就会出现偏差。
当内部液体受到动脉内搏动性血流的干扰时,与动脉置管和换能器相连的充满液体的柱子就会摆动(有规律地来回移动)。如果扰动过大,就会在监视器上显示出夸张的响应,即共振。共振会导致SAP出现人为的增加,DAP出现人为的减少,而MAP基本不受影响。
系统内的共振由阻尼抵消。阻尼描述了系统恢复的速度。如果系统阻尼过大,部分信号将丢失,SAP将被低估,DAP将被高估。如果系统阻尼不足,信号将被夸大,SAP将被高估。不过在这两种情况下,MAP通常都是准确的。因此,测量系统必须具有最佳的共振和阻尼,才能在监视器上显示准确的波形。
造成阻尼过大的因素包括动脉管路中的气泡或血凝块、使用小管以及太软的管。造成阻尼不足的原因包括置管相对于血管过大、所用管道过长或直径过小。为防止出现欠阻尼或过阻尼,必须使用大小合适的置管和相对硬、短且直径较宽的管道。如果出现阻尼不足或过大的情况,应确保置管没有打结,管路中没有气泡或血凝块,并且系统压力适当。动脉波形示例见图13。
06 总结
动脉血压通过复杂的生理机制维持在一个狭窄的范围内。要解释动脉血压值并在必要时确定适当的治疗方法,就必须了解这些机制并认识到不同测量方法的局限性。本系列的第二部分将讨论低血压的病理生理学及治疗方案。
参考文献:Rollet, M., Auckburally, A. and Elsom, J. (2024), Arterial blood pressure. Part 1: physiology and measurement in cats and dogs. In Practice, 46: 220-235.