
| 一般情况 | |
|---|---|
| 品种:短毛猫 | |
| 年龄:3岁 | |
| 性别:外观雄 | |
| 是否绝育:不详 | |
| 诊断:性发育障碍 | |
01 主诉及病史
因腹泻、厌食、呕吐和高热就诊。
曾有过便秘病史,通过灌肠治疗后得到缓解。主人是从收容所中救出这只猫的,他不知道更多的既往病史,也不知道其是否做过绝育手术。猫在家里没有表现出雄性行为(攻击或标记领地行为)。
02 检查
体重4千克。体格检查发现结肠内有大量硬粪便,阴茎缺如,阴囊内也没有睾丸。全血细胞计数和血生化均未发现异常。
腹部超声发现结肠内有大量粪便,在降结肠附近和膀胱头端还有一个直径约1 cm的充满液体的结构(下图)。通过细针穿刺获得的内容物经细胞学分析后发现细胞度较差,有少量炎性细胞(中性粒细胞和小淋巴细胞),提示存在炎症。
↑ 降结肠(红圈)附近结构的超声检查结果。
CT显示在降结肠腹侧和膀胱尾部有一个管状结构,两条分支均呈腹尾走向,其中一条分支的末端靠近结肠壁,另一条分支则向左腹股沟管延伸,到达腹股沟皮下组织,末端为结节状结构,尺寸约为10×9×19 mm。尾端的分支位于结肠腹侧,为盲端,距离肛门约3 cm。这些发现提示该猫同时存在雌性和雄性生殖器,似乎有两个子宫角、一个隐睾和一个疑似残余子宫的管状结构(下图)。
↑ 对比后的CT图像。(A)和(B)显示降结肠腹侧有一个管状结构,管壁吸收率高(黑色箭头)。(C)和(D)显示该结构有两个分支(白色箭头)。(E)左腹股沟皮下组织有一个结节状结构,降结肠腹侧有一个管状结构,管壁高吸收,内部低吸收,与残余子宫吻合(黑色箭头)。
03 手术
进行了剖腹探查术。通过腹中线切口进入腹腔,切口从脐尾部2 cm处开始,一直延伸到耻骨。
检查盆腔时,发现一个管状结构与降结肠腹壁粘连,末端是一个含有液体的死腔。使用钝头剪刀将该结构解剖至靠近骨盆尿道的起源处,并在此处确认了其直径的增大。从这个较宽的区域发现了另一个管状结构隆起。第二个结构穿过左侧腹股沟管,在其末端有一个类似睾丸的小结构(下图)。术中发现骨盆尿道和管状结构之间有连接。该结构被尽可能的从靠近骨盆尿道处切除。切除的所有组织都进行了组织病理学检查。
↑ 术中发现。两个管状结构(H)汇聚成一个更宽的结构,类似子宫体。在一个管状结构的末端,有一个类似睾丸的小结构(T)。
组织病理学显示,两个子宫角萎缩,结构正常,但子宫内膜腺体发育不良,一个发育不良的睾丸和附睾附着在其中一个子宫角上(下图AB)。睾丸显示出一个由肿瘤性多面体上皮细胞组成的区域,这些细胞呈巢状排列,夹杂在稀少的纤维血管基质中。这些肿瘤细胞有细小的空泡状嗜酸性细胞质和中度多形的卵圆形细胞核。有丝分裂指数为每10个高倍视野中1个。提示为睾丸间质细胞(Leydig细胞)肿瘤。此外,还出现了囊性和出血区(下图B)。与附睾相连的是输精管(下图C)。子宫角(下图D)以慢性炎症为特征(下图E),间质有中度弥漫性炎症浸润,由浆细胞、淋巴细胞、巨噬细胞和少量中性粒细胞组成。另一个子宫角的末端由大量脂肪细胞组成,位于胶原基质之间,存在出血和血管腔(下图F)。
↑ 组织病理学结果。睾丸和附睾(A)、睾丸肿瘤区(B)、(C)、子宫角(D)、子宫炎症浸润(E)和带有出血的脂肪组织(F)。
04 遗传学分析
对外周血进行了细胞遗传学分析,使用肝素化试管采集的外周血进行。根据标准方案建立淋巴细胞培养。结果显示存在37,X/38,XY嵌合体核型(下图)。分别有15%和85%的淋巴细胞发现了该类型细胞系。51个(85%)分裂相的核型为38条染色体,存在X和Y染色体,9个(15%)分裂相的核型为37条染色体,缺少Y染色体。
↑ (A)和(B)来自非整倍体37,X细胞系的染色体核型图。(C)和(D)来自38,XY细胞系的染色体核型图。箭头表示Y染色体。
从本病例和两只对照组猫(一公一母)身上采集全血和毛发样本进行DNA检测。PCR结果证实,从本病例的全血和毛发中分离出的DNA中含有SRY和ZFY基因(下图)。
↑ SRY和ZFX/ZFY部分序列的PCR扩增结果。CASE-本病例;C♀-对照组雌猫;C♂-对照组雄猫;NTC-无模板对照;M-分子量标记。
SRY(性别决定区Y基因)位于Y染色体,该基因指定了睾丸分化的开始和个体的性别。鉴于在外周血中进行的细胞遗传学分析结果显示该猫大多数细胞具有Y染色体,因此进一步分析了SRY基因在睾丸组织中的表达,以更好地了解该猫的表型。结果发现本病例睾丸组织中的SRY基因表达量比对照猫减少了97.5%(下图)。SRY基因表达量的减少可能与该猫的性发育异常有关。
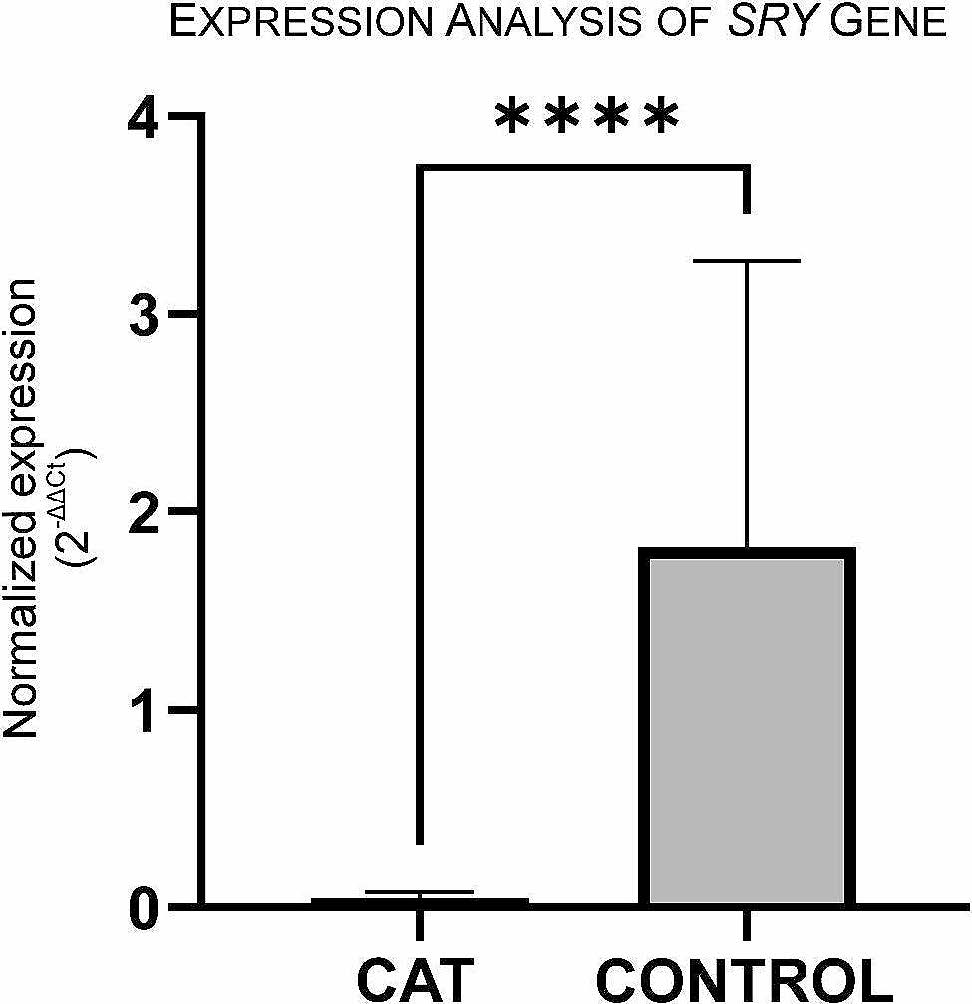
↑ 本病例(CAT)和对照组睾丸组织中SRY基因mRNA的表达水平。****p<0.0001。
05 讨论
性发育障碍(Disorders of sexual development,DSD)以前被称为两性畸形或雌雄同体,是影响生殖的重要因素,因为它会对生育能力产生有害影响,增加性腺肿瘤发生的风险,导致行为问题,还常常伴有其他先天性畸形[1]。
DSD主要分为三类:性染色体DSD(由性染色体异常引起);XX DSD(患有这种疾病的个体具有正常的女性性染色体)和XY DSD(患有这种疾病的个体具有正常的男性性染色体)[1, 2]。
另一方面,异常的内生殖器和持续存在的穆勒氏管显示这些结构未能退化。这些导管会发育成雌性的子宫角、子宫和部分阴道。这种异常是抗穆勒氏管激素缺乏或其受体缺乏的结果[3],约50%的病例与隐睾有关[4,5]。这种疾病在犬(尤其是迷你雪纳瑞)中的描述较多,是一种常染色体隐性遗传[5],但在猫中的描述则较为罕见。患有DSD的动物可能直到出现子宫积脓、尿路感染、前列腺疾病或发烧等临床症状时才会被诊断出来[5,6]。
对生殖器异常动物的细胞遗传学分析表明,这种表型通常与染色体结构或染色体数目的异常有关,如X单体[1]。然而,关于猫37,X/38,XY嵌合体的报道却很少[2,7]。在这些研究中,37,X/38,XY细胞系分别在90%和10%;96%和4%的淋巴细胞中被发现。
本研究描述了一例具有37,X/38,XY嵌合体核型的DSD猫,该病例具有非常罕见的组织病理学特征。这是第一例报告患有性染色体DSD猫同时患有睾丸间质细胞(Leydig细胞)肿瘤和慢性子宫内膜炎的病例。
在男性中,Y染色体基因的性别决定区(SRY)负责启动一连串错综复杂、相互作用的遗传信号。在性腺中诱导SRY的表达能够指定睾丸分化的开始和个体的性别发育方向[12]。
SRY似乎对SOX9基因的激活起作用[13]。除了SRY激活外,SF-1基因似乎也是启动SOX9表达的必要条件。SRY和SF-1结合在SOX9的相同启动子序列区域。然后SOX9在胚胎性腺中启动Sertoli细胞的形成和性索组织。尽管SRY主要在胚胎发生过程中活跃,但在不同物种中,精原细胞、圆形精母细胞和成体睾丸的Sertoli细胞都表达SRY[14,15]。在SF-1的刺激下,Sertoli细胞分泌穆勒氏管抑制物质,从而诱导穆勒氏管退化。Leydig细胞在同一蛋白的影响下分泌睾酮,刺激Wolffian管成熟发育为附睾和输精管[5]。
本病例报告描述了一例罕见的雌雄同体猫,它的外周血核型为37,X/38,XY,尽管血液和毛发中SRY阳性,但性腺中几乎没有SRY基因表达,因此可以将该病例归入性染色体DSD组。在狗身上报道过几例DSD病例[16-18],但在猫身上却很少见,可能是因为缺乏核型分析。
在为数不多的病例中[7],所报道的猫有行为问题和明显的生殖问题,如隐睾,而在本病例中,猫只有腹泻和不明临床症状。CT扫描对指导临床治疗至关重要,因为该动物所表现出的临床症状均与生殖系统无关。CT发现在骨盆入口处有两个管状结构汇聚在一起,类似于既往文献[7]所描述的子宫分叉。
在既往病例中[7],尽管其中一个睾丸在阴囊前,但还是发现了两个睾丸。本病例只发现了一个隐睾,而且在右侧子宫分支的末端,虽然宏观上类似于一个生殖腺,但组织学上却不像是一个条状生殖腺,因为那里没有紧密的基质,而是一团脂肪组织。
考虑到本病例以前的病史不详,医生怀疑该猫只有左侧阴囊有睾丸,而且可能在幼年时就已绝育,并被送回收容所,直到后来被主人救出。在之前描述的一个病例[2]中,发现左侧睾丸位于阴囊内,而右侧睾丸位于腹部。饲养者未报告其行为或排尿问题。睾丸发育不良和肿瘤很可能与睾酮水平低有关。
本病例具有一些独特的特征,如慢性子宫内膜炎和隐睾中的睾丸间质细胞肿瘤,证实了该病例的罕见性。睾丸肿瘤在家猫中非常罕见,关于该物种的研究也寥寥无几[19]。
隐睾是狗患睾丸肿瘤的一个危险因素,但尚未在猫中发现这种关联[20]。猫的睾丸肿瘤与嵌合体核型DSD的关系从未被描述过。从临床角度来看,应该指出的是,完整、详尽的影像学诊断至关重要,否则肿瘤可能会发生转移。
本病例的研究结果对于了解与猫DSD相关的临床症状的多样性非常重要,因为与狗相比,对猫DSD的描述通常较少。 在怀疑患有DSD时,应考虑采用多学科诊断方法,包括完整的临床和影像学检查以及基因分析,以便对猫的这些病症进行正确分类。
文献来源:Montenegro L, Costa I, Maltez L, Evaristo V, Dias IR, Martins C, Borges I, Morinha F, Pereira R, Neto N, Oliveira C, Martins-Bessa A. Unusual sex chromosomal DSD in a domestic Shorthair cat with a 37,X/38,XY mosaic karyotype. BMC Vet Res. 2024 Jul 6;20(1):298.
参考文献
1.Szczerbal I, Switonski M. Genetic disorders of sex development in cats: an update. Anim Reprod Sci. 2020;216:106353.
2.Szczerbal I, Stachowiak M, Nowacka-Woszuk J, Dzimira S, Szczepanska K, Switonski M. Disorder of sex development in a cat with chromosome mosaicism 37,X/38,X,r(Y) Reprod Dom Anim. 2017;52:914–7.
3.Foster RA. Disorders of sexual development in the cat: current state of knowledge and diagnostic approach. J Fel Med Surg. 2022;24:257–65.
4.Romagnoli S, Schlafer DH. Disorders of sexual differentiation in puppies and kittens: a Diagnostic and Clinical Approach. Vet Clin North Am Small Anim Pract. 2006;36:573–606.
5.Christensen BW. Disorders of sexual development in Dogs and cats. Vet Clin North Am Small Anim Pract. 2012;42:515–26.
6.Flanders JA. Persistent Müllerian Duct Syndrome. In: Côté’s Clinical Veterinary Advisor: Dogs and Cats. Elsevier eBooks for Practicing Clinicians.
7.Balogh O, Berger A, Pieńkowska-Schelling A, Willmitzer F, Grest P, Janett F, Schelling C, Reichler IM. 37,X/38,XY mosaicism in a Cryptorchid Bengal Cat with Müllerian Duct remnants. Sex Dev. 2016;9:327–32.
8.Guimarães T, Oliveira C, Crespo J, Porto B, Cunha R, Rocha A. Congenital stricture of the vestibulo-vaginal Fold in a mare with normal karyotype. Equine vet Educ. 2021;33:e400–2.
9.McGowan-Jordan J, Hastings R, Moore S, Re T. Liehr. Cytogenet Genome Res. 2021;161:225–226.
10.Pomp D, Good BA, Geisert RD, Corbin CJ, Conley AJ. Sex identification in mammals with polymerase chain reaction and its use to examine sex effects on diameter of day-10 or-11 pig embryos. J Anim Sc. 1995;73:1408–15.
11.Joshi BD, De R, Goyal SP. Utility and applicability of a universal set of primers in identifying the sex of South and Southeast Asian mammals. Zool Stud. 2019;58:e19.
12.Mäkelä J-A, Koskenniemi JJ, Virtanen HE, Toppari J. Testis Development. Endocr Rev. 2019;40:857–905.
13.Rossi E, Radi O, De Lorenzi L, Iannuzzi A, Camerino G, Zuffardi O, Parma P. A revised Genome Assembly of the region 5′ to Canine SOX9 includes the RevSex Orthologous Region. Sex Dev. 2015;9:155–61.
14.Mitsuhashi T, Warita K, Sugawara T, Tabuchi Y, Takasaki I, Kondo T, Hayashi F, Wang ZY, Matsumoto Y, Miki T, Takeuchi Y, Ebina Y, Yamada H, Sakuragi N, Yokoyama T, Nanmori T, Kitagawa H, Kant JA, Hoshi N. Epigenetic abnormality of SRY gene in the adult XY female with pericentric inversion of the Y chromosome. Congenit Anom. 2010;50:85–94.
15.Turner ME, Ely D, Prokop J, Milsted A. Sry, more than testis determination? Am J Physiol Regul Integr Comp Physiol. 2011;301:R561–71.
16.Cinti F, Sainato D, Charlesworth T. A case of persistent mullerian duct syndrome in a dog. J Small Anim Pract. 2021;62:311.
17.Vegter A, Kooistra H, Van Sluijs F, Van Bruggen L, Ijzer J, Zijlstra C, Okkens A. Persistent Mullerian Duct Syndrome in a miniature Schnauzer Dog with signs of Feminization and a sertoli cell Tumour. Reprod Dom Anim. 2010;45:447–52.
18.Wright S, Lago-Alvarez Y, Champion C, Folk C, Rivard B, Back B, Aguiar LH, de Diel M. (2024). Sexual development disorder in a dog. Clin Theriogenology. 2024;16: 10439.
19.Lawrence JA, Saba CF. (2020). Tumors of the Male Reproductive System. In: Vail DM, Thamm DH, Liptak JM. Withrow and MacEwen’s Small Animal Clinical Oncology. Elsevier, 6th edition, pp. 626–644).
20. Valentine BA. Testicular Tumors. In: L. Cohn A. & E. Côté, editors. Côté’s Clinical Veterinary Advisor: Dogs and cats. Elsevier, 4th edition, 2019. pp. 962–963.