
| 一般情况 | |
|---|---|
| 品种:英国斗牛犬 | |
| 年龄:4岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:落叶型天疱疮 | |
01 主诉及病史
因严重的急性落叶型天疱疮复发就诊。
之前已通过细胞学和组织病理学检查确诊为落叶型天疱疮(下图),并通过多模式疗法获得了完全缓解,包括泼尼松(2 mg/kg,每天一次)、霉酚酸酯(10 mg/kg,每天两次)、奥拉替尼。缓解后就将泼尼松剂量减少20%。
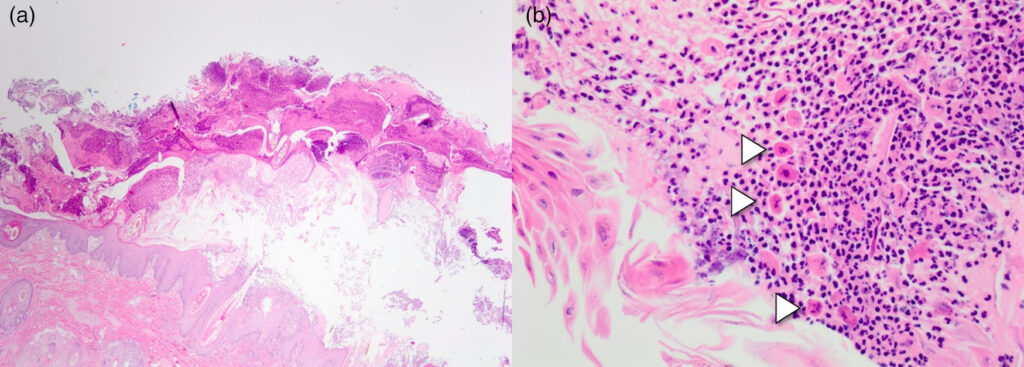
减量后两周内,再次出现面部大面积红斑脓疱和结痂,双侧背侧和躯干出现多灶性结痂、糜烂、溃疡性斑块,乳腺部位出现红斑脓疱。活动性皮损约占体表总面积的50%。再次进行活组织病理学检查以及细菌和真菌培养后,证实落叶型天疱疮复发,没有细菌和真菌感染迹象。
02 检查
体重18千克。仍按照之前的处方服用霉酚酸酯和泼尼松。入院后1小时内,观察到面部和乳腺分别出现了新的红斑和完整的脓疱。
03 治疗
考虑到病情严重且迅速恶化,医生决定进行治疗性血浆置换(TPE)治疗,以迅速消除循环中的自身抗体(下图)。
↑ 患者的血液经右侧双腔透析导管排出,并通过血液透析机与专有的PRISMA TPE进行过滤。置换液和过滤后的血浆通过同一双腔透析导管返回患者体内。每次TPE治疗期间,患者都能舒适地休息,无需使用镇静剂。
由于奥拉替尼无法产生糖皮质激素节约效应,因此停用了奥拉替尼,并开始使用环孢素(7 mg/kg,每天一次)作为额外的免疫抑制疗法,同时启动了TPE方案。免疫抑制药物在每次TPE治疗后和治疗前4-6小时服用,以尽量减少药物清除。
采用改良的Seldinger技术,经皮将一根11.5 Fr×20 cm 的临时双腔透析导管在6天内(第0、1、2和5天)连续进行了4次TPE。在每次TPE过程中,规定在2.5-3小时内交换1.5容积的血浆,以达到循环抗体减少约80% 的目的。
以毫升为单位的血浆容量计算公式如下:(1-血细胞比容)×(体重[kg]×80 mL/kg)。TPE是通过使用PRISMA TPE的连续肾脏替代疗法平台启动的。体外循环最初使用0.9%氯化钠。液体置换包括约400 mL VetStarch、300 mL 0.9%氯化钠和720 mL犬新鲜冰冻血浆。
在第3和第4次TPE治疗前15分钟,肌肉注射盐酸苯海拉明。在血浆置换期间,以0.5-1 mL/kg/h的速度静脉注射5%氯化钙,以维持离子钙大于3.6 mg/dL [4.6-5.4]。抗凝最初使用75 u/kg的肝素,以100-120 u/h的肝素持续输注,以达到180-200秒[60-120]的活化凝血时间。
在整个治疗过程中,对收缩压、舒张压和平均动脉血压、心率、呼吸频率和呼吸强度进行监测。脉搏氧饱和度和心电图也按指示进行监测。所有数值均保持在正常范围内。未发现与TPE有关的并发症。
04 预后
经过4个疗程的治疗,临床状况明显改善,病情得到部分缓解。精神状态从安静转为警觉,皮损红斑的程度明显减轻(下图ab),结痂开始脱落,溃疡下层出现了健康的肉芽组织(下图cd)。
↑ 面部治疗前(a)和治疗后(b),背部治疗前(c)和治疗后(d)。(a)中的红斑在(b)中消退。(c)中覆盖在溃疡床上的结痂在(d)中显示出逐渐愈合的迹象,从结痂的脱落和单个病灶内健康肉芽组织的形成可以看出。
第4次治疗后,病变皮肤约占体表总面积的25%,没有脓疱形成的迹象,之前的红斑消退,在最后一次治疗后的24小时内没有发现新的病变。
完成第4次TPE治疗后出院。在没有继续接受TPE治疗的情况下,临床状况很快就恶化了,一周复查时出现了新的脓疱和结痂糜烂。
为了避免安乐死,主人采取了积极的治疗措施。在撰写本报告时,患者的病情已得到部分缓解,正在接受来氟米特(1.6 mg/kg,每天一次)、地塞米松(0.3 mg/kg,每天两次)以及局部皮质类固醇治疗,每天一次。
05 讨论
落叶型天疱疮(Pemphigus foliaceus,PF)是一种自身免疫性皮肤病,人、狗、猫、马和山羊均可患病[1]。自身抗体可诱导犬PF的棘层溶解,导致典型的局灶性或泛发性脓疱和结痂性皮炎[2,3]。DSC-1是犬PF的主要自身抗原,与人类PF的自身抗原不同[3]。
犬PF的成功治疗包括免疫调节治疗和继发感染控制。常用药物包括糖皮质激素、环孢素、霉酚酸酯和硫唑嘌呤[2,4]。最近在治疗小动物的PF时出现了一些替代疗法,如奥克替尼和多硫化糖胺聚糖[5-7]。通常情况下,犬PF需要多模式治疗才能获得缓解,并将长期用药相关的不良反应降至最低。
治疗性血浆置换(Therapeutic plasma exchange,TPE)是一种血液净化方法,利用对流从血液中分离出高分子量的非细胞成分[8]。TPE已在人类医学中被证明可有效治疗严重的难治性PF[9]。虽然TPE已在兽医学中用于治疗各种免疫性疾病和毒性反应[8],但有关其用于治疗犬PF的情况尚未见报道。本病例报告描述了一只患有严重难治性PF犬的临床表现和对TPE的反应。
在人类医学中,对于标准疗法无效的病例,会考虑应用TPE治疗PF。该疗法能显著减少循环中的自身抗体,从而改善临床症状,减轻疾病的严重程度[9-12]。在兽医领域,关于使用TPE治疗PF的文献很少。
最近,一篇关于体外疗法的综述简要提到了在狗和一头患有严重PF的驴身上使用TPE的情况[8]。在这两种动物中,使用TPE都能显著改善临床症状和疾病严重程度,与本文描述的患者一致。
本患者在停用TPE后临床状态下降,这强调了同时使用免疫抑制药物对长期治疗PF的重要性。停用TPE后,自身抗体水平往往会在1-2周内反弹[9]。因此,TPE的主要目的是降低循环中的自身抗体水平,实现疾病的快速控制,并在全身免疫抑制治疗生效前提供免疫调节[10]。
在人类患者中,停用TPE的决定基于对临床改善和/或抗desmoglein蛋白滴度的监测,在人类PF患者中,停用TPE通常需要数周至数月的时间[9,11,12]。在本病例中,由于临床反应有所改善,且经济拮据限制了更多的TPE疗程,TPE在一周后停止。延长TPE的使用时间,同时进行人免疫球蛋白治疗等辅助干预,可能会为该患者带来更好的治疗效果。
本报告有一个局限性,那就是缺乏与临床改善相对应的TPE治疗前后的总免疫球蛋白IgG和抗DSC-1 IgG测量值。未来的研究可能会将治疗频率、循环IgG水平和病变严重程度联系起来,以帮助制定治疗方案建议。
总之,本病例表明,TPE是治疗犬PF的有效辅助疗法。 较长的TPE治疗时间可能有利于获得更有利的临床结果,尤其是当同时进行的免疫抑制治疗需要数周才能见效时。虽然TPE对该犬安全且耐受性良好,但仍需进行对照临床试验,以确定TPE的益处以及对患有PF和其他免疫介导型皮肤病的犬的具体适应症。
文献来源:Edmonds KB, Her J, Langston C, Jennings R, Diaz S. Efficacy of therapeutic plasma exchange in a case of severe, generalised canine pemphigus foliaceus. Vet Dermatol. 2024 Apr;35(2):247-251.
参考文献
1. Olivry T. A review of autoimmune skin diseases in domestic animals: I – superficial pemphigus. Vet Dermatol. 2006; 17: 291–305.
2. Mueller RS, Krebs I, Power HT, Fieseler KV. Pemphigus foliaceus in 91 dogs. J Am Anim Hosp Assoc. 2006; 42: 189–196.
3. Bizikova P, Dean GA, Hashimoto T, Olivry T. Cloning and establishment of canine desmocollin-1 as a major autoantigen in canine pemphigus foliaceus. Vet Immunol Immunopathol. 2012; 149: 197–207.
4. Gomez SM, Morris DO, Rosenbaum MR, Goldschmidt MH. Outcome and complications associated with treatment of pemphigus foliaceus in dogs: 43 cases (1994–2000). J Am Vet Med Assoc. 2004; 224: 1312–1316.
5. Carrasco I, Martínez M, Albinyana G. Beneficial effect of oclacitinib in a case of feline pemphigus foliaceus. Vet Dermatol. 2021; 32: 299–301.
6. Martinez N, McDonald B, Crowley A. A case report of the beneficial effect of oclacitinib in a dog with pemphigus vulgaris. Vet Dermatol. 2022; 33:237-e65.
7. Simpson DL, Burton GG. Use of prednisolone as monotherapy in the treatment of feline pemphigus foliaceus: a retrospective study of 37 cats. Vet Dermatol. 2013; 24(6): 598–601, e143-4.
8. Londoño L. Extracorporeal therapies in the emergency room and intensive care unit. Adv Small Anim Care. 2023; 4: 61–70.
9. Connelly-Smith L, Alquist CR, Aqui NA, Hofmann JC, Klingel R, Onwuemene OA, et al. Guidelines on the use of therapeutic apheresis in clinical practice – evidence-based approach from the writing committee of the American Society for Apheresis: the ninth special issue. J Clin Apher. 2023; 38: 77–278.
10. Melchionda V, Harman KE. Pemphigus vulgaris and pemphigus foliaceus: an overview of the clinical presentation, investigations and management. Clin Exp Dermatol. 2019; 44: 740–746.
11. Khaddour HH, Zaher D, Kassem T, Hasan A. Aggressive refractory pemphigus vulgaris that responded to plasmapheresis: a case report. J Med Case Rep. 2020; 14: 109.
12. Kunadia A, Sami N. Combination therapy of plasma exchange and rituximab to treat cicatricial pemphigoid and bullous pemphigoid. Cureus. 2021; 13:e19932.