| 一般情况 | |
|---|---|
| 品种:短毛猫 | |
| 年龄:3岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:化学性肺炎 | |
01 主诉及病史
因骨折畸形愈合导致骨盆错位而反复便秘,在初级医院住院治疗。使用多库酯钠和纤维饮食进行了长期治疗。
在住院的最初48小时里接受了皮下注射液、乳果糖和温水灌肠等治疗,但都没有成功。住院第3天,开始以3 mL/kg/h的速度静脉输液,并置入了鼻饲管。通过鼻饲管以3 mL/kg/h的速度恒速输注未稀释的聚乙二醇电解质溶液(PEG-ELS)持续4小时,然后增加到8 mL/kg/h。
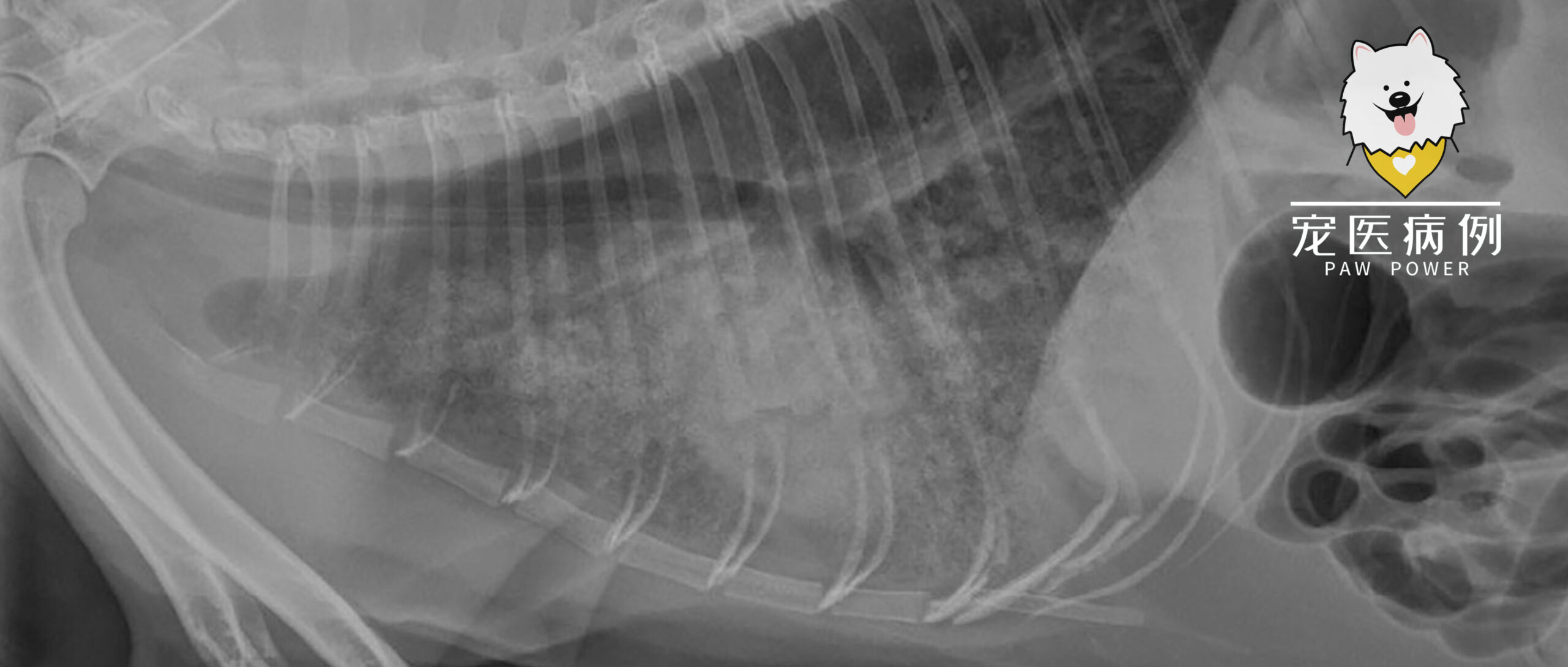
8小时后(总共输入了PEG-ELS 176 mL)呼吸频率为80次/分,血氧饱和度97%。立即停止静脉输液和PEG-ELS恒速输注,给予吸氧。注射了抗生素(氨苄西林-舒巴坦30 mg/kg、恩诺沙星5 mg/kg)。X光片显示弥漫性严重肺泡型肺病,腹侧肺野的情况更糟(下图)。鼻饲管的末端位于气管近心尖处。
血液检查显示PCV(40%)正常,白细胞和中性粒细胞严重减少(白细胞1.04×10^9/L [2.87-17.02];中性粒细胞0.28×10^9/L [2.3-10.29])以及轻度血小板减少(118×10^9/L [151-600])。拔掉鼻饲管后,猫被转诊到本院。
02 检查及治疗
体重4.9千克。表现出中度呼吸急促和呼吸困难,伴有刺耳的肺音和双侧湿啰音。注射了单剂量的呋塞米(1 mg/kg IV)以促进水肿消退,注射了马洛比坦(1 mg/kg IV)和丁丙诺啡(0.1 mg/kg IV)以轻度镇静,安置在氧气笼中(FiO2 60%)。
继续使用氨苄西林-舒巴坦,并以30 mL/kg/天输入等渗晶体液和2 mg/kg/天的甲氧氯普胺。开通了第二根外周静脉导管,并注射了甲强龙栓剂(1 mg/kg IV),随后又进行了甲强龙恒速输注(1 mg/kg/天)。
静脉血气显示PvCO2正常(45 mmHg),乳酸为39.6 mg/dL。全血细胞计数显示白细胞、中性粒细胞、血小板减少已缓解(白细胞4.6×10^9/L [3.9-19]、中性粒细胞3.36×10^9/L [2.62-15.17]、200×10^9/L [155-641])。血生化发现轻度高胆红素血症(34.2 μmol/L [0.0-5.13])和肌酸激酶活性升高(1312 U/L [64-440])。
住院第2-4天,一直使用甲强龙恒速输注和吸氧。
住院第4天,呼吸频率改善到40-60/min(FiO2 40%),胸腔听诊显示肺音有所改善。注射了丁丙诺啡(0.4 mg/kg)、阿法沙隆(1 mg/kg)和右美托咪定(1 μg/kg IV)。
置入了鼻饲管和三腔颈静脉中心导管。血检显示中度贫血(PCV 20%)。复查血常规显示为非再生性贫血,HCT为0.19 L/L (19.1%) [0.28-0.527 (28.2-52.7%)],高胆红素血症(8.55 μmol/L)和肌酸激酶(577 U/L)有所改善。
胸片显示肺泡形态轻度改善,呈腹侧分布,鼻饲管放置适当,管尖和几厘米的管子卷曲在胃里(下图)。腹部X光片显示左骨盆骨折愈合不良,骨盆狭窄,持续严重便秘。
通过鼻饲管重新启动PEG-ELS恒速输注,速度为39 mL/h(8 mL/kg/h),并开始肠外营养(35 mL/kg/天;50%静息能量需求)。停止使用等渗晶体液。
住院第5天,注射了镇静剂,用一根新的三腔导管更换了一根不起作用的中心管。在镇静期间,猫反胃了几次。评估发现胃残余容积极小,因此暂停了肠内喂食。PCV进一步降至18%。在4小时内输注了5 mL/kg的猫A型包装红细胞。输血后PCV上升到30%。傍晚观察到几次小肠蠕动,随后出现腹泻,于是停止使用PEG-ELS恒速输注。
住院第6-7天,呼吸状况继续好转,吸氧逐渐减少。腹泻仍在持续,开始主动进食,肠外喂养减少到静息能量需求的25%(20 mL/kg/天),随后停止。
住院第8天,胸部和腹部X光片显示,肺泡肺形态有所改善,但仍呈腹侧分布,粪便持续干燥,结肠胀气有所改善。呼吸频率改善到了20-30次/分,逐渐停止吸氧。开始口服乳果糖(2 mL q8h)。
住院第9天,HCT为24%,出现了轻度氮质血症(肌酐141.5 μmol/L [79.6-203.4])。
住院第10天,肌酐有所改善(106.1 μmol/L),出院时服用了阿莫西林-克拉维酸钾(12.5 mg/kg PO q12h,共10天)、泼尼松龙10天渐进疗程、乳果糖(2 mL PO q12h)和Miralax(1/4茶匙,掺入食物中,q12h)。
03 预后
出院7天后复查,全血细胞计数和生化检查均未发现异常,胸片上的肺部病变也已消失。主人称排便情况有所改善,在家中的呼吸和活动水平也正常。
04 讨论
聚乙二醇电解质溶液(PEG-ELS)是PEG-3350和电解质(即硫酸钠、氯化钠、碳酸氢钠和氯化钾)的组合物,用于清洁结肠,以达到诊断和治疗目的。PEG-3350是现有的较大的PEG分子之一,不可吸收,通过在增加胃肠道中的液体起到渗透性泻药的作用[1,2]。
PEG-ELS可用于成人结肠镜检查或结肠手术前的肠道准备,也可用于治疗儿童的严重便秘[2-6]。PEG-ELS对人体最常见的不良反应包括恶心、腹痛、痉挛或腹胀以及药物吸收不良[4]。有报告称出现过其他不良反应,如呼吸困难、血管性水肿和严重的心脏异常,包括心律失常、心肌缺血和心脏骤停[3,7,8]。
在过去几年中,有多例报告称,由于鼻饲管置入不当或患者气道受损,导致PEG-ELS被灌入或吸入患者肺部,从而引发化学性肺炎和急性呼吸窘迫综合征[2,4-7,9,10]。
在狗和猫身上,PEG-ELS经口腔给药或通过肠饲管给药后,对解决便秘或梗阻具有疗效[11,12]。在这些物种中,副作用主要有恶心、呕吐和腹胀[13]。有记录显示,一只狗吸入PEG-ELS后死亡[13]。还有一只狗吸入PEG-ELS后立即出现呼吸困难,在采取包括支气管镜灌洗在内的积极措施后痊愈[14]。
吸入或灌入PEG-ELS造成肺损伤的病理生理学非常复杂,尚未完全阐明。化学性肺炎是由于肺部直接受到渗透性损伤、肺泡毛细血管膜随后发生剥脱、毛细血管通透性增加以及液体外渗到肺间质和肺泡所致[2,6,7,15]。中性粒细胞和其他促炎介质随之被招募[2]。
在实验性大鼠模型中,向肺部灌注PEG会导致生化和组织病理学方面的促氧化和促炎症标记物增加。在这些啮齿类动物中,同时使用肿瘤坏死因子-α阻断剂英夫利昔单抗治疗可减轻肺部炎症[15]。
PEG-ELS的高渗透性有助于液体从肺血管渗出到肺泡中。每个PEG-3350分子都能截留比该化合物分子量预期更多的水分子,从而导致肺内的液体量远高于灌注或吸入的液体量。II型肺泡细胞产生表面活性物质的能力受损,表面活性物质的功能受到干扰,肺泡充水导致表面张力改变,这些都会导致肺泡和支气管塌陷[2,15]。最终导致液体扩散到肺泡内、肺水肿和急性呼吸窘迫综合征[15]。
鼻饲管常用于给人和小动物注射PEG-ELS,因为成功治疗所需的容量很大,而且味道难闻。使用鼻饲管施用PEG-ELS并不排除吸入的风险,因为人类吸入PEG-ELS的病例都发生在插有鼻饲管的患者身上[7]。
放置鼻饲管导致下食道括约肌完整性受到破坏,可能会增加吸入风险[2]。其他患者性因素,如先兆呕吐或恶心、胃肠道运动功能减退,或因大量镇静或精神状态改变而导致意识水平改变,都可能增加吸入风险。
对于有误吸风险因素的患者,强烈建议严格遵守预防措施,包括在PEG-ELS输注期间每小时测量一次胃残余物,并考虑使用止吐药和促动力药进行预处理[2]。在通过鼻饲管输注PEG-ELS期间,评估气道能力、保持直立体位、根据年龄(或体型)调整溶液流速以及监测肺部窘迫也是额外的注意事项。
强烈建议在输注任何物质之前,通过X射线检查确认鼻饲管放置适当。一篇人类文献综述报告称,在12名通过鼻饲管输注PEG-ELS后出现肺部不良事件的患者中,没有一名患者在输注PEG-ELS前拍片记录了鼻饲管放置的位置[10]。
吸气后造影发现其中几名患者的鼻饲管位于肺叶、支气管和口咽部。通过鼻饲管注入空气后听诊肠鸣音以及抽吸管内液体进行石蕊试验,是这些患者的置管确认方法。最近的一项人类综述证实,X线照片是区分鼻饲管在胃部还是肺部的最准确方法[10]。
对于人类或小动物患者因吸入PEG-ELS而继发的化学性肺炎和呼吸窘迫综合征,目前还没有标准化的治疗方法。本研究中的这只猫接受了综合氧疗、利尿剂、皮质类固醇和抗生素的保守治疗,在住院10天后出院。
文献来源:Mastrocco A, Prittie J, Zollo AM. Chemical pneumonitis secondary to accidental pulmonary polyethylene glycol-electrolyte solution infusion in a cat. J Vet Emerg Crit Care (San Antonio). 2024 May-Jun;34(3):296-301.
参考文献
1. Schiller LR, Emmett M, Santa Ana CA, Fordtran JS. Osmotic effects of polyethylene glycol. Gastroent. 1988; 94(4): 933-941.
2. Lutz PJ, Mason R. Aspiration complications following nasogastric administration of polyethylene glycol (PEG) Solution. A case to remember. Pract Gastroent. 2002, 26-33.
3. Skaff C, Alayed T. Lethal complication from inappropriately prepared polyethylene glycol (Golytely) in a pediatric patient. Cureus. 2021; 13(3):e13713.
4. Marschall HU, Bartels F. Life-threatening complications of nasogastric administration of polyethylene glycol-electrolyte solutions (Golytely) for bowel cleansing. Gastrointest Endosc. 1998; 47(5): 408-410.
5. Narsinghani U, Chadha M, Farrar HC, Anand KS. Life-threatening respiratory failure following accidental infusion of polyethylene glycol electrolyte solution into the lung. J Toxicol Clin Toxicol. 2001; 39(1): 105-107.
6. Liangthanasarn P, Nemet D, Sufi R, Nussbaum E. Therapy for pulmonary aspiration of a polyethylene glycol solution. J Pediatr Gastroenterol Nutr. 2003; 37(2): 192-194.
7. de Graaf P, Slagt C, de Graaf JL, Loffeld RJ. Fatal aspiration of polyethylene glycol solution. Neth J Med. 2006; 64(6): 196-198.
8. Mo Y, Gandhi S, Orsini J. Possible GoLytely-associated cardiac arrest: a case report and literature review. J Pharm Pract. 2020; 33(3): 364-367.
9. Mosquera RA, McDonald M, Samuels C. Aspiration pneumonitis caused by polyethylene glycol-electrolyte solution treated with conservative management. Case Rep Pediatr. 2014; 2014:872634.
10. Metheny NA, Meert KL. Administering polyethylene glycol electrolyte solution via a nasogastric tube: pulmonary complications. Am J Crit Care. 2017; 26(2): e11-e17.
11. Carr AP, Gaunt MC. Constipation resolution with administration of polyethylene glycol solution in cats (Abstract). J Vet Intern Med. 2010; 24: 753-754.
12. Tam FM, Carr AP, Myers SL. Safety and palatability of polyethylene glycol 3350 as an oral laxative in cats. J Feline Med Surg. 2011; 13(10): 694-697.
13. Leib MS, Baechtel MS, Monroe WE. Complications associated with 355 flexible colonoscopic procedures in dogs. J Vet Intern Med. 2004; 18(5): 642-646.
14. Aguayo Santaella DM, Olin SJ, Willard MD, Whittemore JC. Management of polyethylene glycol solution aspiration using bronchoscopic lavage in a dog. J Vet Intern Med. 2020; 34(3): 1304-1307.
15. Güzel A, Günaydin M, Güzel A, et al. Infliximab attenuates activated charcoal and polyethylene glycol aspiration-induced lung injury in rats. Exp Lung Res. 2012; 38(3): 147-156.