
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:6岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:猫进行性组织细胞增生症 | |
01 主诉及病史
因鼻翼上的结节性病变持续了9个月就诊。
02 检查
体重3.6千克。各项生命指标正常。鼻部、下唇、脚指、尾巴(2个1.5 cm)可见结节状、脱毛、非溃疡性病变(下图)。
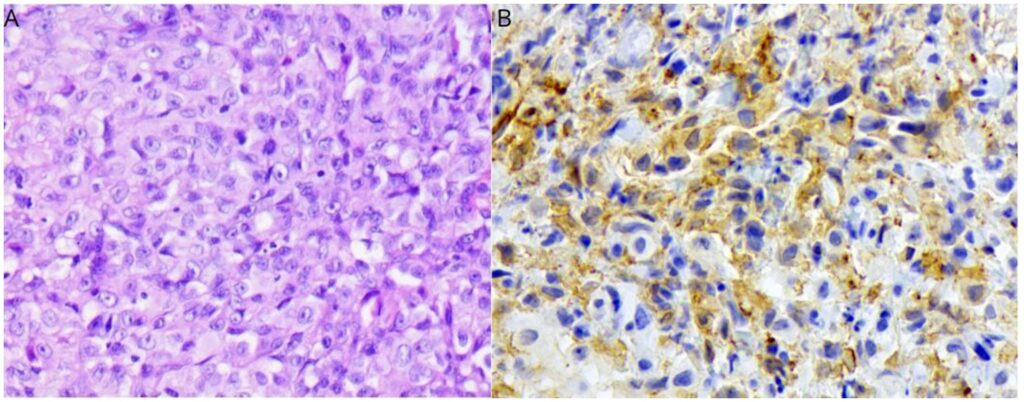
在另一家机构进行的活检诊断为组织细胞增生症,显示真皮浅层和深层明显存在组织细胞浸润。细胞有宽大、略带嗜酸性的胞浆,核中央大而圆,偶尔会出现轻微凹陷、边缘染色质和明显的核小体。2.37平方毫米内有12个有丝分裂象,中度多形性,偶有核仁肿大,并有不明显的淋巴浆细胞浸润。对之前采集的样本进行了免疫组化检查,包括Iba-1、CD3、Granzyme B、CD20、CD117、MUM1、Pax-5和PanCK标记物。只有Iba-1呈阳性,被诊断为猫进行性组织细胞增生症(下图)。
其他检查包括腹部超声、胸部X光、全血细胞计数和血生化(尿素、肌酐、谷丙转氨酶、谷草转氨酶、谷草转氨酶、碱性磷酸酶、蛋白质和组分、钙和磷),但均无异常。
03 治疗
开始进行化疗,使用洛莫司汀(35 mg/m2 PO)和多柔比星(1 mg/kg IV),两次用药间隔14天。还使用了泼尼松龙(0.7 mg/kg PO BID)和欧米茄-3(500 mg PO SID)。
两种化疗药物给药14天后无客观反应,病灶越来越大,数量越来越多,一些结节还出现了溃疡(下图)。还观察到III级中性粒细胞减少(630/μL [3000-11000])和I级血小板减少(126,000/μL [175,000-500,000]),因此单次皮下注射了非格司亭(5 mcg/kg)。
暂停使用泼尼松龙、洛莫司汀和多柔比星,开始使用磷酸托西尼布(帕拉丁,10 mg,每周一、三、五口服),同时继续补充欧米茄-3。使用帕拉丁21天后,发现病灶大小相似,但水肿、红斑和渗出减少(下图)。全血细胞计数和血生化等结果均正常。继续治疗,并在开始服用帕拉丁33天后再次尝试口服单剂量洛莫司汀(30 mg/m2)。
经过约6周的稳定期后,鼻部病变出现了明显进展,同时皮肤病变也出现了溃疡(下图),左侧腘窝淋巴结也增大了。
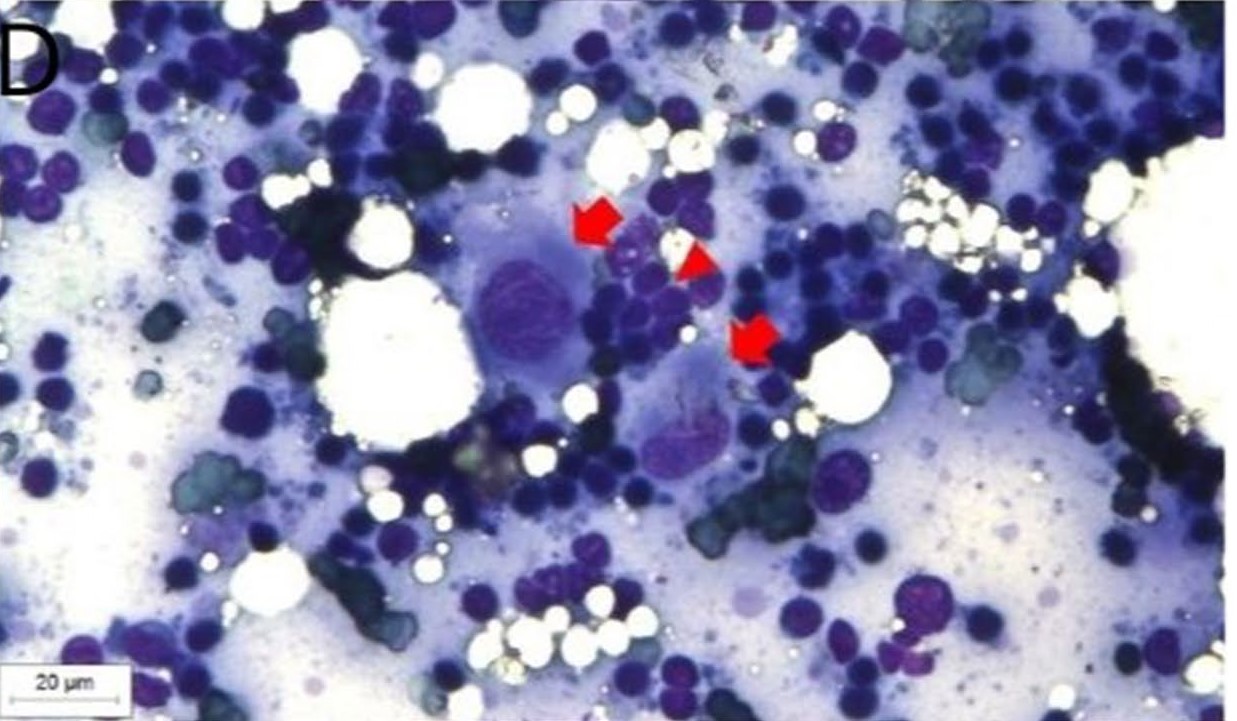
淋巴结细针穿刺细胞学检查证实肿瘤转移(下图)。主人报告说病变部位出现瘙痒和疼痛,同时还伴有嗜睡和厌食。于是开具了辅助治疗药物,包括加巴喷丁(6 mg/kg BID,持续使用)、米氮平(2 mg q48h,用14天)和美洛昔康(0.02 mg/kg SID,用14天)。
由于治疗效果不佳,开始接受方波脉冲电化学治疗,每次100微秒,振幅1,000-1,300 V/cm,频率为5 kHz,电脉冲前8分钟静脉注射博莱霉素(15 IU/m2)。在所有病灶上进行,每个病灶周围留出1-2 cm的边缘。电化学治疗过程中使用的麻醉方案包括美沙酮(0. 3 mg/kg IM)结合右美托咪定(5 mg/kg IM)和氯胺酮(1 mg/kg IM)作为麻醉前用药;丙泊酚(2 mg/kg IV)、氯胺酮(1 mg/kg IV)和芬太尼(2. 5 μg/kg IV)进行麻醉诱导。七氟醚和芬太尼(5 μg/kg IV)作为维持麻醉的吸入麻醉剂。
共进行了6次电化学治疗,间隔时间分别为22、22、32、50和134天。每次治疗前的血液检查均正常。第1次治疗后结节逐渐缩小。第3次治疗18天后,结节缩小了80%(下图)。随访期间进行了胸片和腹部超声检查,没有发现转移迹象。
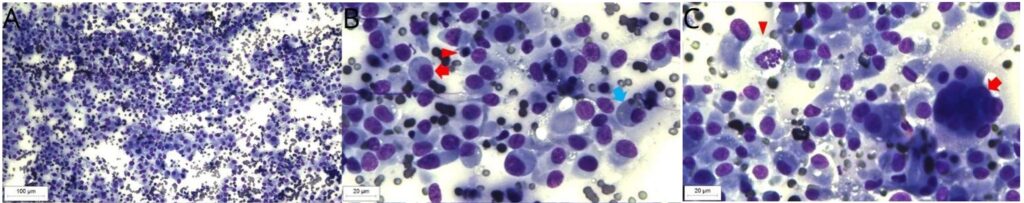
第4次电化学治疗21天后,发现了新的病变,包括上下眼睑、肩胛骨间背侧区域,鼻部、左后肢爪垫、右后肢跗骨区域和尾部的两个结节复发。颈部中央区域还有一个3 cm结节,坚硬、粘连且很深。颈部超声怀疑左侧甲状腺或左侧咽后内侧淋巴结肿大,细针穿刺细胞学检查显示大量组织细胞,呈卵圆形至纺锤形,核与细胞质的比例从低到高不等,核呈卵圆形,异形细胞增多,染色质形态粗糙,核仁单个且不明显、细胞质嗜碱性离散且分界不清,轻度至中度存在双核细胞和大细胞,每视野有5个以上有丝分裂图形(下图)。
CT显示咽后内侧淋巴结肿大(3.5×1.8×1.8 cm)、咽后右内侧淋巴结肿大(2.1×0.8×0.3 cm)、左侧颈浅淋巴结肿大(略有增大)以及左下颌淋巴结肿大(中度增大)。甲状腺未见异常。鉴于这些发现,治疗得到了加强,每周一、三、五加用苯丁酸氮芥(2 mg)。
帕拉丁和苯丁酸氮芥联合治疗21天后,咽后淋巴结已无法触及,皮肤病变也变小了。
为了控制剩余的皮损,继续进行了电化学治疗。不过为了减少费用和改善患者福利,治疗间隔时间延长了。在总共完成6个疗程后,观察到皮肤病变完全缓解(下图),腹部超声和胸部放射线检查均未发现异常。在第1、2、4和6个疗程中,患者出现了长达2天的倦怠和厌食。此外在头两次治疗后鼻腔结痂,表现出呼吸道不适,去除结痂后好转。在联合治疗期间,监测到了无症状的I级中性粒细胞减少。
04 预后
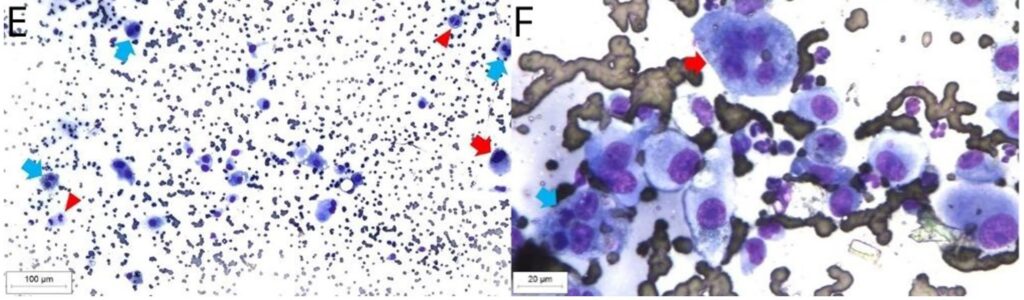
最后一次电化学治疗3个月后,出现了厌食、嗜睡和体重减轻。观察到右侧颈浅淋巴结增大,针刺细胞学检查结果显示,与之前结果相比,细胞不典型性有所增加。除了先前观察到的特征外,还发现了圆形核、突出的单个核小体,偶尔还有多个核小体。观察到多空泡核、噬细胞和多核现象,以及不典型的有丝分裂象,提示诊断为组织细胞肉瘤(下图)。
确诊后460天,该猫在家中去世,很可能是由于疾病恶化所致。主人拒绝尸检。
05 讨论
组织细胞来源于CD34+干细胞前体,它们分化成巨噬细胞和树突状细胞。树突状细胞包括位于局部血管周围区域和各种器官的间质树突状细胞(IC),以及出现在皮肤、胃肠道、呼吸道和生殖道上皮细胞内的朗格汉斯细胞(LC)[1]。
树突状细胞是诱导幼稚T细胞产生免疫反应的最有效的抗原呈递细胞。树突状细胞与T细胞之间错误的相互作用会导致免疫失调,并导致组织细胞疾病的发生[2]。犬猫的大多数组织细胞疾病都涉及IC的增殖,但也可能与其他细胞有关[3]。
组织细胞疾病在人、犬和猫中均有记录,但其病因和发病机制仍然不明,通常是致命的[4-6]。在人类医学中,组织细胞疾病有许多亚型。组织细胞学会根据放射学、组织病理学、表型和分子特征将组织细胞病分为以下几类:LC相关组织细胞病(L组)、皮肤和粘膜组织细胞病(C组)、恶性组织细胞病(M组)、罗赛-多夫曼病(R组)、嗜血细胞淋巴组织细胞病和巨噬细胞活化综合征(H组)[7]。
在犬中,组织细胞疾病包括反应性组织细胞增生症、组织细胞瘤、皮肤LC组织细胞增生症以及更严重的组织细胞增生症(组织细胞肉瘤和嗜血细胞组织细胞肉瘤等),这些疾病都可能表现为局部和/或全身性疾病[2]。
猫组织细胞疾病并不常见,很少有报道。包括组织细胞肉瘤(源于IC)、嗜血细胞组织细胞肉瘤(源于巨噬细胞)、猫进行性组织细胞增生症(FPH)(源于IC)、肺LC组织细胞增生症,以及零星报道的猫组织细胞瘤(源于LC)[6]。
FPH是猫最常见的组织细胞疾病,通常表现为皮肤病变。尽管如此,它仍然是一种罕见的疾病,患者多为雌猫,通常为中老年,没有品种偏好[8]。FPH的病因尚不十分清楚,但慢性抗原刺激被认为是其发病的诱发因素。
从临床表现上看,FPH类似于皮肤内常驻树突状细胞引起的低级别组织细胞肉瘤[3]。最初会出现单发或多发的非瘙痒性无痛皮肤结节,主要位于头部、下肢和躯干。表面常脱毛,并可能出现溃疡[9]。皮损可能会增大,凝聚成斑块,或自发缩小,但不会完全消退[3]。
虽然最初局限于皮肤,但在一个月到三年内,它们可能会发展为恶性组织细胞肿瘤,并转移到淋巴结、肝脏、脾脏、肾脏、肺部和骨髓,最终导致死亡或不得不安乐死。确诊的依据是组织病理学和免疫组化评估以及临床表现[3,9]。
组织病理学上,病变由真皮和皮下组织中弥漫和密集的组织细胞浸润组成,分界不清[3,10]。在早期阶段,组织细胞分化良好,有丝分裂率低,但随着病情的发展,可能会出现细胞多形性、有丝分裂率增高和多核现象,与组织细胞肉瘤相似[9]。
常规组织病理学无法区分组织细胞亚型,需要进行免疫组化。在组织细胞疾病中,嗜血细胞组织细胞肉瘤的免疫表型为IBA-1+、CD204+、MHC-II-、E-cadherin-;组织细胞肉瘤、反应性组织细胞增生症和FPH的免疫表型为IBA-1+、CD204±、MHC-II+、E-cadherin-;组织细胞瘤和皮肤LC组织细胞增生症为IBA-1+、CD204±、MHC-II+、E-cadherin+。在FPH中观察到了一些变化,如CD5+和E-cadherin+分别占50%和10%[2,9,11]。
组织细胞肿瘤不仅在诊断方面面临挑战,在治疗方面也是如此。皮质类固醇、抗生素、干扰素、L-天冬酰胺酶、氮芥、长春新碱等疗法均有应用,但效果并不理想[3,12]。局部或远处复发很常见,手术切除效果不佳[2]。但初次就诊时没有转移迹象的患者可以从广泛的手术切除中获益,延长无病间隔期[10]。
人类医学根据组织细胞疾病的类型、程度、表型和分子特征进行标准化治疗,而猫组织细胞增生症却没有有效的治疗方法或护理标准。如对于成人常见的组织细胞增生症,如LC组织细胞增生症、埃尔德海姆-切斯特病和罗赛-多夫曼病,当它们出现MAPK/ERK通路突变时,治疗方法包括考比替尼/曲美替你等。还可根据具体疾病使用一系列药物,如泼尼松龙、长春新碱、羟基脲、沙利度胺、阿糖胞苷、甲氨蝶呤和干扰素alfa-2a[7]。
电化学疗法(Electrochemotherapy,ECT)是一种局部治疗方法,它将细胞毒药物的作用与通过电脉冲对细胞膜进行电穿孔结合起来,从而使亲水药物分子得到更好的渗透。ECT已被用作各种类型浅表皮肤单发肿瘤的单一或辅助疗法,显示出较高的反应率和最小的副作用。尤其对皮肤小肿块反应率高的肿瘤有:犬口腔黑色素瘤(约90%)、猫皮肤鳞状细胞癌(约80%)、马肉瘤(约97%),小于2 cm3的肿瘤反应率约为100%[13,14]。
ECT疗法在兽医学中的疗效已得到公认,目前被推荐作为各种实体瘤的新辅助和辅助治疗方法[13]。除了直接的细胞毒性作用外,ECT还能通过释放肿瘤抗原和免疫原性细胞死亡(ICD)激活免疫系统,从而引发间接的抗肿瘤作用。ICD是指任何形式的细胞死亡,它能有效激发针对死亡细胞释放的抗原的适应性免疫反应,并释放出促进树突状细胞和巨噬细胞吞噬的物质[21]。
静脉注射博莱霉素会降低博莱霉素在肿瘤细胞内的浓度,相比之下,瘤内注射博莱霉素会在每个细胞周期对DNA造成渐进性损伤,直到发生灾难性的有丝分裂,导致细胞死亡,类似于ICD的坏死。如果浓度较高或进行瘤内注射,则可能出现假性凋亡,其免疫原性较低[22,23]。
对免疫功能正常和免疫功能低下小鼠癌症模型的研究表明,ECT的疗效存在差异,这强调了免疫系统的重要性。在免疫功能正常的小鼠中,ECT诱导的免疫激活对于有效对抗肿瘤至关重要,而免疫缺陷小鼠对治疗的反应则大大降低或消失[24]。
总之,FPH对各种治疗方法都有抗药性,但实施旨在恢复抗肿瘤免疫力的多模式疗法可能会提高治疗效果。ECT是控制FPH皮肤病变的有效手段,可显著提高患者的生活质量。反复使用ECT治疗FPH皮肤病变可带来显著的临床疗效。
文献来源:de Sena BV, Turquete PBDSR, Pimentel PAB, Almeida IO, Lavalle GE, Nakagaki KYR, Giuliano A, Paes PRO, Horta RDS. Case report: Complete clinical remission of feline progressive histiocytosis after multimodal treatment including electrochemotherapy. Front Vet Sci. 2024 Aug 22;11:1397592.
参考文献
1.Merad M, Ginhoux F, Collin M. Origin, homeostasis and function of Langerhans cells and other langerin-expressing dendritic cells. Nat Rev Immunol. (2008) 8:935–47.
2.Moore PF. Histiocytic diseases. Vet Clin North Am Small Anim Pract. (2023) 53:121–40.
3.Affolter VK, Moore PF. Feline progressive histiocytosis. Vet Pathol. (2006) 43:646–55.
4.Affolter VK, Moore PF. Localized and disseminated histiocytic sarcoma of dendritic cell origin in the dog. Vet Pathol. (2002) 39:74–83.
5.Arico M, Egeler RM. Clinical aspects of langerhans cell histiocytosis. Hematol Oncol Clin North Am. (1998) 12:247–58.
6.Day MJ, Lopatkin I, Lucke VM, Withbread TJ. Multiple cutaneous histiocytomas in a cat. Vet Dermatol. (2000) 11:305–10.
7.Rocamora-Blanch G, Climent F, Solanich X. Histiocytosis. Med Clin. (2023) 161:166–75.
8.Treggiari E, Ressel L, Polton GA, Benoit J, Desmas I, Blackwood L. Clinical outcome, PDGFRβ and KIT expression in feline histiocytic disorders: a multicentre study. Vet Comp Oncol. (2017) 15:65–77.
9.Cunha NP, Ghisleni G, Scarampella F, Fabbrini F, Sforna M, Cornegliani L, et al.. Cytologic and immunocytochemical characterization of feline progressive histiocytosis. Vet Clinical Pathol. (2014) 43:428–36.
10.Coste M, Prata D, Castiglioni V, Minoli L, Etienne-Raffestin CL, Boulouha L, et al.. Feline progressive histiocytosis: a retrospective investigation of 26 cases and preliminary study of Ki67 as a prognostic marker. J Vet Diagn Invest. (2019) 31:801–8.
11.Pierezan F, Mansell J, Ambrus A, Hoffmann AR. Immunohistochemical expression of ionized calcium binding adapter molecule 1 in cutaneous histiocytic proliferative, neoplastic and inflammatory disorders of dogs and cats. J Comp Pathol. (2014) 151:347–51.
12.Solc M, Jazic E, Crandell J, Loeffler D. Feline progressive dendritic cell histiocytosis in a domestic long hair feline. Vet Rec Case Rep. (2017) 5:1–4.
13.Spugnini EP, Baldi A. Electrochemotherapy in veterinary oncology state-of-the-art and perspectives. Vet Clin Small Anim. (2019) 49:967–79.
14.Tellado M, Mir LM, Maglietti F. Veterinary guidelines for electrochemotherapy of superficial tumors. Front Vet Sci. (2022) 9:868989.
15.Souza LMS, Gorza LL, Merísio ACR, Sena BV, Almeida IO, Flecher MC, et al.. Canine mast cell tumour lomustine’s sensitization by tyrosine kinase inhibitors. Acta Sci Vet. (2022) 50:839.
16.Clifford CA, Skorupski KA, Moore PF. Miscellaneous tumor In: Vail DM, Thamm DH, Liptak MJ, editors. Withrow & MacEwen’s small animal clinical oncology. St Louis: Elsevier; (2020). 773–810.
17.Hirabayashi M, Chambers JK, Sumi A, Harada K, Haritani M, Omachi T, et al.. Immunophenotyping of nonneoplastic and neoplastic histiocytes in cats and characterization of a novel cell line derived from feline progressive histiocytosis. Vet Pathol. (2020) 57:758–73.
18.Shortman K, Naik SH. Steady-state and inflammatory dendritic-cell development. Nat Rev Immunol. (2007) 7:19–30.
19.Mitchell L, Thamm DH, Biller BJ. Clinical and immunomodulatory effects of toceranib combined with low-dose cyclophosphamide in dogs with cancer. J Vet Intern Med. (2012) 26:355–62.
20.Bosnjak M, Jesenko T, Markelc B, Cerovsek A, Sersa G, Cemazar M. Sunitinib potentiates the cytotoxic effect of electrochemotherapy in pancreatic carcinoma cells. Radiol Oncol. (2022) 56:164–72.
21.Galluzzi L, Vitale I, Warren S, Adjemian S, Agostinis P, Martinez AB, et al.. Consensus guidelines for the definition, detection and interpretation of immunogenic cell death. J Immunother Cancer. (2020) 8:337–57.
22.Mir L. Bases and rationale of the electrochemotherapy. Ejc Suppl. (2006) 4:38–44.
23.Tounekti O, Pron G, Belehradek J, Jr, Mir LM. Bleomycin, an apoptosis-mimetic drug that induces two types of cell death depending on the number of molecules internalized. Cancer Res. (1993) 53:5462–9.
24.Bendix MB, Houston A, Forde PF, Brint E. Electrochemotherapy and immune interactions; A boost to the system? Eur J Surg Oncol. (2022) 48:1895–900.