| 一般情况 | |
|---|---|
| 品种:松狮犬 | |
| 年龄:8.5岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:乳腺癌 | |
01 主诉及病史
2021年1月21日,因乳腺肿瘤复发就诊。
7个月前接受了单侧右乳全切术,但乳腺肿瘤(3 cm)未进行组织病理学检查。本次就诊前1个月,在手术疤痕上发现乳腺肿瘤复发,生长迅速。
02 检查
体重4.0千克。复发的乳腺肿瘤从右侧M3进展到M5,呈直径3 cm的条索状(长13.5 cm),并延伸到M4-M5的左侧乳腺(长4.8 cm;下图)。右腹股沟淋巴结3×4 cm,左腹股沟淋巴结正常。
麻醉状态下(0.2 mg/kg美沙酮和5 μg/kg美托咪定预处理,丙泊酚诱导,异氟醚气体吸入麻醉)进行了CT检查,显示髂骨、骶骨、胸骨上和右腹股沟淋巴结可能发生了肿瘤转移。肺部、腹腔器官和脑部均未发现转移灶(下图)。
↑ 右腹股沟、髂骨内侧(a)、外侧(b)、骶骨(c)和胸骨(d)淋巴结增大,呈圆形,注射造影剂后呈强均匀强化,强烈怀疑已被肿瘤浸润。肺、腹部器官和脑均未发现转移灶。
乳腺肿瘤和右腹股沟淋巴结的细针穿刺细胞学检查显示,细胞呈游离的圆形,或少部分成簇,证实了上皮性增殖。细胞中等或较大,通常具有空泡化的嗜碱性胞质,核圆形,核胞质比高,染色质形态粗糙,呈网状,富含多个核小体。无细胞和无核分裂非常明显。观察到频繁的有丝分裂和一些多核细胞,右腹股沟淋巴结被相同的细胞浸润(下图)。
↑ (a)细胞呈游离的圆形,或部分成簇,证实了上皮性增殖。(b)细胞中等或较大,通常有空泡化的嗜碱性胞质,核圆形,核胞质比高,染色质形态粗糙,呈网状,富含多个核小体。无细胞和无核分裂非常明显。观察到频繁的有丝分裂和一些多核细胞。(c)腹股沟淋巴结被同样的细胞浸润,怀疑转移灶。
生化结果基本正常(谷丙转氨酶157 UI/L [<100],白/球比为0.7)。接受了非罗考昔(3.56 mg/kg/天)治疗。血细胞计数和凝血时间均正常。
主人要求进行手术。
03 手术
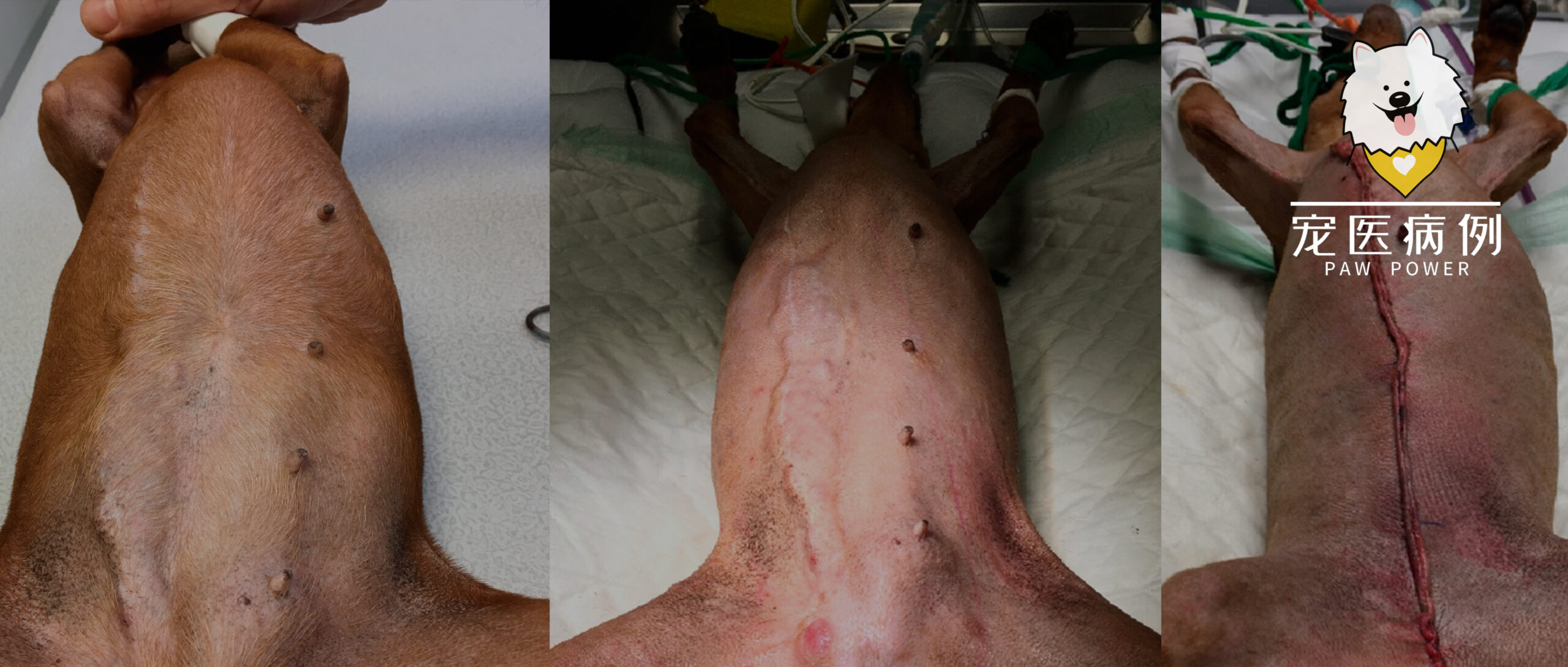
CT检查6天后进行了手术,包括卵巢切除术,同时切除了四条髂淋巴结和两条骶淋巴结,大面积切除右侧乳腺条索状肿瘤和右腹股沟淋巴结,并进行了M2-M5左侧乳房切除术(下图)。
↑ (a)手术当天乳腺肿瘤复发情况。肿瘤在6天内进一步增大。首先进行了卵巢切除术,并切除了髂淋巴结和骶淋巴结,然后对迅速增大的右侧复发条索状肿瘤进行了根治性切除。手术方案见红笔所示。(b)手术后的疤痕。(c)切除的骶淋巴结和髂淋巴结。
手术第2天进行了胸骨切开术,以切除胸骨上淋巴结。手术前2小时硬膜外注射了吗啡止痛,并在诱导前静脉注射芬太尼(5 mg/kg)和氯胺酮(0.6 mg/kg),诱导时使用丙泊酚(2 mg/kg)和地西泮(0.25 mg/kg)。手术在氯胺酮(0.6 mg/kg/h)和芬太尼(5 mg/kg/h)的恒速输注下进行。术后16小时内,恒速输注速度逐渐降低。
组织病理学检查显示,乳腺癌为III级,向淋巴管内发展,伴有大量肿瘤栓子和多灶淋巴结转移(切除的所有淋巴结均被浸润,包括胸骨上淋巴结)(下图),相当于WHO分类中的IV期(T3N2M0)。边缘无肿瘤组织。
↑ 乳腺肿瘤呈浸润性(a),伴有淋巴管内侵犯(b)。检查结果显示为III级乳腺癌。发现多灶性淋巴结转移(c)。
术后5天内,服用阿莫西林-克拉维酸(12.5 mg/kg,每日一次)、非罗考昔(3.56 mg/kg,每日一次)和呋塞米(1 mg/kg/天,5 天)(以减轻后肢水肿)。
术后10天开始使用苯丁酸氮芥(2 mg,隔天一次,6.9 mg/m2)治疗。
术后11天,由于右侧远端伤口开裂,进行了手术缝合伤口。
04 化疗
术后14天,伤口愈合良好,开始卡铂化疗(270 mg/m2);苯丁酸氮芥化疗隔天继续,每天服用非罗考昔。每次化疗前都要住院24小时,并在每次静脉化疗前以最大耐受剂量静脉注射马罗吡坦(1 mg/kg/天)。在每次卡铂化疗后的4天内,还系统地口服了马罗吡坦(1 mg/kg/天)。
3周后进行了第2次卡铂化疗(由于中性粒细胞减少,化疗剂量改为202 mg/m2),同时使用了13天非罗考昔,并在出现外阴水肿后停用。
第2次化疗3周后,发现肩胛前淋巴结肿大(左2 cm;右3.5 cm),细针穿刺细胞学检查显示被乳腺肿瘤浸润。开始口服托西尼布(2.03 mg/kg,每天一次)。4天后切除了这两个淋巴结,组织学检查证实了肿瘤转移。为避免伤口裂开,下一次卡铂化疗推迟到第2次化疗后1.5个月进行。
接下来的化疗(共6次)每4周进行一次。每次化疗前2天停用苯丁酸氮芥,3天后恢复。前一天停用非罗考昔,8天后恢复。前一天停用托西尼布,5天后恢复。托西尼布和苯丁酸氮芥交替使用。由于化疗当天出现中性粒细胞减少,卡铂剂量逐渐减至150 mg/m2。第6次卡铂给药后,只保留了非罗考昔、苯丁酸氮芥和托西尼布。
不良反应大多为低度不良反应(在卡铂剂量的最低点发生了7次1级中性粒细胞减少和1次3级中性粒细胞减少;在卡铂首次剂量为270 mg/m2和卡铂第6次化疗后发生了2级血小板减少)。血小板减少可能是由于癌症的进展,而不是治疗的直接不良反应。没有出现贫血或胃肠道副作用,谷丙转氨酶和肌酐始终正常。
05 预后
在整个治疗期间,该犬的生活质量非常好,体重没有减轻(反而增加了4-5千克),食欲稳定,活动正常,与主人的互动正常,生活习惯正常。
第6次化疗后,突然出现腹腔血肿,并伴有腹股沟淋巴结反应。停止了非罗考昔、苯丁酸氮芥和托西尼布的治疗。5天后血肿缩小。除了腹股沟淋巴结肿大外,没有乳腺肿瘤局部复发的迹象。
在最后一次卡铂化疗5周后,尽管血小板持续减少,但还是重新使用了非罗考昔和托西尼布。CT检查(下图)显示有多处脊柱转移灶,但没有发现其他部位的转移,该犬在CT检查第2天死亡。没有进行尸检。从在本院最初的手术到因乳腺肿瘤死亡的时间为218天(7个月零6天)。
↑ 最后一次的CT检查。C6、L3、L6、L7、S1和S2椎体出现箭头所指的转移性病变。(L6的病变严重侵入髓管,此处未显示)。
06 讨论
很少有研究证明化疗对犬侵袭性乳腺癌有疗效。在单独使用时,一些药物对乳腺癌的转移[1]或术后小群体的中位生存期有益处[2,3],但其他研究未能证明化疗对术后中位生存期有任何益处[4-7]。
这种结果的缺乏可能是由于队列的异质性(手术类型、组织学类型/分级、准确的转移评估和治疗类型)以及大多数出版物中纳入的患者数量较少。因此,仍然缺乏根据犬肿瘤的组织学分类、分级和分期而制定的标准化高效方案,而在人类病例中确实存在这种方案[8]。
本病例报告描述了一例复发的III级犬乳腺癌,该肿瘤演变为明显的淋巴管内侵犯和多灶性淋巴结转移(IV期),采用了根治性手术和辅助化疗相结合的强化治疗。后者结合了卡铂最大耐受剂量化疗(必要时调整剂量)和非罗考昔、托西尼布和苯丁酸氮芥的月经周期化疗(逐步给药、仔细监测)。
通过调整每种分子的剂量,避免了不良事件的发生,使患者存活了218天,并获得了良好的生活质量。这是首次描述这种治疗组合的病例报道。这种治疗方法应在大规模的前瞻性研究中进行测试。
在Goldschmidt于2011年提出的新组织学分类法[10]中,乳腺实体癌被认为是高度恶性的犬乳腺癌。如果不考虑炎症性癌,它们与无弹性癌、粘液腺癌和恶性肌上皮瘤一样,预后最差[11-13]。在本病例中,肿瘤大于5 cm,生长迅速,细胞分化差,侵犯淋巴管、浸润骶骨、髂骨和胸骨上淋巴结。所有这些因素都是非常不利的预后参数[11,14]。
组织学IIIb期预后较差,术后中位生存时间为163天[15,16]。此外,如果淋巴结大量浸润,而CT检查未显示其他组织浸润,则报告的肿瘤分期至少为IV期,这进一步恶化了预后[12]。由于乳腺癌细胞倾向于侵入骨髓[17-20],不能确定本病例的骨髓转移是否已经存在,但在第一次CT检查时,骨髓转移并没有显现出来。
本可以对本病例进行骨髓穿刺,通过免疫组化检查[21]寻找骨髓中是否存在上皮细胞,但肿瘤细胞的圆形外观及其CK5/6阴性可能会在这种情况下产生假阴性结果。无细胞DNA检测本可以检测出乳腺肿瘤细胞,但血液中的检测率仅为61%,骨髓中的检测率则未知[22]。
极少数已发表的病例系列报告了单独使用最大耐受剂量化疗对患有犬乳腺肿瘤存活率的影响[1-7,23,24]。单独使用卡铂[3]、同时使用纳曲酮[7]或同时使用甲氧环磷酰胺化疗[24]似乎对患有乳腺癌的雌性犬的存活率有益。
COX2过度表达会促进血管生成和侵袭[25],使用抗COX2的消炎药曾对某些类型的乳腺癌(即炎性乳腺癌)产生过效果[23,26-29]。在体外和体内,非罗考昔似乎也能促进乳腺癌细胞的凋亡,尤其是在三阴性肿瘤的情况下[30]。在既往研究中,首先单独使用卡铂,不使用抗炎药物,在最后一次化疗后给予抗炎药物,持续6个月[3]。之前发表的研究表明,托西尼布对炎性乳腺癌有疗效[28,31],这种癌也会侵犯淋巴管,就像本病例中描述的实体癌一样。
总之,本病例报告对一只患有严重侵袭性乳腺癌且预后极差的雌性犬进行了根治性手术和多模式疗法,包括最大耐受剂量的化疗和甲氧嘧啶疗法、非罗昔布和托西尼布。 调整卡铂、托西尼布、非罗考昔和苯丁酸氮芥的剂量避免了不良反应以及生活质量的下降。
该犬生活正常,没有丧失活动能力,而且继续与主人互动,甚至比以前更多。包括手术和化疗在内的治疗使它存活了218天。然而,这只是一个病例,只有对类似病例进行前瞻性研究,才能确定这种综合治疗方法与对照组相比是否能延长中位存活时间、是否安全以及是否可用于侵袭性极强的犬乳腺癌。
文献来源:Beaudu-Lange C, Lange E. Intensive Multimodal Chemotherapy in a Dog Suffering from Grade III/Stage IV Solid Mammary Carcinoma. Animals (Basel). 2024 Sep 9;14(17):2618.
参考文献
1.Suryawanshi R.V. Assessment of Efficacy and Toxicity of Cyclophosphamide Chemotherapy in Canines with Malignant Mammary Tumor: A Retrospective Study. Vet. Med. Int. 2021;2021:5520603.
2.Karayannopoulou M., Kaldrymidou E., Constantinidis T.C., Dessiris A. Adjuvant Post-operative Chemotherapy in Bitches with Mammary Cancer. J. Vet. Med. A. 2001;48:85–96.
3.Lavalle G.E., De Campos C.B., Bertagnolli C., Cassali G.D. Canine Malignant Mammary Gland Neoplasms with Advanced Clinical Staging Treated with Carboplatin and Cyclooxygenase Inhibitors. Vivo. 2012;26:375–380.
4.Tran C.M., Moore A.S., Frimberger A.E. Surgical treatment of mammary carcinomas in dogs with or without postoperative chemotherapy. Vet. Comp. Oncol. 2014;14:252–262.
5.Marconato L., Lorenzo R.M., Abramo F., Ratto A., Zini E. Adjuvant gemcitabine after surgical removal of aggressive malignant mammary tumours in dogs. Vet. Comp. Oncol. 2008;6:90–101.
6.Simon D., Schoenrock D., Baumgartner W., Nolte I. Postoperative Adjuvant Treatment of Invasive Malignant Mammary Gland Tumors in Dogs with Doxorubicin and Docetaxel. J. Vet. Intern. Med. 2006;20:1184–1190.
7.Machado M.C., da Costa-Neto J.M., Portela R.D., D’Assis M.J.M.H., Martins-Filho O.A., Barrouin-Mello S., Ferreira Borges N., Silva F.L., Estrela-Lima A. The effect of naltrexone as a carboplatin chemotherapy-associated drug on the immune response, quality of life and survival of dogs with mammary carcinoma. PLoS ONE. 2018;13:e0204830.
8.Valdivia G., Alonso-Diez Á., Pérez-Alenza D., Peña L. From Conventional to Precision Therapy in Canine Mammary Cancer: A Comprehensive Review. Front. Vet. Sci. 2021;8:623800.
9.LeBlanc A.K., Atherton M., Bentley R.T., Boudreau C.E., Burton J.H., Curran K.M., Dow S., Giuffrida M.A., Kellihan H.B., Mason N.J., et al. Veterinary Cooperative Oncology Group-Common Terminology Criteria for Adverse Events (VCOG-CTCAE v2) following investigational therapy in dogs and cats. Vet. Comp. Oncol. 2021;19:311–352.
10.Goldschmidt M., Peña L., Rasotto R., Zappulli V. Classification and grading of canine mammary tumors. Vet. Pathol. 2011;48:117–131.
11.Abadie J., Nguyen F., Loussouarn D., Peña L., Gama A., Rieder N., Belousov A., Bemelmans I., Jaillardon L., Ibisch C., et al. Canine invasive mammary carcinomas as models of human breastcancer. Part 2: Immunophenotypes and prognostic significance. Breast Cancer Res. Treat. 2018;167:459–468.
12.Peña L., De Andrés P.J., Clemente M., Cuesta P., Pérez-Alenza M.D. Prognostic Value of Histological Grading in Noninflammatory Canine Mammary Carcinomas in a Prospective Study with Two-Year Follow-Up: Relationship with Clinical and Histological Characteristics. Vet. Pathol. 2013;50:94–105.
13.Canadas A., França M., Pereira C., Vilaça R., Vilhena H., Tinoco F., Silva M.J., Ribeiro J., Medeiros R., Oliveira P., et al. Canine Mammary Tumors: Comparison of Classification and Grading Methods in a Survival Study. Vet. Pathol. 2019;56:208–219.
14.de Araújo M.R., Campos L.C., Ferreira E., Cassali G.D. Quantitation of the Regional Lymph Node Metastatic Burden and Prognosis in Malignant Mammary Tumors of Dogs. J. Vet. Intern. Med. 2015;29:1360–1367.
15.Chocteau F., Abadie J., Loussouarn D., Nguyen F. Proposal for a Histological Staging System of Mammary Carcinomas in Dogs and Cats. Part 1: Canine Mammary Carcinomas. Front. Vet. Sci. 2019;6:388.
16.Nguyen F., Peña L., Ibisch C., Loussouarn D., Gama A., Rieder N., Belousov A., Campone M., Abadie J. Canine invasive mammary carcinomas as models of human breast cancer. Part 1: Natural history and prognostic factors. Breast Cancer Res. Treat. 2018;167:635–648.
17.Marconato L., Facchinetti A., Zanardello C., Rossi E., Vidotto R., Capello K., Melchiotti E., Laganga P., Zamarchi R., Vascellari M. Detection and Prognostic Relevance of Circulating and Disseminated Tumour Cell in Dogs with Metastatic Mammary Carcinoma: A Pilot Study. Cancers. 2019;11:163.
18.Jaillardon L., Barthélemy A., Goy-Thollot I., Pouzot-Nevoret C., Fournel-Fleury C. Mammary gland carcinoma in a dog with peripheral blood and bone marrow involvement associated with disseminated intravascular coagulation. Vet. Clin. Pathol. 2012;41:261–265.
19.Clemente M., Pérez-Alenza M.D., Peña L. Metastasis of canine inflammatory versus non-inflammatory mammary tumours. J. Comp. Pathol. 2010;143:157–163.
20.Cooley D.M., Waters D.J. Skeletal metastasis as the initial clinical manifestation of metastatic carcinoma in 19 dogs. J. Vet. Intern. Med. 1998;12:288–293.
21.Taylor B.E., Leibman N.F., Luong R., Loar A.S., Craft D.M. Detection of carcinoma micrometastases in bone marrow of dogs and cats using conventional and cell block cytology. Vet. Clin. Pathol. 2013;42:85–91.
22.Flory A., Kruglyak K.M., Tynan J.A., McLennan L.M., Rafalko J.M., Fiaux P.C., Hernandez G.E., Marass F., Nakashe P., Ruiz-Perez C.A., et al. Clinical validation of a next-generation sequencing-based multi-cancer early detection “liquid biopsy” blood test in over 1000 dogs using an independent testing set: The CANcer Detection in Dogs (CANDiD) study. PLoS ONE. 2022;17:e0266623.
23.Arenas C., Peña L., Granados-Soler J.L., Pérez-Alenza M.D. Adjuvant therapy for highly malignant canine mammary tumours: Cox-2 inhibitor versus chemotherapy: A case–control prospective study. Vet. Rec. 2016;179:125.
24.Machado M.C., Yamamoto P.A., Pippa L.F., de Moraes N.V., Neves F.M.F., Portela R.D., Barrouin-Melo S.M., Hielm-Björkman A., Godoy A.L.P.C., Estrela-Lima A. Pharmacokinetics of Carboplatin in Combination with Low-Dose Cyclophosphamide in Female Dogs with Mammary Carcinoma. Animals. 2022;12:3109.
25.Queiroga F.L., Pires I., Lobo L., Lopes C.S. The role of Cox-2 expression in the prognosis of dogs with malignant mammary tumours. Res. Vet. Sci. 2010;88:441–445.
26.Campos C.B.D.E., Lavalle G.E., Monteiro L.N., Pêgas G.R.A., Fialho S.L., Balabram D. Adjuvant thalidomide and metronomic chemotherapy for the treatment of canine malignant mammary gland neoplasms. Vivo. 2018;32:1659–1666.
27.De Souza C.H., Toledo-Piza E., Amorin R., Barboza A., Tobias K.M. Inflammatory mammary carcinoma in 12 dogs: Clinical features, cyclooxygenase-2 expression, and response to piroxicam treatment. Can. Vet. J. 2009;50:506–510.
28.Rossi F., Sabattini S., Vascellari M., Marconato L. The impact of toceranib, piroxicam and thalidomide with or without hypofractionated radi ation therapy on clinical outcome in dogs with inflammatory mammary carcinoma. Vet. Comp. Oncol. 2018;16:497–504.
29.Vieira T.C., Oliveira E.A., Dos Santos B.J., Souza F.R., Veloso E.S., Nunes C.B., Del Puerto H.L., Cassali G.D. COX-2 expression in mammary invasive micropapillary carcinoma is associated with prognostic factors and acts as a potential therapeutic target in comparative oncology. Front. Vet. Sci. 2022;12:983110.
30.Brandi A., de Faria Lainetti P., Elias F., Rodrigues M.M.P., Fagundes Moraes L., Laufer-Amorim R., de Camargo L.S., Salles Gomes C.O.M., Fonseca-Alves C.E. Firocoxib as a Potential Neoadjuvant Treatment in Canine Patients with Triple-Negative Mammary Gland Tumors. Animals. 2022;13:60.
31. Alonso-Miguel D., Valdivia G., García-San José P., Alonso-Diez Á., Clares I., Portero M., Peña L., Pérez-Alenza M.D. Clinical outcome of dogs diagnosed with canine inflammatory mammary cancer treated with metronomic cyclophosphamide, a cyclooxygenase-2 inhibitor and toceranib phosphate. Vet. Comp. Oncol. 2022;20:179–188.