| 一般情况 | |
|---|---|
| 品种:哈士奇 | |
| 年龄:13岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肝细胞癌 | |
01 主诉及病史
为了对肝尾状叶的肝细胞癌进行微波消融治疗入院。
22个月前,因直径7.5 cm的巨大肝细胞癌而接受了左肝叶切除术。当时肝脏没有其他病变。术后3个月,超声发现肝右叶有2个高回声结节,最大的直径达 1.1 cm。通过CT对这些病变进行了监测,在随后的19个月中,这些病变不断增大。
02 检查
3个月前的胸部、腹部和盆腔CT显示,肝尾状叶、右内侧叶和右外侧叶有多个大小不一、低增强、界限不清的病灶。尾状叶内的肿块大小为2.7×1.9×2.3 cm,呈低增强和对比度增强(对比前51 HU,对比后121 HU)(下图)。右外侧叶病灶大小为1.5×1.1×1.7 cm,右内侧叶病灶大小为4.8×3.7×5.1 cm。
↑ 尾状叶肿块的横断面对比前(A)和对比后(B),以及背侧(C)和矢状面(D)对比后图像,符合肝细胞癌。肿块(白色箭头)呈卵圆形,位于尾状叶最尾端,大小约2.7×1.9×2.3 cm。肿块呈不均质低强化,中度不均质对比度增强,并使肝包膜变形。
1个月前通过腹腔镜对尾状叶、右外侧叶、右内侧叶和左内侧叶病变部位进行了活检。尾状叶肿块符合肝细胞癌,其余肿块为良性结节性增生。右内侧、右外侧和左内侧肿块的铜浓度升高(右内侧716 μg/g,右外侧1229 μg/g,左内侧1086 μg/g [<400])。尾状叶肿块的铜浓度正常(229 μg/g)。
体重30.7千克。皮肤上有多处小的、凸起的粉色皮损。凝血酶原时间轻度升高(14秒 [7.06-9.00]),活化部分凝血活酶时间正常(13.0秒 [10.12-14.21])。PCV为41%,总固形物为8 g/dL。
讨论的治疗方案包括尾状叶切除术和尾状叶肿瘤微波消融。最终主人选择了腹腔镜微波消融,以保留肝实质,并通过微创方法将手术并发症降至最低。肿块的位置和大小也非常适合微波消融。
03 治疗
全麻后在液压浮动台上以约30°反向特伦德伦伯姿势背卧。通过脐部常规放置一个30 mm的腹腔镜手术孔。用二氧化碳对腹部充气至8 mmHg,然后将带有高清摄像头的5 mm 30°腹腔镜放入手术口。使用钝头腹腔镜探针操作肝叶并分离肝尾叶。将狗向左侧旋转约45°,以方便进入肝脏右叶。
然后将一个直径10mm、频率13-5 mHz的腹腔镜曲面阵列四向换能器置于单切口腹腔镜手术孔的15 mm套管内。将换能器直接放在尾状叶上,使用超声监视器获取尾状叶图像。多普勒血流用于评估肿块的灌注情况(下图)。
↑ 微波消融前,尾状叶肿块内可看到彩色多普勒信号,表明有灌注。
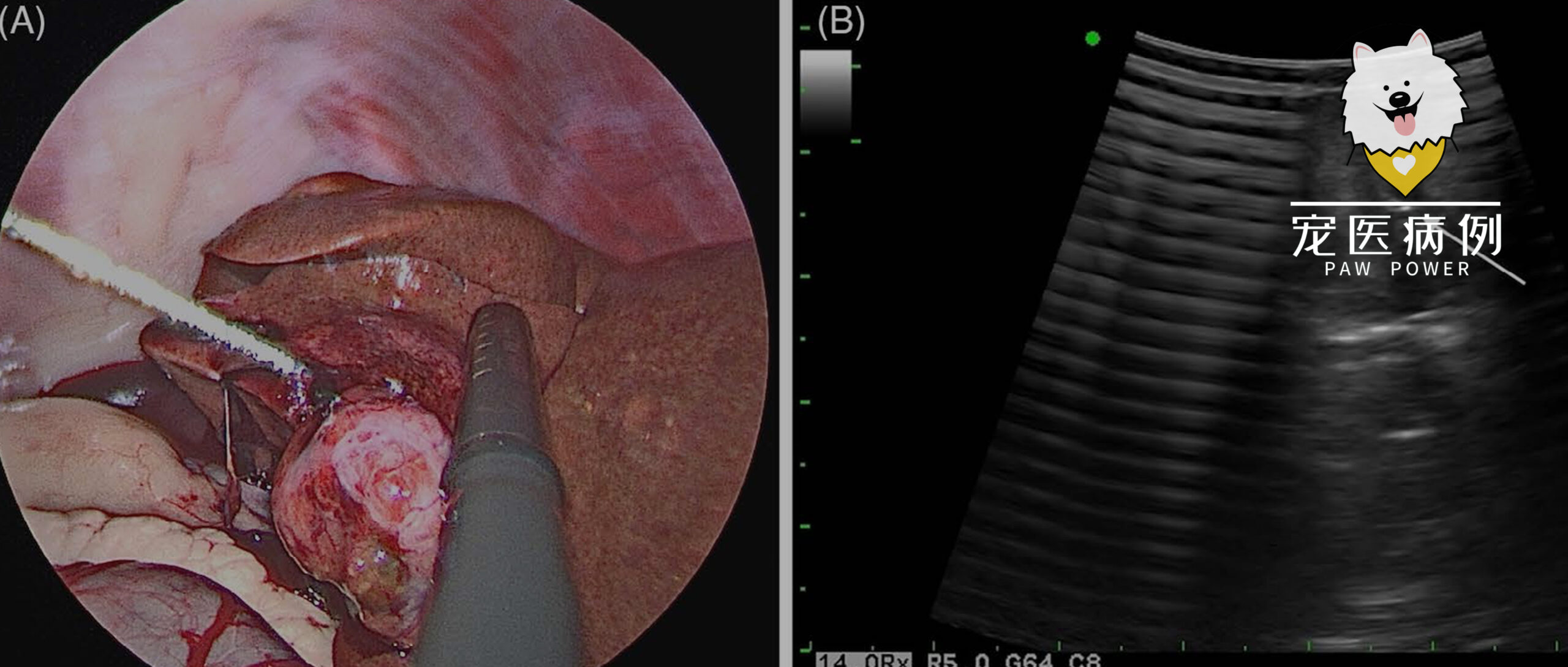
在腹腔镜可视情况下,通过右腹经皮导入17号微波消融探头。在腹腔镜超声引导下,将探头插入肿块的外侧缘、内侧缘和中心部位(下图)。由于无法直接触摸肿瘤,腹腔镜超声被用来观察肿瘤的实质边缘,并确保每次将探针再次插入肿块时都能正确放置。在不同位置分别以30 W和45 W功率消融肿块外侧缘5分钟和3分钟。内侧边缘在不同位置分别以45 W功率消融3分钟和35 W功率消融2分钟。每次将消融探头重新插入肿块时,都会使用腹腔镜超声观察肿瘤边缘以及肿块内的血管,以避免不慎刺穿大血管。
↑ (A)腹腔镜超声传感器用于确认消融探头是否位于尾状叶肿块中心。(B)尾状叶肿块的腹腔镜超声图像。消融探头(箭头)位于肿块中心,呈高回声金属状。
微波消融的功率设置和持续时间根据肿块的大小和形态而定,并符合制造商对可预测消融区域的描述。消融后对肿块进行了腹腔镜超声检查,多普勒血流证实肿块无灌注,表明已完全凝固性坏死(下图)。观察了手术部位,发现有轻度自限性静脉出血。
↑ 微波消融后,肿块立即出现坏死、异质外观和空化区域。肿块内不再有明显的彩色多普勒信号,表明已完全凝固性坏死。
拔出操作头,对腹部进行二氧化碳吹扫,并按常规关闭切口。
04 预后
术后24小时内出院,出院时口服加巴喷丁和阿莫西林/克拉维酸(14.2 mg/kg,q12h,共服用14天)。
术后3个月,临床表现良好,CT显示尾状叶肿块大小为 2.7×3.3×1 cm,呈低增强(对比前后均为49 HU),边缘不规则。肿块内无对比度增强(下图)。
右内侧叶(下图)和右外侧叶肿块在外观和大小上保持不变。
整个肝脏内发现多个新的异质、界限不清、轻度对比度增强的肝结节和肿块。在先前肿块腹侧的右内侧叶中有一个新的结节,呈双叶状,与周围实质呈低强化(下图)。左内侧、右外侧和第四肝叶也发现了新的病变。
术后6个月,CT显示尾状叶肿块变小,大小为1.6×2.2×0.7 cm,低增强(对比前36 HU,对比后66 HU),周边有很薄的对比增强边缘(下图)。
右内侧叶腹侧的双叶结节较大,有坏死区域(下图)。其他病变保持不变,没有出现新的肝脏病变。
术后12个月,CT显示尾状叶肿块为2.5×0.6×0.4 cm,仍呈低增强状态(对比前49 HU,对比后76 HU),周边的对比剂增强边缘已消退(下图)。
右内侧叶腹侧的双叶结节明显增大,大小为8.1×8.4×4.7 cm(下图)。在初次CT中发现的右内侧叶内的另一个肿块大小保持不变。其他先前的病变在大小和外观上都没有变化。由于右内侧叶肿块在过去一年中明显增大,担心会是恶性肿瘤。
与主人讨论了多种方案,包括右内侧叶切除术或姑息治疗和监测。由于右内侧叶肿块明显大于3 cm,而3 cm是推荐用于肝癌微波消融的最大尺寸,因此不考虑对其进行微波消融。
术后13个月,接受了右内侧叶切除术和胆囊切除术。手术时还对第四肝叶、右外侧叶和右内侧叶的病灶进行了活检。右内侧叶肿块符合肝细胞癌,其余活检组织符合良性结节性增生。
术后20个月,出现嗜睡、食欲不振和体重减轻。体重为19.1千克。腹部超声发现肝脏右叶有多个界限不清的混合回声结节(大小可达0.6 cm)。细针穿刺结果显示肝细胞轻度至中度不典型性,伴有轻度空泡变和轻度混合性炎症。
术后777天,因生活质量下降而被实施安乐死。
05 讨论
肝细胞癌(Hepatocellular carcinoma,HCC)是犬最常见的原发性肝肿瘤。肿块型HCC是最常见的形式,但也会出现结节型和弥漫型HCC[1]。部分或完全肝叶切除术是治疗单发巨大型HCC的首选方法,中位生存时间超过1460天[2]。然而,对于影响多个肝叶的结节型和弥漫型HCC,手术切除可能并不可行。
如果病变影响多个肝叶,可考虑采用微波消融(microwave ablation,MWA)等局部治疗方法。MWA是利用电磁场对组织进行快速、均匀的加热,使肿瘤凝固性坏死[3,6]。肝脏肿瘤的MWA通常在腹腔镜超声引导下进行,以便同时进行分期,并确保安全、彻底地消融肿瘤[3]。
在犬中,肝脏病变的MWA鲜有报道,曾通过开腹手术、腹腔镜手术和超声引导下的经皮手术进行[4-6]。一份报告显示,通过腹腔镜方法在死亡犬和两只活犬身上对肝脏进行MWA是可行的[5]。但没有对探针在肿瘤内的准确位置进行评估。这对确保完全消融至关重要。
虽然两项研究均未出现手术并发症,但没有报道过完全消融,有一只狗被证实消融不彻底[5,6]。最近对狗的腹腔镜肝脏超声进行了研究,结果表明通过单个切口进入所有肝叶是可行的[7]。因此,腹腔镜超声在狗身上的应用与人类似,可帮助指导肝脏病变的MWA。
此前一项比较肝脏肿瘤开腹、腹腔镜和经皮MWA的研究显示,经皮治疗的肿瘤局部复发率更高[18]。这表明经皮方法实现完全消融可能更具挑战性。然而,之前也有报道称腹腔镜方法会增加患者的并发症,表明该技术存在缺陷[19,20]。这些并发症大多与使用二氧化碳充气有关[20]。因此,在腹腔镜MWA治疗肿瘤时,可以考虑使用提升腹腔镜而不是充气。
在本报告中,右内侧、右外侧和左内侧肝叶肿块的最初活检结果与结节性增生和铜积聚一致。后来右内侧肝脏肿块发展成了肝癌,而之前的活检结果是良性结节性增生。这既可能代表最初的诊断不正确,也可能是良性病变的恶性转化。
在人体内,HCC组织样本中检测到铜的蓄积增加。此外,威尔逊氏病是一种基因突变,会导致铜代谢改变和肝脏中铜浓度升高,据报道,威尔逊氏病患者的HCC发病率较高[25]。犬中也存在同样的联系。
之前一份关于狗的报告显示,HCC病变的铜浓度往往低于非肿瘤性肝组织[26]。在进行腹腔镜肝活检时,该犬肝脏右内侧良性结节性增生病变部位的铜含量较高,但肝尾部HCC病变部位的铜含量正常。右内侧病变后来发展成了HCC。因此,肝脏铜浓度升高可能会导致HCC的发生,但一旦HCC病变发生,铜浓度就会降低。有必要进一步研究狗体内铜浓度与HCC发展之间的关系,因为这可能是一种诊断和治疗策略,就像在人体内一样。
总之,在这只狗身上,肝癌MWA在腹腔镜超声引导下成功、安全地进行了手术,完全消融了病灶。腹腔镜超声引导下的肝肿瘤MWA应被视为犬HCC病例中的另一种微创方法。
文献来源:Solari FP, Case JB, Vilaplana Grosso FR, Bertran J, Fox-Alvarez S, Cabrera R. Laparoscopic ultrasound-guided microwave ablation of hepatocellular carcinoma in a dog. Vet Surg. 2024 Sep 16.
参考文献
1. Liptak JM. Hepatobiliary tumors. In: Vail DM, Thamm DH, Liptak JM, eds. Withrow and MacEwen’s Small Animal Clinical Oncology. 6th ed. Saunders Elselvier; 2013:405-410.
2. Liptak J, Dernell W, Monnet E, et al. Massive hepatocellular carcinoma in dogs—48 cases (1992–2002). J Am Vet Med Assoc. 2004;225(8):1225-1230.
3. Simo KA, Sereika SE, Newton KN, Gerber DA. Laparoscopicassisted microwave ablation for hepatocellular carcinoma: safety and efficacy in comparison with radiofrequency ablation. J Surg Oncol. 2011;104(7):822-829.
4. Yang T, Case JB, Boston S, Dark MJ, Toskich B. Microwave ablation for treatment of hepatic neoplasia in five dogs. J Am Vet Med Assoc. 2017;250(1):79-85.
5. Oramas A, Case JB, Toskich BB, et al. Laparoscopic access to the liver and application of laparoscopic microwave ablation in 2 dogs with liver neoplasia. Vet Surg. 2019;48(S1):O91-O98.
6. Locatelli A, Treggiari E, Innocenti M, Romanelli G. Percutaneous ultrasound-guided microwave ablation for treatment of hepatocellular carcinomas in dogs: four cases (2019–2020). J Small Anim Pract. 2022;63(12):897-903.
7. Solari FP, Case JB, Vilaplana Grosso FR, Regier PJ, Maxwell EA, Cabrera R. Laparoscopic ultrasonography of the liver is feasible and safe in dogs. Am J Vet Res. 2023;84:1-7.
8. Habibollahi P, Sheth RA, Cressman ENK. Histological correlation for radiofrequency and microwave ablation in the local control of hepatocellular carcinoma (HCC) before liver transplantation: a comprehensive review. Cancers (Basel). 2020;13(1):104.
9. Xu Z, Yang Z, Pan J, Hu Y. Individualized laparoscopic B-ultrasound-guided microwave ablation for multifocal primary liver cancer. Videosurg Other Miniinvasive Tech. 2018;13(1):9-16.
10. Liang P. Practice guidelines for ultrasound-guided percutaneous microwave ablation for hepatic malignancy. World J Gastroenterol. 2013;19(33):5430-5438.
11. Vogl T, Nour-Eldin NE, Hammerstingl R, Panahi B, Naguib N. Microwave ablation (MWA): basics, technique and results in primary and metastatic liver neoplasms—review article. Rofo. 2017;189(11):1055-1066.
12. Wang Z, Liu M, Zhang D, et al. Microwave ablation versus laparoscopic resection as first-line therapy for solitary 3–5-cm HCC. Hepatology. 2022;76(1):66-77.
13. Santambrogio R, Barabino M, D’Alessandro V, et al. Laparoscopic thermoablation for hepatocellular carcinoma in patients with liver cirrhosis: an effective procedure for tricky tumors. Med Oncol. 2020;37(4):32.
14. Santambrogio R, Opocher E, Ceretti AP, et al. Impact of intraoperative ultrasonography in laparoscopic liver surgery. Surg Endosc. 2007;21(2):181-188.
15. Rhaiem R, Piardi T, Renard Y, Deguelte S, Kianmanesh R. Laparoscopic thermal ablation of liver tumours. J Visc Surg. 2021;158(2):173-179.
16. Giglio MC, Garofalo E, Montalti R, Vanlander A, Troisi RI. The learning curve of laparoscopic ablation of liver tumors: a technically demanding procedure requiring dedicated training. Eur J Surg Oncol. 2021;47(10):2579-2585.
17. Santambrogio R, Vertemati M, Barabino M, Zappa MA. Laparoscopic microwave ablation: which technologies improve the results. Cancers (Basel). 2023;15(6):1814.
18. Groeschl RT, Pilgrim CHC, Hanna EM, et al. Microwave ablation for hepatic malignancies. Ann Surg. 2014;259(6):1195-1200.
19. Ceppa EP, Collings AT, Abdalla M, et al. SAGES/AHPBA guidelines for the use of microwave and radiofrequency liver ablation for the surgical treatment of hepatocellular carcinoma or colorectal liver metastases less than 5 cm. Surg Endosc. 2023;37(12):8991-9000.
20. Della Corte A, Ratti F, Monfardini L, et al. Comparison between percutaneous and laparoscopic microwave ablation of hepatocellular carcinoma. Int J Hyperthermia. 2020;37(1):542-548.
21. Spinella G, Valentini S, Spadari A, Fedrigo M. Laparoscopic ultrasonography in six dogs. Vet Radiol Ultrasound. 2006;47(3):283-286.
22. Yang WT, Johnson PJ. Monitoring response to treatment in liver tumours. Best Pract Res Clin Gastroenterol. 1999;13(4):637-654.
23. Yamashiki N, Kato T, Bejarano PA, et al. Histopathological changes after microwave coagulation therapy for patients with hepatocellular carcinoma: review of 15 explanted livers. Am J Gastroenterol. 2003;98(9):2052-2059.
24. Dong BW, Liang P, Yu XL, et al. Sonographically guided microwave coagulation treatment of liver cancer: an experimental and clinical study. Am J Roentgenol. 1998;171(2):449-454.
25. Wachsmann J. Molecular imaging and therapy targeting copper metabolism in hepatocellular carcinoma. World J Gastroenterol. 2016;22(1):221-231.
26. Harro CC, Smedley RC, Buchweitz JP, Langlois DK. Hepatic copper and other trace mineral concentrations in dogs with hepatocellular carcinoma. J Vet Intern Med. 2019;33(5):2193-2199.