
 | 品种:混种犬 |
| 年龄:11岁 | |
| 性别:雄 | |
| 诊断:念珠菌病 | |
01 主诉及病史
运动不耐受、不明原因的体重增加和皮肤病症状,包括躯干对称性脱毛。
02 检查
体重6.40千克,体况评分6/9,肌肉状况评分显示肌肉质量正常,听诊无重大异常。空腹时进行的血液检查显示,全血细胞计数无明显异常。生化分析显示胆固醇和甘油三酯水平升高。
甲状腺激素测定显示,总甲状腺素(TT4)<0.30 µg/dl [1.00-2.90],游离甲状腺素(FT4)< 0.3 ng/dl [0.5-3.0],促甲状腺激素(TSH)0.15 ng/ml [<0.50]。根据这些结果,该犬被诊断为甲状腺功能减退。
03 治疗
开始服用左旋甲状腺素钠(Thyradin-S片剂)。
04 预后
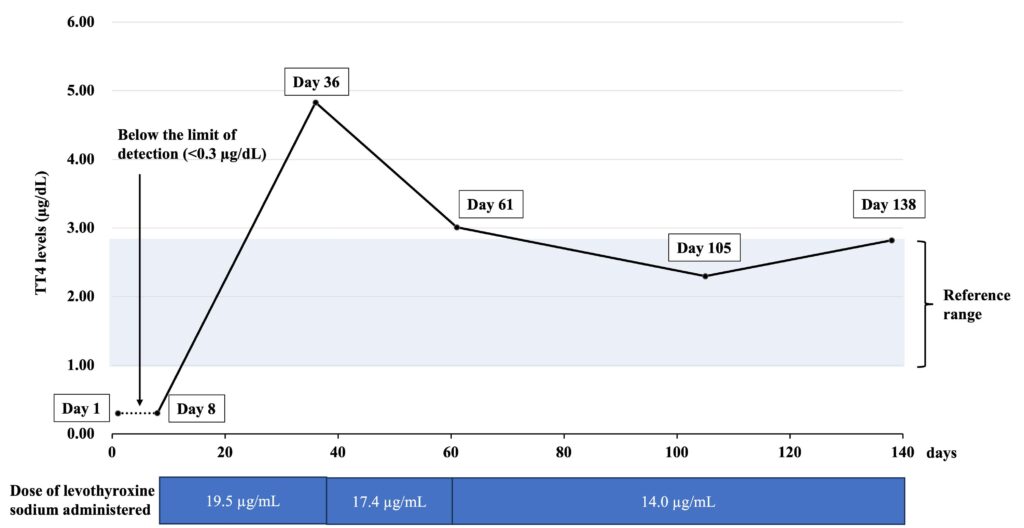
第36天,T4为4.83 µg/dl,表明左旋甲状腺素钠的剂量应减至17.4 µg/kg。所有血液样本都是在服用左旋甲状腺素后4-6小时内采集的,用于后续的TT4检测。
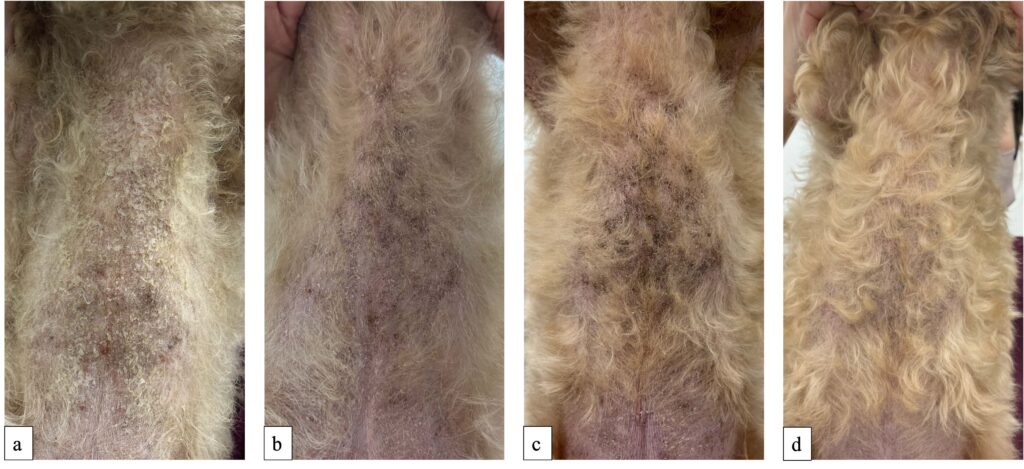
第46天,因背部出现鳞屑就诊。鳞屑出现已有约一周时间,该部位有轻微瘙痒。体重5.65千克(体况评分5/9,肌肉质量正常),体温38.5°C,心率150 bpm。在背部皮肤上观察到脱毛,有色素沉着并覆盖有鳞屑(下图a)。还发现躯干背面除脱毛部位外还有鳞屑(下图b)。
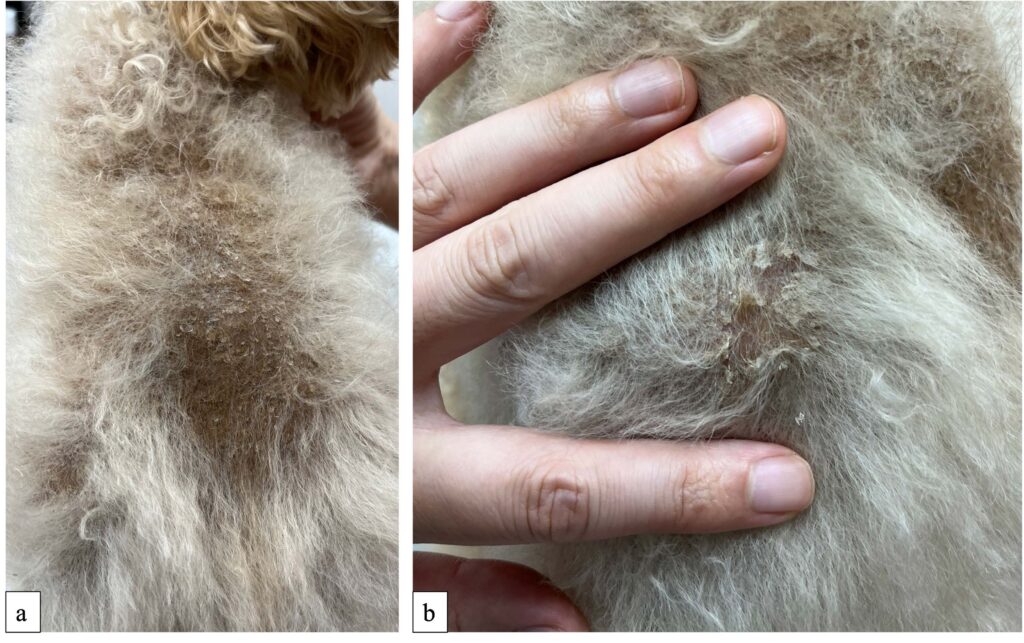
进行了皮肤病检查,包括毛发检查(毛发三色图)、细胞学检查(印模涂片)和伍德灯试验,均未发现明显变化。考虑到患者在鳞屑出现前服用了左旋甲状腺素钠,推测服用左旋甲状腺素钠与鳞屑之间可能存在因果关系。决定在逐渐减少左旋甲状腺素钠用量的同时继续监测病情(下图)。
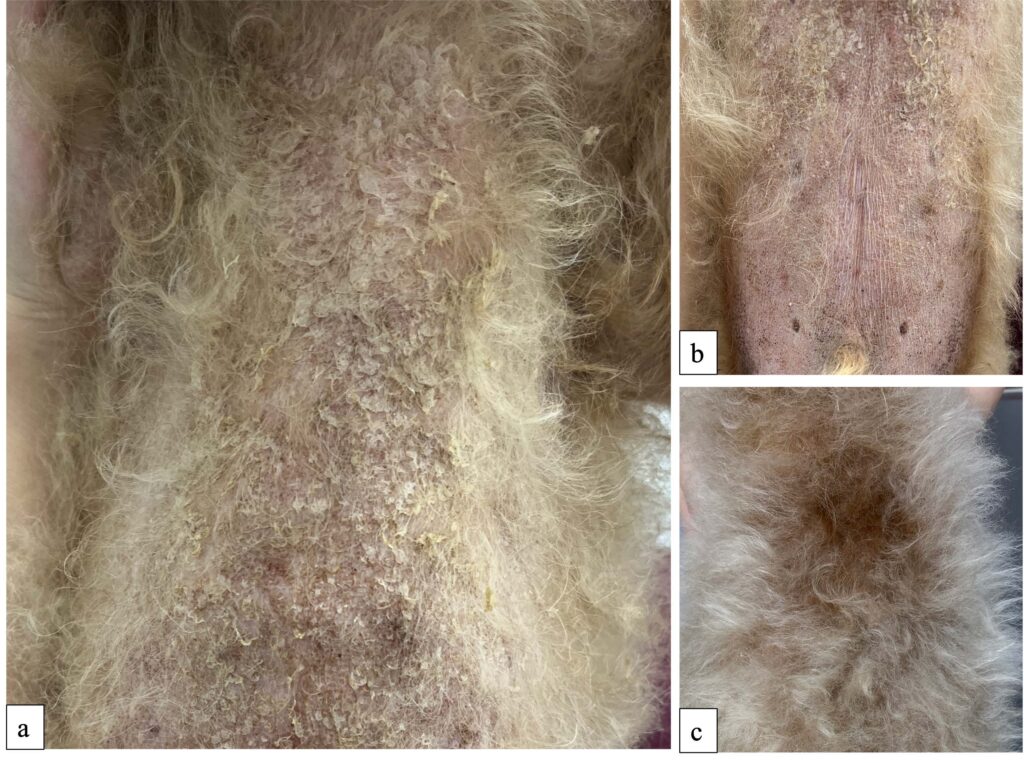
第61天,在躯干腹侧发现了大量鳞屑(下图)。背部的脱毛区发现毛发生长,鳞屑也已消失。TT4为3.01 µg/dl。这些结果表明,将左旋甲状腺素钠的剂量减少到14.0 µg/kg 是有益的。
第75天,躯干腹侧的鳞屑明显减少,只剩下一些细小的鳞屑。背部的毛发已经生长完毕,但新长出的毛发颜色比周围区域要深(下图)。
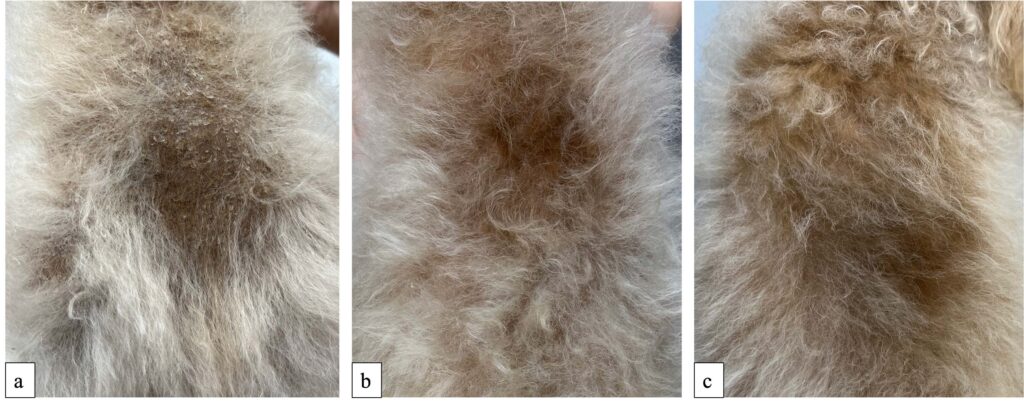
第105天,躯干腹侧的鳞屑几乎完全消失。与上次相比,色素沉着有所增加,而毛发已经生长。TT4为2.30 µg/dl,继续使用相同剂量的左旋甲状腺素钠。
第138天,躯干腹侧的色素沉着减少,毛发几乎完全生长(下图)。TT4为2.82 μg/dL,继续使用相同剂量的左旋甲状腺素钠。
05 讨论
鳞屑由脱落的角质细胞组成,它们被归类为继发性病变,因此,有必要确定病变的主要原因[1,2]。原发性疾病的鉴别诊断包括寄生虫感染、过敏、炎症性疾病以及神经源性和肿瘤性疾病(如果有瘙痒症状)。潜在原发性疾病的鉴别诊断包括内分泌疾病、感染、营养缺乏或失衡、代谢性疾病以及无瘙痒的皮肤肿瘤[1]。
甲状腺机能减退主要是成年犬的后天性疾病,其特征是原发性甲状腺无法产生足够的甲状腺素(T4)和三碘甲状腺原氨酸(T3)[3]。甲状腺功能减退的发病机理主要是免疫介导的甲状腺功能组织破坏(甲状腺炎)或特发性甲状腺萎缩[3,4]。
皮肤异常经常发生,通常包括躯干非瘙痒性脱毛、“鼠尾”外观、被毛质量差、皮脂溢出、色素沉着和复发性脓皮病[5]。其他主要报告的临床症状包括嗜睡、精神呆滞、运动不耐受、肥胖或不明原因的体重增加,以及寻热行为,而面神经麻痹、前庭疾病和多发性神经病则较少报告[6]。
甲状腺功能减退常常会被过度诊断,因为其症状并不特异,而且在解释甲状腺功能检测结果时也存在问题[3,9]。如有报道称,TT4水平会在疾病或压力期间、某些犬种(灰狗或萨路基犬)、随着年龄增长以及服用某些药物(如强的松)时出现继发性下降[7,10-12]。
本患者表现出运动不耐受和不明原因体重增加的临床症状,皮肤表现,如躯干对称性脱毛,生化检测显示空腹高胆固醇血症和高甘油三酯血症,甲状腺功能检测显示TT4和FT4水平较低,提示典型的甲状腺功能减退[3,5,13]。此外,患者在服用左旋甲状腺素钠后,运动不耐受和体重增加的情况迅速改善,因此被诊断为甲状腺功能减退[3]。
在本病例中,鳞屑是在服用左旋甲状腺素钠治疗犬甲状腺机能减退一个月后观察到的。除了逐渐减少左旋甲状腺素钠的用量外,没有进行其他治疗。3个月后鳞屑消失,同时在同一部位观察到毛发生长。因此,强烈怀疑与药物有关。
狗甲亢与猫甲亢类似,都是先天性甲状腺功能亢进。患有甲亢的狗会出现各种症状,包括兴奋、腹泻、体温升高、心动过速、呼吸过速、震颤和体重减轻[14-17]。然而,没有报告描述过皮肤脱屑。同样,厌食、瘙痒和皮肤症状(包括红斑)、活动减少、呕吐、腹泻、多尿和多动被报道为左旋甲状腺素钠的副作用[18],但没有出现脱屑病例。
有四个原因支持本病例为甲状腺功能减退过程中皮肤新陈代谢恢复导致的鳞屑。首先是鳞屑出现的位置。在本病例中,鳞屑出现在躯干,尤其是脱毛区。甲状腺机能减退引起脱毛的病理生理学特征是毛发周期停滞,这种停滞并不是全身性的,而是在特定的身体部位更为明显,如躯干和尾部[1,3,19]。
甲状腺机能减退导致新陈代谢减慢的皮肤区域并不一致。推测服用左旋甲状腺素钠能改善细胞代谢[1,18],从而促进毛发生长周期的恢复和皮肤的新陈代谢。此外,激素导致的细胞代谢改变也是鳞屑形成的原因[1,2]。因此,观察到鳞屑和脱毛发生的区域一般是相同的,这支持了这是由于左旋甲状腺素钠导致皮肤新陈代谢改变引起的假设[1]。
其次,在服用左旋甲状腺素钠后观察到几处鳞屑,但没有额外的鳞屑。这表明,鳞屑是与皮肤新陈代谢恢复正常状态有关的短暂现象。
第三是鳞屑出现的时间。有活力的表皮(基底层到颗粒层)大约在22天内更新[1,20]。在本病例中,鳞屑是在服用左旋甲状腺素钠约1个月后观察到的,这与鳞屑是由皮肤新陈代谢恢复引起的假设是一致的。
第四,鳞屑不是在毛囊周围观察到的,而是在整个表皮层观察到的。这表明鳞屑与皮肤新陈代谢而非毛发生长有关。
因此,在观察到脱毛的区域,皮肤新陈代谢过程也已停止,其方式类似于甲状腺功能减退导致的毛发周期停止。推测服用左旋甲状腺素钠可促进毛发周期和皮肤新陈代谢的恢复。此外,在皮肤新陈代谢开始的同时,还可观察到短暂的鳞屑。在本病例中,服用左旋甲状腺素钠后,TT4水平在较短时间内从低于测量限值迅速升高到超过标准值。本病例与其他类似病例之间的这种差异可能是导致观察到大量鳞屑的根本原因。
从病理上讲,鳞屑可分为潴留性角化过度和增生性角化过度。潴留性角化过度是指角质层过度粘连,无法正常脱落,积累到一定程度后大量脱落,而增殖性角化过度是指角质细胞增殖加速[1,2,19]。病理检查结果对于了解鳞屑出现背后的机制至关重要,而在本病例中,由于主人不同意,无法进行皮肤活检。因此,无法进一步调查该病例的详细机制。
总之,鳞屑一般被归类为继发性病变,因此有必要查明病因并采取相应的治疗措施。但在治疗甲状腺功能减退时,应该考虑到可能会出现不需要特殊治疗的鳞屑。在本病例中,鳞屑是在毛发生长之前观察到的,预计在毛发生长完成前后会自然消失。
文献来源:Kasuga Y, Murayama N. Scales in a dog after levothyroxine sodium treatment: A case report. Open Vet J. 2024 Oct;14(10):2707-2713.
参考文献
[1] Miller W.H, Griffin C.E, Campbell K.L. 7th. Philadelphia, PA, USA: W. B. Saunders; 2012. Muller & Kirk’s small animal dermatology.
[2] Shimizu H. Hoboken, NJ, USA: Wiley-Blackwell; 2017. Shimizu’s dermatology.
[3] Bugbee A, Rucinsky R, Cazabon S, Kvitko-White H, Lathan P, Nichelason A, Rudolph L. 2023 AAHA selected endocrinopathies of dogs and cats guidelines. J. Am. Anim. Hosp. Assoc. 2023;59:113–135.
[4] Gosselin S.J, Capen C.C, Martin S.L. Histologic and ultrastructural evaluation of thyroid lesions associated with hypothyroidism in dogs. Vet. Pathol. 1981;18:299–309.
[5] Dixon R.M, Mooney C.T. Evaluation of serum free thyroxine and thyrotropin concentrations in the diagnosis of canine hypothyroidism. J. Small Anim. Pract. 1999;40:72–8.
[6] Vitale C.L, Olby N.J. Neurologic dysfunction in hypothyroid, hyperlipidemic Labrador Retrievers. J. Vet. Intern. Med. 2007;21:1316–1322.
[7] Corsini A, Faroni E, Lunetta F, Fracassi F. Recombinant human thyrotropin stimulation test in 114 dogs with suspected hypothyroidism: a cross-sectional study. J. Small Anim. Pract. 2021;62:257–264.
[8] Strey S, Mischke R, Rieder J. Hypothyroidism in dogs: an overview. Tierarztl Prax. Ausg. K Kleintiere Heimtiere. 2021;49:195–205.
[9] Travail V, Fernandez Sanchez C, Costo J.M, Valentine N, Conroy M, Lee V, Bouziopoulos D, Bateman K, Gatehouse E, Cruzado-Perez J, Pollard D, Lamb V, Juvet F, Kelly D. Assessment of the likelihood of hypothyroidism in dogs diagnosed with and treated for hypothyroidism at primary care practices: 102 cases (2016–2021) J. Vet. Intern. Med. 2024;38:931–41.
[10] Shiel R.E, Sist M, . Nachreiner R.F, Ehrlich C.P, Mooney C.T. Assessment of criteria used by veterinary practitioners to diagnose hypothyroidism in sighthounds and investigation of serum thyroid hormone concentrations in healthy Salukis. J. Am. Vet. Med. Assoc. 2010;236:302–8.
[11] Krogh A.K, Legind P, Kjelgaard-Hansen M, Bochsen L, Kristensen A.T. Exercise induced hypercoagulability, increased von Willebrand factor and decreased thyroid hormone concentrations in sled dogs. Acta. Vet. Scand. 2014;56:11.
[12] Hegstad-Davies R.L, Torres S.M, Sharkey L.C, Gresch S.C, Muñoz-Zanzi C.A, Davies P.R. Breed-specific reference intervals for assessing thyroid function in seven dog breeds. J. Vet. Diagn. Invest. 2015;27:716–27.
[13] Boretti F.S, Reusch C.E. Endogenous TSH in the diagnosis of hypothyroidism in dogs. Schweiz. Arch. Tierheilkd. 2004;146:183–8.
[14] Fine D.M, Tobias A.H, Bonagura J.D. Cardiovascular manifestations of iatrogenic hyperthyroidism in two dogs. J. Vet. Cardiol. 2010;12:141–146.
[15] Tolbert M.K, Ward C.R. Feline thyroid storm: rapid recognition to improve patient survival. Compend. Contin. Educ. Vet. 2010;32:E2.
[16] Potter J.J, Cook J, Meakin L.B. Suspected thyroid storm in a cat anaesthetised for bilateral thyroidectomy. Vet. Rec. Case Rep. 2020;8:e000895.
[17] Merkle J.E, Boudreaux B, Langohr I, Hegler A, Ryan K, Fletcher J. Thyroid storm in a dog secondary to thyroid carcinoma. J. Vet. Emerg. Crit. Care. (San Antonio) 2021;31:428–431.
[18] Budde J.A, McCluskey D.M. 10th. Hoboken, NJ, USA: Wiley-Blackwell; 2018. Plumb’s veterinary drug handbook.
[19] Jackson H, Marsella R. 4th. Quedgeley, UK: BSAVA; 2021. BSAVA manual of canine and feline dermatology.
[20] Baker B.B, Maibach H.I, Park R.D, McFarland L.Z, O’Brien T.R. Epidermal cell renewal in the dog. Am. J. Vet. Res. 1973;34:93–94.