
 | 品种:短毛猫 |
| 年龄:4岁 | |
| 性别:雄 | |
| 诊断:下颌纤维肉瘤 | |
01 主诉及病史
出现嗜睡、食欲不振和流涎等症状。
02 检查
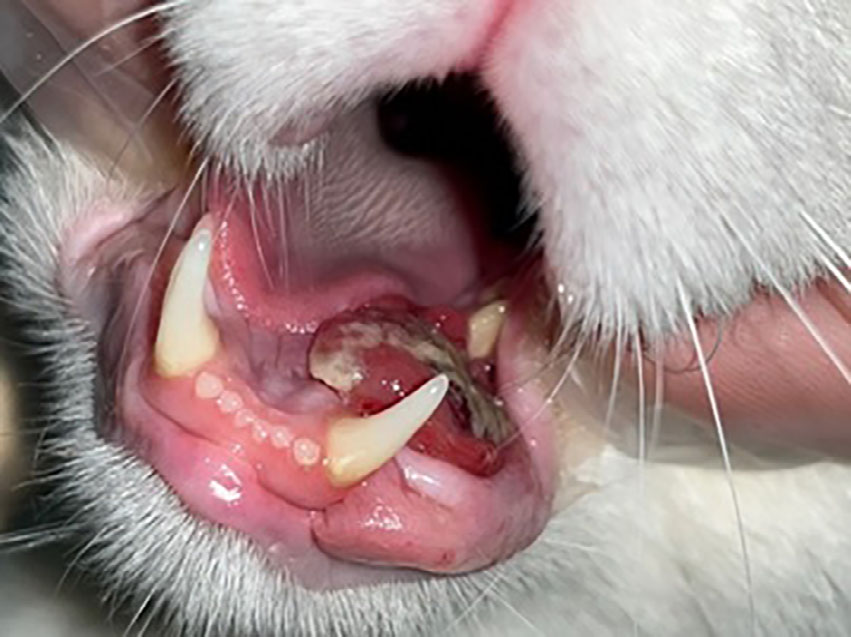
在检查口腔时,发现单侧下颌腹侧肿胀(下图)。
全血细胞计数显示血细胞比容为36% [24-45],血红蛋白120 g/L [120-180]。白细胞16.00×10^3/µL [5.5-19.5]。血涂片中观察到淋巴细胞数量处于低水平。其他异常血液学结果包括严重左移,表明存在急性炎症。
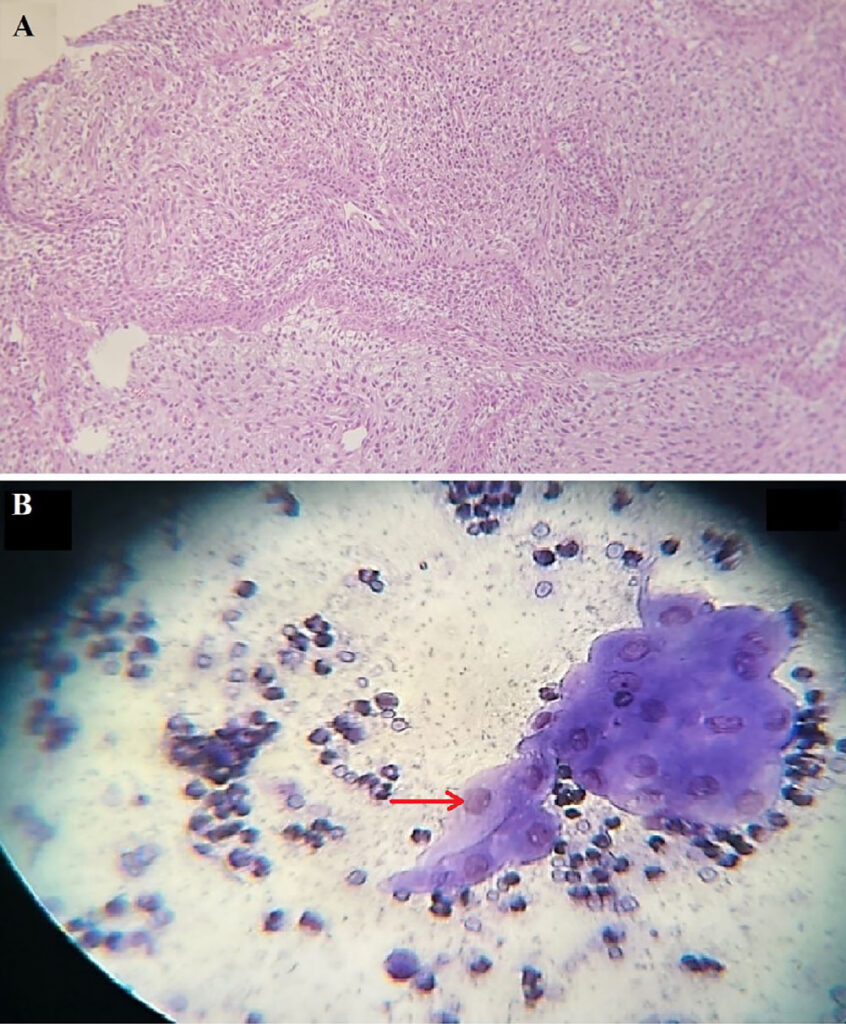
对下颌骨进行了超细针抽吸,在印模涂片中精确地观察到了中性粒细胞和成纤维细胞。细胞学检查显示,多核成纤维细胞明显增多,胞浆嗜碱性,核仁增大或呈角状。有丝分裂图异常,许多多形性细胞和间质细胞也明显存在。成纤维细胞的存在以及细胞大小、形状和细胞核的变化明确显示了肿瘤的恶性程度(下图)。
03 治疗
由于怀疑感染,首先接受了为期5天的辅助治疗,包括头孢曲松(5.5 mg/kg IV)和克林霉素(25 mg/kg IV)。同时还使用了泮托拉唑和甲氧氯普胺(IV和IM给药,1 mg/kg)以及Duphalyte 500 mL(10 mL/kg IV)来缓解恶心和刺激食欲。
治疗5天后,由于病情未见好转,对第304号牙齿进行了根治性切除手术,并切除肿块以进行组织病理学和免疫组化分析。
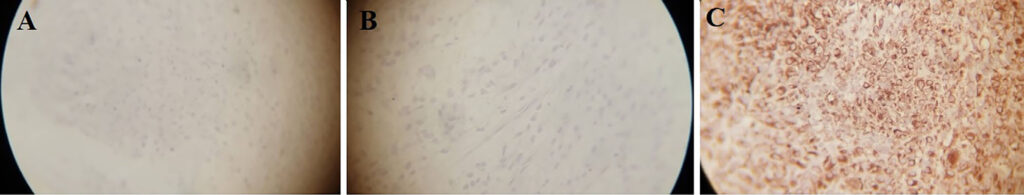
免疫组化结果显示,Desmin的结果两次均为阴性,因此上皮细胞的存在被否定,诊断结果也没有显示鳞状细胞癌(下图A)。S100两次检测结果均为阴性,因此Shwan细胞的存在被否定(下图B)。波形蛋白两次结果呈阳性,显示出许多间质细胞,表明这是一种间质组织肿瘤(下图C)。
04 讨论
猫下颌纤维肉瘤是一种从纤维结缔组织发展而来的肿瘤,具有侵袭性和增殖性,可影响骨骼和软组织[1]。下颌骨肿瘤在猫中很少见。纤维肉瘤是成纤维细胞的恶性肿瘤,成纤维细胞产生胶原结缔组织,但不直接制造骨骼或软骨。
这些肿瘤可侵犯颅骨的任何部位。不过,下颌骨和上颌骨是颅骨纤维肉瘤的常见部位。它们也可能来自皮肤或皮下组织[2]。纤维肉瘤已被确定为猫口腔肿瘤的第二大流行病,占口腔肿瘤的9.8%-17.0%。症状包括面部肿胀、变形或吞咽困难、体重减轻和口臭[3]。
猫下颌纤维肉瘤的治疗通常包括手术切除原发肿瘤,然后进行放疗或化疗[4]。预后因肿瘤的大小、位置和分期而异。定期的兽医检查和监测对检测复发或扩散至关重要[5]。
猫的大部分肿瘤是纤维肉瘤,通常发生在9.6岁左右的猫[6]。猫纤维肉瘤的三种常见类型是自发性单发纤维肉瘤、疫苗注射相关纤维肉瘤和癌基因诱导纤维肉瘤[7]。
纺锤形细胞瘤经常发生在猫的下颌骨。下颌骨肿瘤通常被认为是一种特殊的肿瘤,一般的下颌骨纺锤形细胞肉瘤在猫中并不常见[8]。猫下颌纤维肉瘤多发于中老年猫。
本研究采用免疫组化染色法对波形蛋白、Desmin和S-100进行细胞类型的验证。波形蛋白、Desmin和S100通常被用作间质分化的标志物,在纤维肉瘤中经常表达[9]。
Desmin意味着猫纤维肉瘤可能是一种分化程度较高、预后良好的肿瘤。在本病例中,这种浸润性肿瘤在短时间内就侵犯了单侧下颌骨。本病例Desmin 的免疫组化结果两次均为阴性,因此,上皮细胞的存在被否定,诊断结果也没有显示鳞状细胞癌。根据这种解释,可以考虑不同类型的肿瘤或良性病变。
S100是一种与钙结合的蛋白质,通常与神经肿瘤有关[10]。它在猫纤维肉瘤中的表现可能表明肿瘤更具侵袭性,很可能已经转移。本病例S100两次检测结果均为阴性,因此,Shwan细胞的存在被否定[11]。
波形蛋白的表达与癌症的发展和抗凋亡有关。它可以表明局部侵袭的可能性增加,所需器官转移的风险很高。然而,本研究并未报告猫下颌纤维肉瘤的转移情况。波形蛋白是一种III型中间蛋白,通常在间质肿瘤(如纤维肉瘤)中表达[11]。根据免疫组化染色结果,本病例的波形蛋白标记两次呈阳性,显示出许多间质细胞,表明这是一种间质组织肿瘤[12]。因此,该猫最终诊断为下颌纤维肉瘤。
文献来源:Ahmadi-Hamedani M, Moslemi HR, Khaligh SG, Sedghi M, Sattari K. Clinicopathological, Histopathological, and Immunohistochemical Analysis of Mandibular Fibrosarcoma in a DSH Cat: A Case Report. Vet Med Sci. 2024 Nov;10(6):e70099.
参考文献
[1] Bell, C. , Schwarz M., T., and Dubielzig R. R.. 2011. “Diagnostic Features of Feline Restrictive Orbital Myofibroblastic Sarcoma.” Veterinary Pathology 48: 742–750.
[2] Harvey, A. , Soukup J. W., and Bell C. M.. 2022. “Feline Maxillary Sarcoma: Clinicopathologic Features of Spindle Cell Sarcomas From the Maxilla of 25 Cats.” Journal of Feline Medicine and Surgery 24: e647–654.
[3] Kalluri, R. , and Zeisberg M.. 2006. “Fibroblasts in Cancer.” Nature Reviews Cancer 6: 392–401.
[4] Moore, A. S. , and Moore A. S.. 2009. “Treatment Choices for Oral Cancer in Cats: What Is Possible?” Journal of Feline Medicine and Surgery 11: 23–31.
[5] Dobromylskyj, M. J. , Richards V., and Smith K. C.. 2021. “Prognostic Factors and Proposed Grading System for Cutaneous and Subcutaneous Soft Tissue Sarcomas in Cats, Based on a Retrospective Study.” Journal of Feline Medicine and Surgery 23: 168–174.
[6] Hendrick, M. J. 2016. “Mesenchymal Tumors of the Skin and Soft Tissues.” In Tumors in Domestic Animals, 142–175. Wiley‐Blackwell.
[7] Al Obaid, I. H. 2020. “Soft Tissue Sarcomas: Immunohistochemistry Evaluation by Desmin, Myosin, Smooth Muscle Actin and Vimentin.” Journal of the Faculty of Medicine Baghdad 62, no. 1.2: 20–26.
[8] White, M. E. , Yang C., Hokamp J. A., etal. 2020. “Fibrosarcoma With Sarcomatosis and Metastasis in a FeLV‐negative Cat.” Veterinary Clinical Pathology 49: 143–146.
[9] Donato, R. R. , Cannon B., and Sorci G., etal. 2013. “Functions of S100 Proteins.” Current Molecular Medicine 13: 24–57.
[10] Yousem, S. A. , Colby T. V., and Urich H.. 1985. “Malignant Epithelioid Schwannoma Arising in a Benign Schwannoma. A Case Report.” Cancer 55: 2799–2803.
[11] Hawes, D. , SHI S. R., and Dabbs D. J.. 2009. “Immunohistochemistry.” Modern Surgical Pathology 1: 48–70.
[12] Heim‐Hall, J. , and Yohe S. L.. 2008. “Application of Immunohistochemistry to Soft Tissue Neoplasms.” Archives of Pathology & Laboratory Medicine 132: 476–489.