
| 品种:拉布拉多犬 | |
| 年龄:9岁 | |
| 性别:雌 | |
| 诊断:原发性肺癌 | |
01 主诉及病史
因肺部肿块就诊。
主人注意到持续数周的渐进性咳嗽和运动不耐受。当地进行的胸部X光片检查发现了一个孤立的肺部肿块,还观察到咯血。
02 检查
血流动力学稳定,咳嗽无力。中性粒细胞升高(23.1×10^3个/μL [2.7-9.4]),碱性磷酸酶轻度升高(117 U/L [7-115])。
在右美托咪啶(6μg/kg)和美沙酮(0.2 mg/kg)静脉注射的镇静下,进行了胸部和腹部增强螺旋CT扫描。结果显示,右尾肺叶有一个最大直径为6.5 cm的孤立肺肿块(下图)。
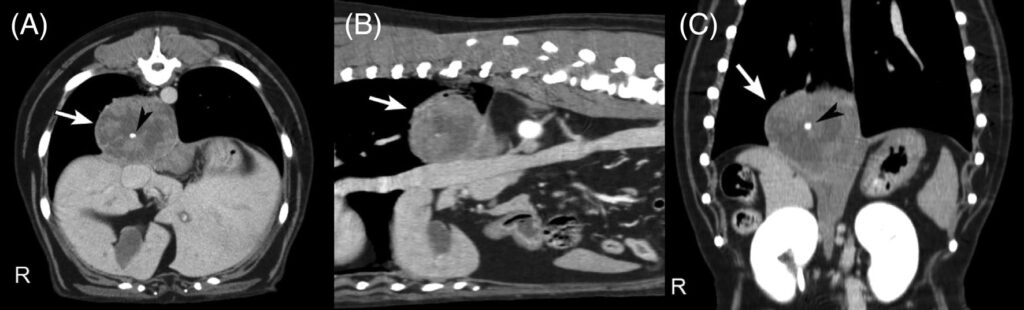
↑ 右尾肺叶肿块(白色箭头)的对比后CT图像显示在软组织窗口中,轴向(a)、矢状(B)和背侧(C)的多平面重建。大的肺部肿块具有不均匀的对比增强,中心有一个小的钙化衰减(黑色箭头)。
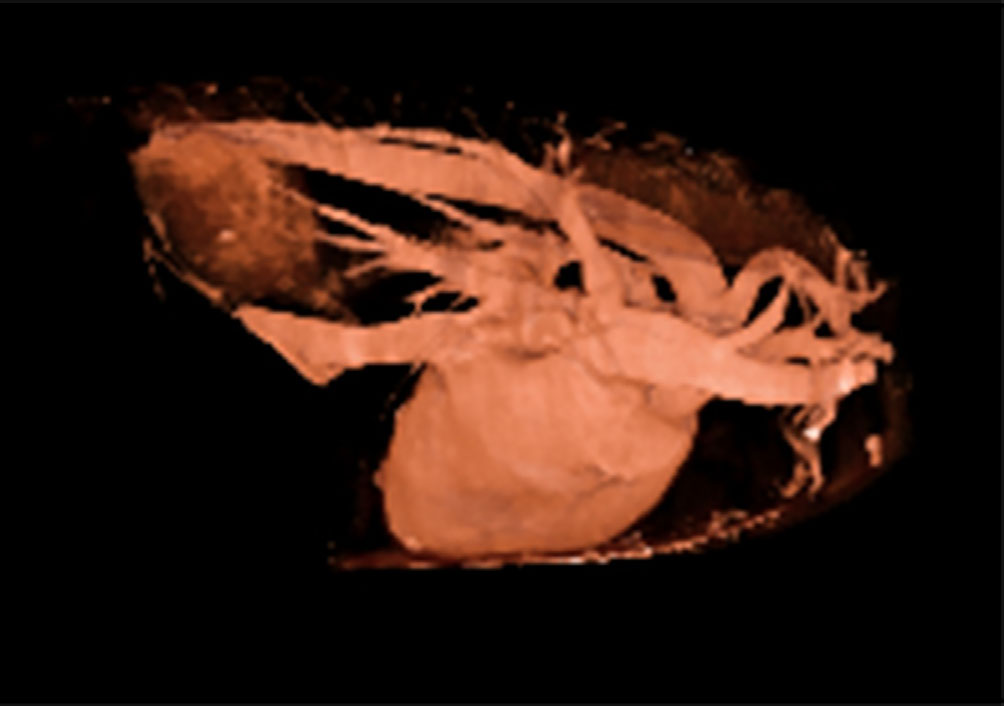
↑ 右尾肺叶肿块的渲染三维图像。
胸骨(1.3×0.6×0.6和1.4×1.0×0.7 cm)和中央支气管(1.2×1.1×1.1 cm)淋巴结轻度肿大,右侧支气管(0.8×0.8×0.7cm)和左侧支气管(1.0×0.9×0.6cm)淋巴结正常(下图)。未发现实质性腹部疾病。
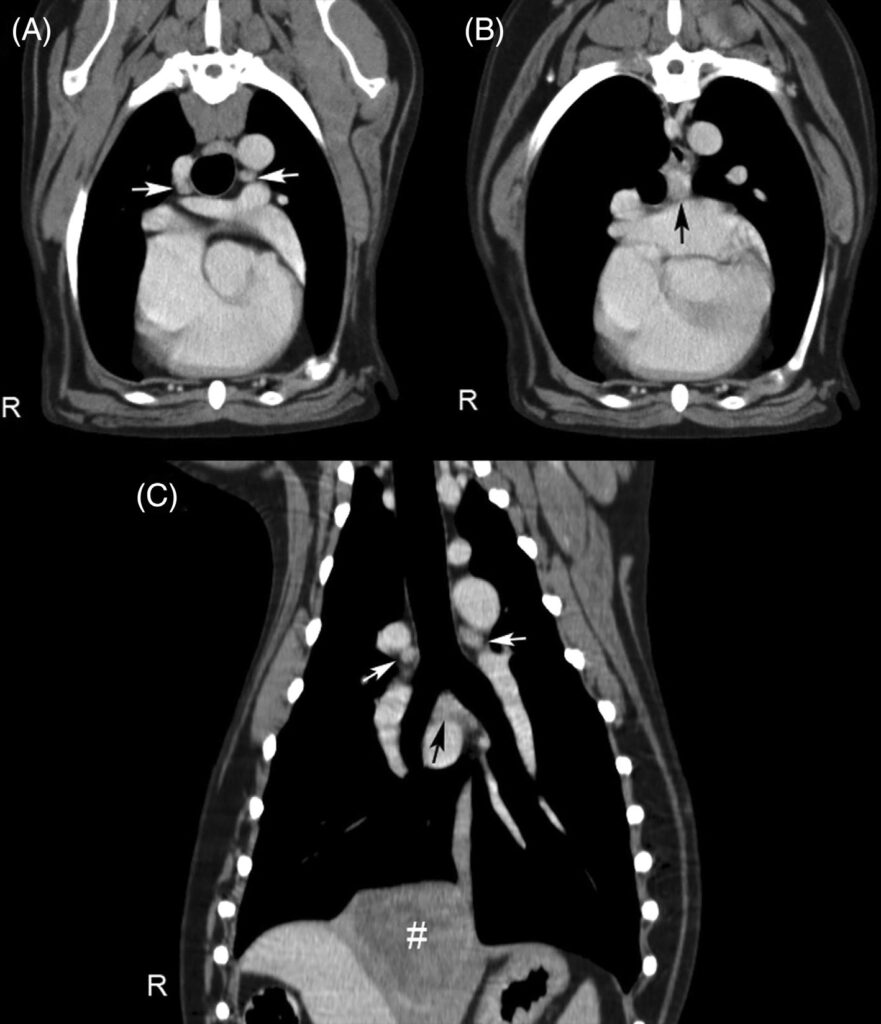
↑ 右、左支气管淋巴结(白色箭头)和中央支气管淋巴节(黑色箭头)的代表性增强后CT扫描图像,轴向(AB)和背侧(C)多平面重建。右侧尾侧肺肿块(#)包含在背侧重建中。
03 治疗
随后,这只狗接受了全身麻醉,进行了电视胸腔镜手术(VATS),包括肺叶切除术和同步前哨淋巴结标记和切除术。
麻醉静脉注射泮托拉唑(1 mg/kg)和马罗吡坦(1 mg/kg)。静脉注射右美托咪啶(10μg/kg)和芬太尼(5μg/kg)。预充氧后,静脉注射氯胺酮(3.3 mg/kg)和丙泊酚(2.6 mg/kg)进行麻醉诱导。放置适当大小的气管内导管后,用100%氧气中的异氟烷维持麻醉,并用氯胺酮、芬太尼和丙泊酚的静脉恒速输注以及静脉等渗晶体维持麻醉。采用无菌技术放置硬膜外导管,并经硬膜外注射总体积为0.2 mL/kg的0.125%罗哌卡因、5μg/mL芬太尼和生理盐水。术前和围手术期每90分钟静脉注射头孢唑林(22 mg/kg)。
左侧斜卧位,通过放置在右侧第四肋间的3个5 mm套管进行胸腔镜入路,以引入5 mm、30°、近红外功能的内镜、钝探头和L形钩单极电外科尖端。通过支气管镜引导在右支气管内放置支气管内阻断剂进行单肺通气。胸腔镜下发现右尾肺叶肿块,用钝头探头将肺叶向腹侧缩回。
单极电切术用于横断右尾肺叶的肺韧带。用22号长针经皮将1 mL 2.5 mg/mL吲哚青绿(ICG)注射到右尾肺叶肿瘤周围组织中,旨在通过胸腔镜引导下的单次注射到紧邻肿块的大体正常肺组织中(下图)。
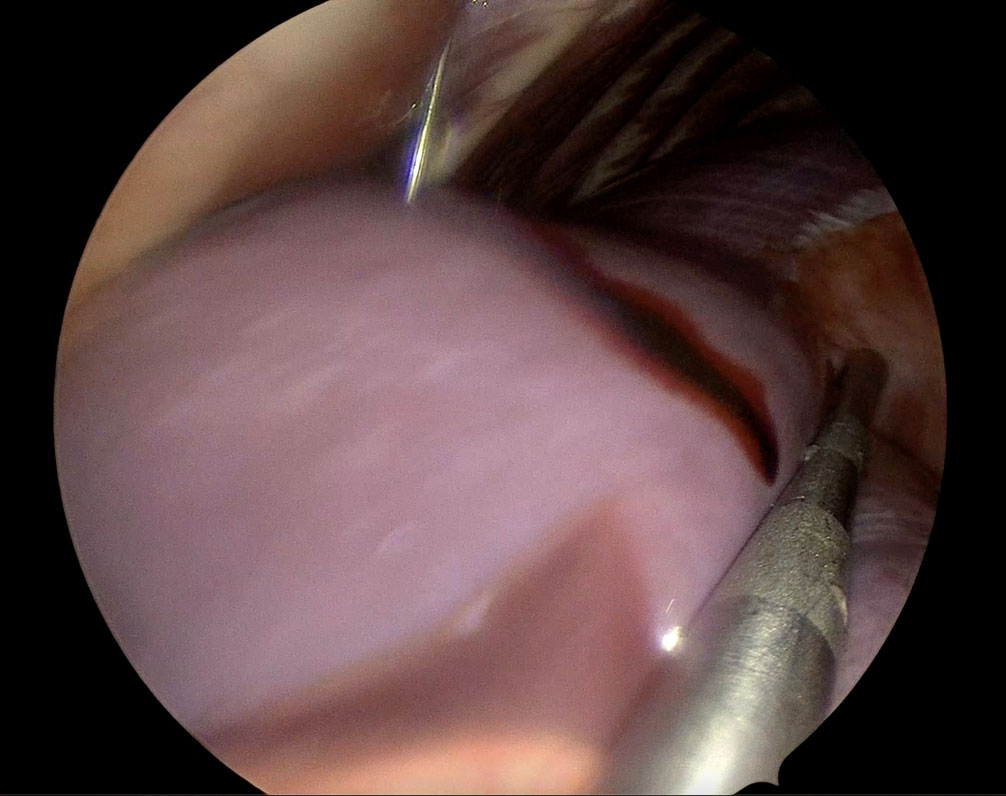
↑ 在胸腔镜引导下,使用22号长针将1 mL吲哚青绿(ICG)经皮注射到右尾侧肺叶的瘤周组织中。在注射过程中,钝探针使右尾侧肺叶稳定在胸壁上。由于单肺通气,肺叶出现肺不张,针刺部位可见少量ICG外渗。
随后,在右侧第6肋间做了一个约8 cm的切口。通过这个切口将伤口牵开器插入胸腔。右尾肺叶被移动,但由于肺肿块较大,在切断肺门之前无法通过伤口牵开器取出。在右尾侧肺门周围穿过一个血管环以隔离和缩回肺门。使用两个棕褐色/血管型60 mm三钉吻合器线性连续地缝合和切断肺门。此后,右尾侧肺叶和肿块被取出。
肺叶切除术后,在瘤周注射ICG约10分钟后,将5 mm内镜插入伤口牵开器,用于对右半胸进行成像。应用可见光上的近红外叠加图像来评估肿瘤周围注射ICG后的荧光淋巴管和淋巴结。右侧气管支气管淋巴结以及进入淋巴结的淋巴管出现荧光(下图)。
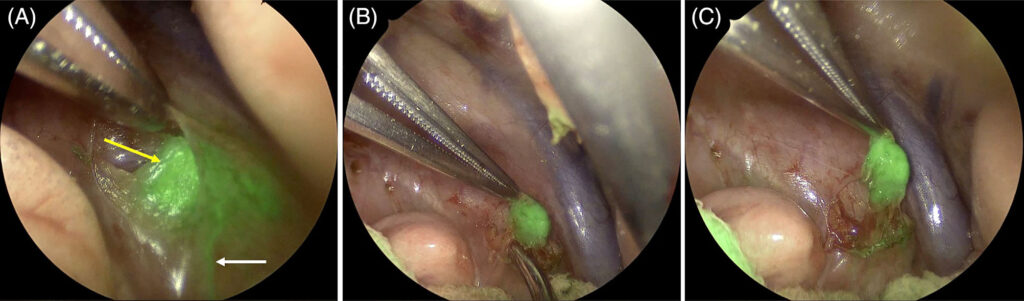
↑ 图像显示右气管支气管淋巴结的荧光(A中黄色箭头)以及进入淋巴结的荧光(A中白色箭头)。(B)和(C)显示了近红外图像引导下从纵隔胸膜深处右侧气管支气管淋巴结。
随后,在视觉和近红外引导下,通过钝性解剖和单极电外科手术切除了该淋巴结。通过胸腔镜辅助的可见光或近红外成像没有发现胸骨淋巴结,通过可见光、触诊或近红外荧光的内镜引导,在纵隔或中央气管支气管淋巴结区域没有发现淋巴结或异常结构。
肺叶切除术或淋巴结摘除部位未观察到出血,用无菌生理盐水和屏气进行的泄漏测试显示没有空气泄漏。取下伤口牵开器和套管。在闭合之前,对胸部进行了灌洗。放置胸廓造口管并将其固定在皮肤上。常规闭合胸腔。将胸廓造口管抽吸至负压。切除的右尾肺叶边缘用墨水标记,所有切除的样本均提交组织学评估。
组织病理学显示,完全切除的1级肺腺癌伴有邻近非肿瘤性化脓性肉芽肿性支气管间质性肺炎,以及右侧气管支气管淋巴结的中度淋巴滤泡增生伴中性粒细胞增多和组织细胞增生。
04 预后
术后,皮下注射卡洛芬(2.2 mg/kg),q6h静脉注射美沙酮(0.2 mg/kg),每天静脉注射晶体液(60 mL/kg),根据需要q8h口服曲唑酮(5mg/kg),根据需要q8h口服加巴喷丁(10 mg/kg)。
术后1天,通气良好,血流动力学稳定,由于胸腔积液和空气排出量低,取下了胸廓造口管。
术后2天,观察到鼻出血和呼吸困难。胸部X光片显示急性、中至重度、头腹型肺实变,优先考虑肺炎,并有肺出血和非心源性肺水肿。全血细胞计数显示轻度非再生性贫血(红细胞压积32% [41-58])、中性粒细胞增多(36.0×10^3/μL)伴左移和血小板减少(110×10^3/μL [186-545])。
生化显示高钠血症(159 mEq/L [143-150])、低钾血症(3.2 mEq/L [4.1-5.4])、高氯血症(125 mEq/L [106-114])、低钙血症(8.3 mg/dL [9.4-11.1])、低白蛋白血症(2.3 g/dL [3.2-4.1])、低血糖(67 mg/dL [68-104])、AST升高(340 U/L [18-56])和高胆红素血症(0.6 mg/dL [0-0.2])。aPTT 17.0秒[11.0-17.5],PT 13.0秒[11.0-15.5],纤维蛋白原829 mg/dL [150-490],抗凝血酶65% [65-145],D-二聚体4502 ng/mL [0-575]。
血栓弹性成像结果如下:组织因子激活反应时间(TF-R)为4.7分钟[3-8],组织因子激活最大振幅为64.6 mm [48-63],组织因素激活α角为67.7°[42-68],组织因数激活运动时间为1.5分钟[2-4],30分钟组织因子激活溶解为0.3% [0-1],运动时间为1.7分钟[1.8-7.8],反应时间为5.8分钟[5-14],组织因子激活的凝块强度为9.1 kdyne/s [4-8],组织因子激活60分钟溶解为2.4% [0-6],最大振幅为66.3 mm [47-60],α角为67.8°[25-65],60分钟溶解率为1.9%。C反应蛋白升高(134.8 mg/L [0-12.0])。
临床症状和贫血恶化,依赖氧气。其他治疗包括q6h静脉注射氨基己酸(100 mg/kg),q8h静脉注射氨苄西林/舒巴坦(30 mg/kg),q24h静脉注射恩诺沙星(10 mg/kg),补充氧气和两次红细胞输注。输血后,心血管状况有所改善,在补充氧气的情况下,保持了正常的氧合。
术后3天,突然昏倒并出现心肺骤停,心肺复苏术未恢复自主循环。主人拒绝了尸检。
05 讨论
狗的原发性肺肿瘤通常是恶性的,具有很高的转移倾向。局部淋巴结是常见的转移部位,淋巴结转移与预后有关[1-4]。因此,建议在狗身上进行肺肿瘤切除时对区域淋巴结进行活检[5,6]。然而,关于在手术时应该对哪些淋巴结进行活检以评估转移情况的数据有限。
在患有原发性肺癌的狗中,确定是否发生了淋巴结转移以及在哪个淋巴结中发生转移具有挑战性,原因如下:(1)区域淋巴结解剖结构和肺部淋巴结引流模式的变化;(2)在CT上确定淋巴结转移的局限性,以及在组织学评估中正常出现的淋巴结可能转移的可能性;(3)由于气管支气管、肺和纵隔淋巴结的尺寸较小且位置靠近关键血管结构,因此在手术中难以识别[4,7,8]。
这些发现强调了对患有肺肿瘤的狗的淋巴结分期进行标准化的必要性,需要可靠的技术来识别和切除第一个引流淋巴结(即前哨淋巴结),以便对患有潜在隐性转移的狗进行组织学评估。
前哨淋巴结(SLN)定位对兽医和人类肿瘤患者的多种肿瘤类型有效[9-11]。在患有癌症的人类中,SLN标记已得到很好的描述,并成功利用了各种术前和术中技术[12-15]。肺SLN标记已在健康犬中进行了研究,作为从人类转化的模型,也可供犬进一步考虑。术前CT淋巴造影、术中闪烁扫描和术中可见染料等技术已被描述用于无肿瘤犬的肺组织[7,16,17]。然而,尚未有关于患有原发性肺肿瘤的狗的SLN标记的报道。
在患有非小细胞肺癌的人类中,SLN标记广泛应用于各种吲哚菁绿(ICG)给药技术,包括瘤周注射ICG,然后进行肺部肿块切除,以及随后对SLN的探查和解剖[15]。因此,在这只狗身上成功地使用了类似的技术。
用于人类非小细胞肺癌的其他术中ICG SLN标记技术包括经支气管注射、封闭注射部位、与白蛋白混合以及在肺肿瘤切除前(但在允许淋巴流到SLN的时间后)对SLN进行解剖[12-14]。各种ICG标记技术的总体准确性在人类肺部肿瘤中的表现非常出色[12]。
在这篇关于肺肿瘤狗的报告中,所描述的技术被证明在识别SLN和指导后续解剖方面是有效的,没有并发症,尽管其他技术也值得进一步评估。对于全胸腔镜肺叶切除术可行的病例,如果在肺叶切除术前有足够的时间(约5-10分钟)让淋巴从肺叶流出,这种技术仍然有效。
总之,利用ICG和近红外成像的术中SLN标记技术可有效识别SLN,并允许在图像引导下进行安全的切除,以便对患有原发性肺腺癌的狗进行后续组织学评估和准确分期。本研究中的VATS技术可以适用于开放式和全胸腔镜手术。未来需要利用SLN标记进行大规模、适当的研究,以确定患有原发性肺肿瘤的狗的淋巴结转移的准确发生率,以及切除隐性/早期转移淋巴结对这些狗的肿瘤预后和辅助治疗适应症的影响。
文献来源:Griffin MA, Todd-Donato AB, Peterson N, Buote NJ. Intraoperative sentinel lymph node mapping with indocyanine green via video-assisted thoracoscopic surgery for primary pulmonary neoplasia in a dog. Vet Surg. 2024 Nov 5.
参考文献
1. Lee BM, Clarke D, Watson M, Laver T. Retrospective evaluation of a modified human lung cancer stage classification in dogs with surgically excised primary pulmonary carcinomas. Vet Comp Oncol. 2020;18(4):590-598.
2. Rose RJ, Worley DR. A contemporary retrospective study of survival in dogs with primary lung tumors: 40 cases (2005–2017). Front Vet Sci. 2020;7:519703.
3. Paoloni MC, Adams WM, Dubielzig RR, Kurzman I, Vail DM, Hardie RJ. Comparison of results of computed tomography and radiography with histopathologic findings in tracheobronchial lymph nodes in dogs with primary lung tumors: 14 cases (1999–2002). J Am Vet Med Assoc. 2006;228(11):1718-1722.
4. McPhetridge JB, Scharf VF, Regier PJ, et al. Distribution of histopathologic types of primary pulmonary neoplasia in dogs and outcome of affected dogs: 340 cases (2010–2019). J Am Vet Med Assoc. 2022;260(2):234-243.
5. Martano M, Boston S, Morello E. Respiratory tract and thorax. In: Kudnig ST, Seguin B, eds. Veterinary Surgical Oncology. 2nd ed. John Wiley & Sons, Inc; 2022:273-328.
6. Culp WTN, Rebhun RB. Pulmonary neoplasia. In: Vail DM, Thamm DH, Liptak JM, eds. Withrow & MacEwen’s Small Animal Clinical Oncology. 6th ed. Elsevier, Inc; 2020:432-448.
7. Tuohy JL, Worley DR. Pulmonary lymph node charting in normal dogs with blue dye and scintigraphic lymphatic mapping. Res Vet Sci. 2014;97(1):148-155.
8. Hermanson JW, De Lahunta A, Evans HE. The lymphatic system. Miller and Evans’ Anatomy of the Dog. 5th ed. Elsevier, Inc; 2020:624-628.
9. Beer P, Pozzi A, Rohrer Bley C, Bacon N, Pfammatter N, Venzin C. The role of sentinel lymph node mapping in small animal veterinary medicine: a comparison with current approaches in human medicine. Vet Comp Oncol. 2018;16(2):178-187.
10. Beer P, Chiti LE, Nolff MC. The role of sentinel node mapping and lymphadenectomies in veterinary surgical oncology. Lymphatics. 2023;1(1):2-18.
11. Liptak JM, Boston SE. Nonselective lymph node dissection and sentinel lymph node mapping and biopsy. Vet Clin Small Anim Pract. 2019;49(5):793-807.
12. Gregor A, Ujiie H, Yasufuku K. Sentinel lymph node biopsy for lung cancer. Gen Thorac Cardiovasc Surg. 2020;68(10):1061-1078.
13. Yamashita S-i, Tokuishi K, Anami K, et al. Video-assisted thoracoscopic indocyanine green fluorescence imaging system shows sentinel lymph nodes in non-small-cell lung cancer. J Thorac Cardiovasc Surg. 2011;141(1):141-144.
14. Stasiak F, Seitlinger J, Streit A, et al. Sentinel lymph node in non-small cell lung cancer: assessment of feasibility and safety by near-infrared fluorescence imaging and clinical consequences. J Pers Med. 2022;13(1):90.
15. Nomori H, Cong Y, Sugimura H. Utility and pitfalls of sentinel node identification using indocyanine green during segmentectomy for cT1N0M0 non-small cell lung cancer. Surg Today. 2016;46:908-913.
16. Nwogu CE, Kanter PM, Anderson TM. Pulmonary lymphatic mapping in dogs: use of technetium sulfur colloid and isosulfan blue for pulmonary sentinel lymph node mapping in dogs. Cancer Investig. 2002;20(7–8):944-947.17. Suga K, Yuan Y, Ueda K, et al. Computed tomography lymphography with intrapulmonary injection of iopamidol for sentinel lymph node localization. Investig Radiol. 2004;39(6):313-324.