
| 品种:短毛猫 | |
| 年龄:3岁 | |
| 性别:雄 | |
| 诊断:毛细线虫感染 | |
01 主诉及病史
消瘦、尿频、呕吐和食欲不振持续1个月。
该猫来自斯里兰卡邦布瓦拉(Bombuwala)。
02 检查
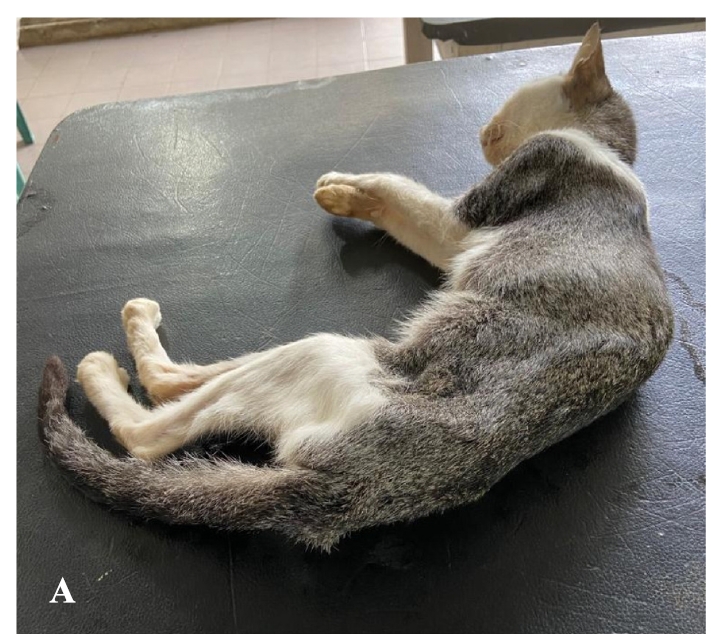
体重1.2千克。严重消瘦,生长迟缓(下图)。体温和心率均未发现异常。但观察到喘息和腹式呼吸。
尿液分析是在无菌条件下直接从膀胱采集尿样进行的。尿液呈黄色,混浊,比重为1.012。尿液pH值呈酸性,蛋白质(+)和尿蛋白原(+)偏低,葡萄糖、酮体和胆红素均为阴性。尿沉渣显微镜检查显示血尿和白细胞呈阴性。还检测到脱落的上皮细胞和尿液结晶。在低倍镜下还观察到许多椭圆形结构,怀疑为毛细线虫虫卵(下图)。尿样中未发现粪便污染。
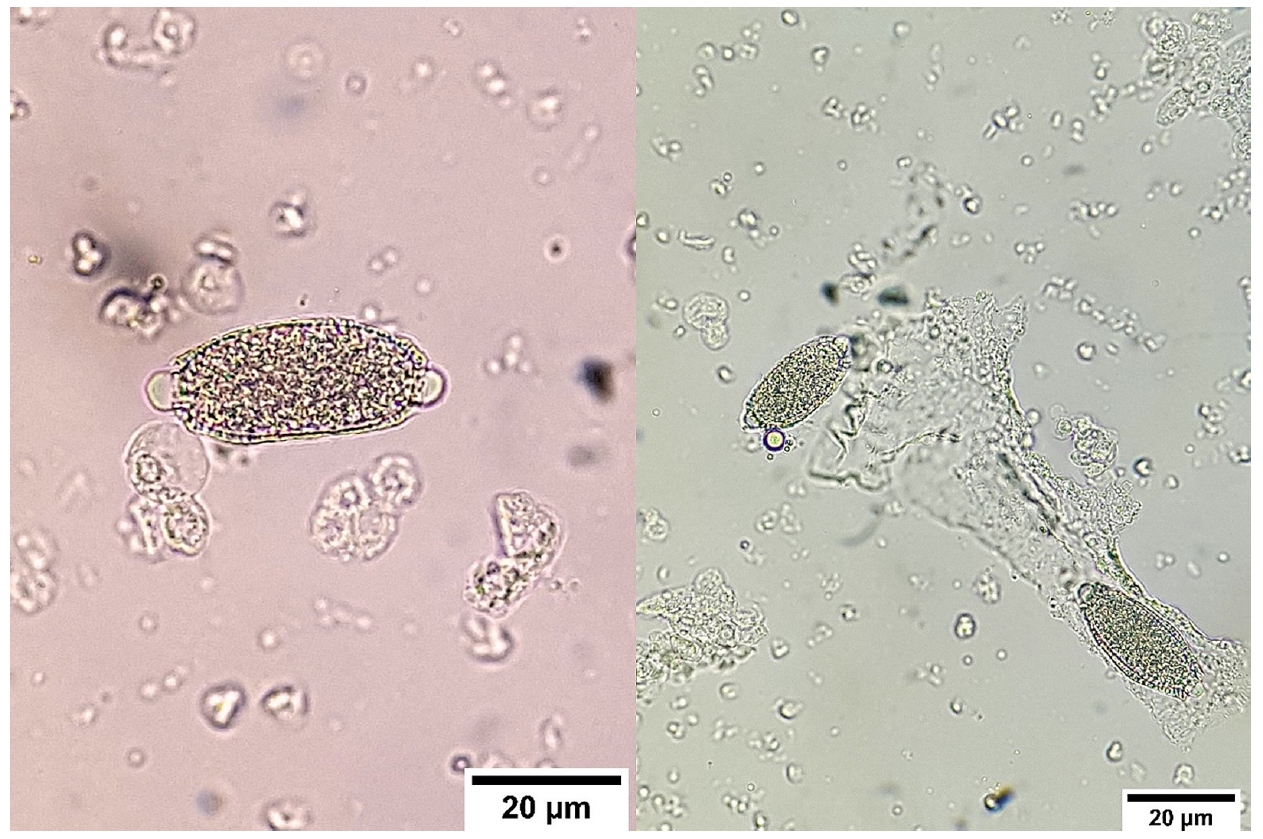
↑ 尿液沉淀物显微照片,显示存在毛细线虫虫卵。卵的形态呈桶状,两头有明显的疙瘩,大小约为50×20 μm。
血尿素氮28.02 mmol/L [1.11-1.67],比正常范围高出15倍以上,血肌酐7.6 mg/dL [0.8-1.8],也高于正常范围。血红蛋白水平和充盈细胞体积略低于参考范围(分别为1.82 g/dL和20%)。白细胞增多(21×10^9/L [5.5-19.5]),血小板计数正常(300-800×10^9/L)。
03 治疗
接受了输液治疗和肾衰竭治疗,并服用了恩诺沙星、盐酸异丙嗪和呋塞米等药物。然而,治疗效果不好。
在治疗的第5天死亡。
04 尸检
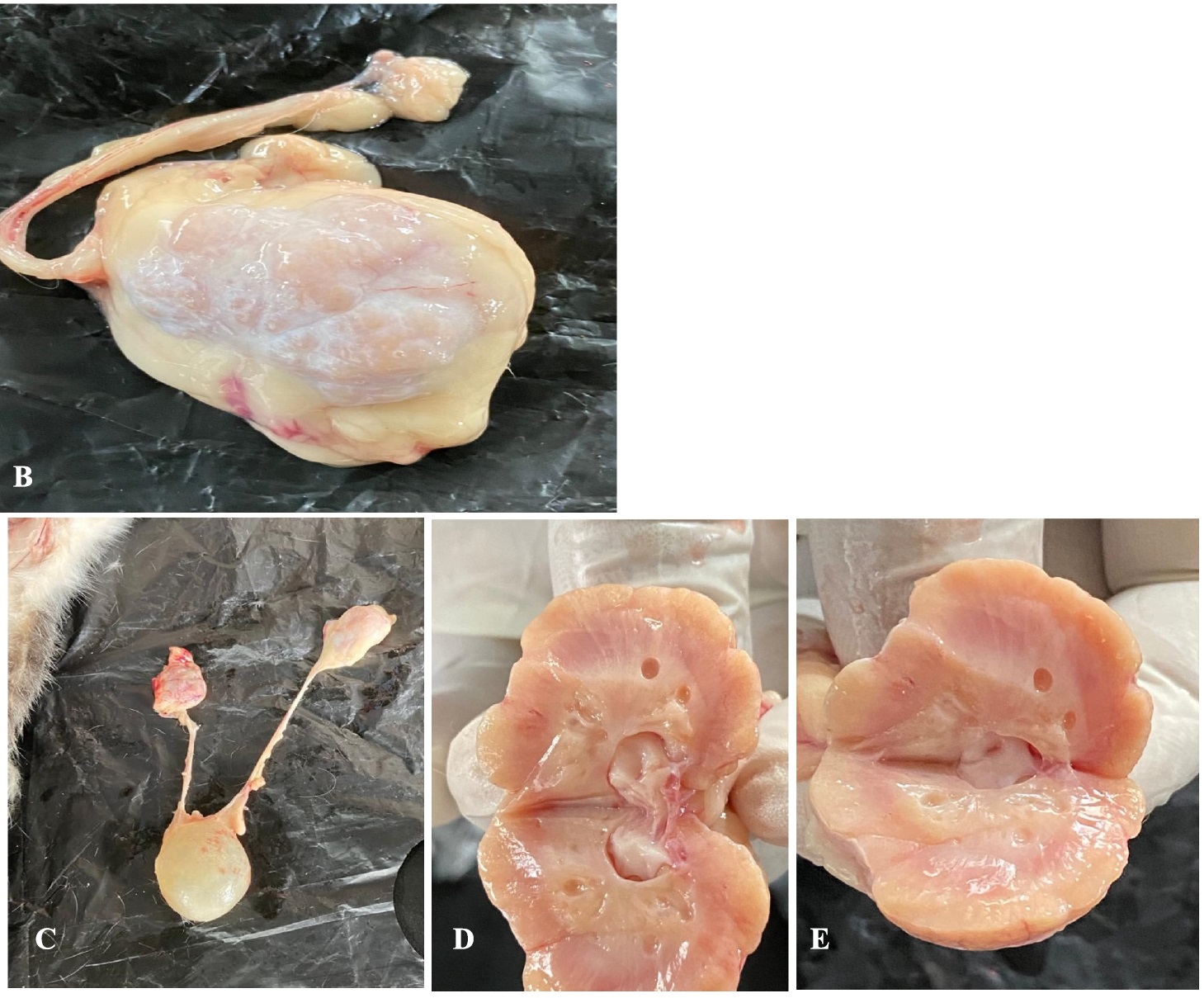
膀胱和泌尿道未见异常,但观察到左肾肿大,肾实质水肿(下图)。
肾实质中可见多灶性肾小管变性和坏死,并伴有成纤维细胞增生(下图AB)。变性区域有中等数量的淋巴细胞浸润(下图C)。远端曲小管偶尔可见嗜酸性粒细胞铸型(下图D)。肺部出现弥漫性肺水肿(下图E)和慢性间质性肺炎,II型肺细胞显著增生(下图F)。
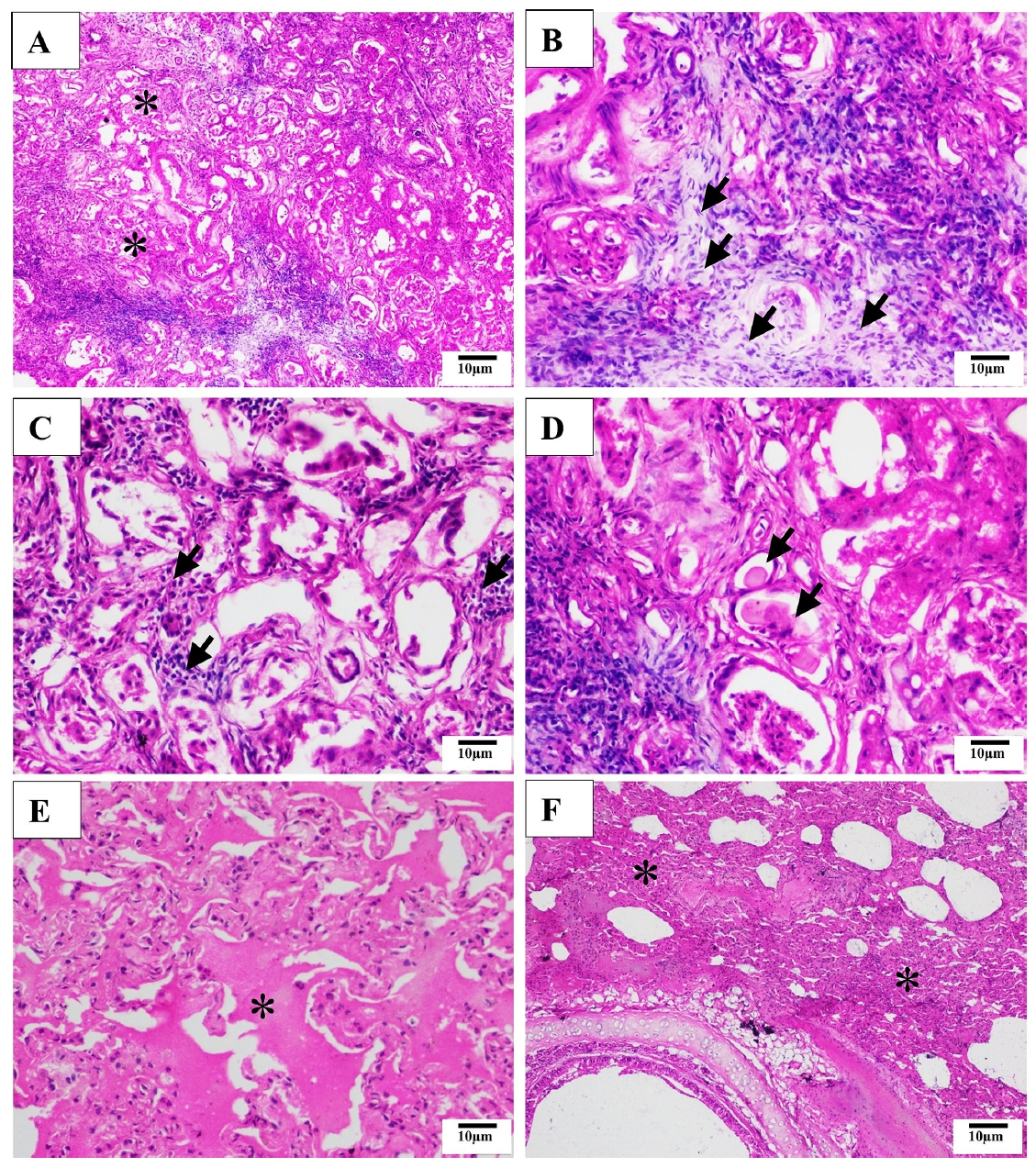
↑ 猫肾脏(A-D)和肺部(EF)的组织学检查。(A)观察到多处肾小管变性和坏死(星号),并伴有纤维化。(B)坏死区域可见纤维母细胞增生和胶原沉积(箭头)。(C)肾间质可见淋巴细胞浸润(箭头)。(D)偶尔可见嗜酸性粒细胞的肾小管铸型。(E)肺部出现弥漫性肺水肿(星号)。(F)肺部出现严重的弥漫性间质性肺炎(星号)。
对虫卵进行了18S rRNA测序,序列与毛细线虫科的Pearsonema属序列的一致率为100%。与Pearsonema plica序列的一致率为99%。上述结果提示该毛细线虫为Pearsonema plica。
05 讨论
伴侣动物(主要是猫、狗)泌尿道中出现线虫的情况很少见,因此被认为是偶然现象。伴侣动物泌尿道感染中的线虫主要有两大类,即毛细线虫科(Capillariidae)和膨结线虫科(Dioctophymatidae)。
毛细线虫科的寄生虫寄生于多种脊椎动物宿主,影响家养和野生犬和猫的泌尿道。它包括两个属:Pearsonema属和毛细线虫属(Capillaria)。Capillaria属成虫的寄生部位可能是胃肠道、呼吸道或膀胱,具体取决于物种[1],因此根据寄生部位的不同,它们被命名为不同的属。
Eucoleus属、Aonchotheca属(和Pearsonema属或大部分毛细线虫属)分别是寄生于呼吸道、胃肠道和泌尿道的寄生虫[2]。Capillaria putorii会感染包括猫在内的哺乳动物的胃和小肠[3]。感染猫和狗呼吸道的物种包括C. aerophila、C. erinacei和C. boehmi[2,4,5]。不过,在粪便而非尿液中检测到毛细线虫虫卵的原因是,寄生在气管支气管上皮的成虫产下的虫卵会被咳出并吞咽,最终进入胃肠道[6]。
在阿尔巴尼亚[7]、巴西[8,9]、意大利[10]和英国[11]的家猫中发现了由Pearsonema plica和C. feliscati引起的膀胱感染。此外,德国野猫[12]、匈牙利红狐[13]和西班牙欧亚獾[14]等其他野生犬科和猫科动物也曾报告过Capillaria spp.引起的膀胱感染。
毛细线虫属的线虫的生命周期因其种类及其在最终宿主中的偏好部位而异。在膀胱寄生虫(即Pearsonema属)的间接生命周期中,虫卵随贮存宿主的尿液排出膀胱后,被作为中间宿主的蚯蚓吃掉。
虫卵在蚯蚓的肠道中孵化,大约一个月后,第一期幼虫(L1)穿过肠壁,在周围的结缔组织中寄生。最终宿主吞食蚯蚓后,L1幼虫在小肠壁内蜕变为L2幼虫。极少数情况下,会在膀胱、输尿管和肾盂中发现L3幼虫,它们是通过血液或淋巴系统迁移的。L4幼虫迁移到最终宿主的膀胱,成虫在此发育[15]。
成虫细长如线,要么外部粘附在膀胱粘膜上,要么浸泡在膀胱粘膜内,因此超声检测具有挑战性[11]。由于猫很少吃蚯蚓,因此猫、蚯蚓与中间宿主的确切关系尚未得到充分认识。既往研究提出,以蚯蚓为食的猫的猎物(如鸟类)可能在猫感染的流行病学中扮演重要的副宿主角色[1]。
在斯里兰卡,淡水鱼[16]、锡兰袋狸、猕猴[17]、狗[18,19]和家鹅[20]中都记录有毛细线虫的存在。早在1955年就报告了斯里兰卡康提地区猫粪便样本中的毛细线虫虫卵,发病率为2.8%。然而,过去在斯里兰卡还没有关于猫泌尿毛细线虫病的报道。
本研究首次记录了斯里兰卡一只猫的泌尿毛细线虫病。尿液分析和组织病理学检查确定了该病的生理学特征。DNA测序结果表明,本研究发现的膀胱蠕虫可能与Pearsonema plica有亲缘关系,但要做出准确的推断,还需要使用其他分子标记物进行进一步鉴定。
既往报告了一只患有泌尿系统毛细线虫病的7岁雌猫,该病伴有冷漠和食欲减退,而血液分析报告显示白细胞减少伴有中性粒细胞减少和淋巴细胞减少[8]。其他报告也提到了猫的泌尿毛细线虫病[1,9,11]。根据这些报告,尿液检测被认为是识别泌尿毛细线虫病的有效方法。
本研究还进行了组织病理学检查。斯里兰卡的大多数猫都是野猫或半家养猫。与狗不同,猫因其狩猎行为而不能被关在笼子里或养在室内。在斯里兰卡的家庭中,即使是驯养的猫也经常捕食蜥蜴、松鼠、蚯蚓等。因此,这些猫极有可能感染毛细线虫。这种疾病在猫中的发病率被低估,因为在斯里兰卡,猫的兽医护理比狗少。
总之,本研究首次记录了斯里兰卡一只猫的泌尿毛细线虫病。尿液分析和组织病理学检查能够准确确定该病的生理学特征。有关猫体内Pearsonema属的分子数据非常稀少,因此需要进一步的研究来填补这一信息空白,并提高人们对这种寄生虫及其引起的疾病的认识。
文献来源:De Silva TK, Wijeratne S, Perera PK, Wijesundera K, Jayaweera WR, Perera V, Rajakaruna RS. First record of feline urinary bladder worm (Capillaria syn. Pearsonema) in Sri Lanka: Clinical, histopathological and molecular characterization. Vet Parasitol Reg Stud Reports. 2024 Nov;56:101117.
参考文献
[1] Bedard, C., Desnoyers, M., Lavall´ee, M.-C., Poirier, D., 2003. Capillaria in the bladder of an adult cat. Canad. Veterin. J.l/La revue v´et´erinaire canadienne 43, 973–974.
[2] Macchioni, F., Chelucci, L., Guardone, L., Mignone, W., Prati, M.C., Magi, M., 2013. Calodium hepaticum (Nematoda: Capillaridae) in a red fox (Vulpes vulpes) in Italy with scanning electron microscopy of the eggs. Folia Parasitol. 60, 102–104.
[3] Guardone, L., Deplazes, P., Macchioni, F., Magi, M., Mathis, A., 2013. Ribosomal and mitochondrial DNA analysis of Trichuridae nematodes of carnivores and small mammals. Vet. Parasitol. 197, 364–369.
[4] Collins, G.H., Charleston, W.A., 1972. Collins, G.H., Charleston, W.A. 1972. Letter:Ollulanus tricuspisandCapillaria putoriiin New Zealand cats. N Z Vet J. 20 (5), 82.
[5] Di Cesare, A., Castagna, G., Otranto, D., Meloni, S., Milillo, P., Latrofa, M.S., Paoletti, B., Bartolini, R., Traversa, D., 2012. Molecular detection ofCapillaria aerophila, an agent of canine and feline pulmonary capillariosis. J. Clin. Microbiol. 50, 1958–1963.
[6] Holmes, P.R., Kelly, J.D., 1973. Capillaria aerophila in the domestic cat in Australia. Aust Vet J. 49 (10), 472–473.
[7] Knaus, M., Shukullari, E., Rosentel, J., Rehbein, S., 2014. Efficacy of a novel topical combination of fipronil,(S)-methoprene, eprinomectin and praziquantel against feline urinary bladder worm (Capillaria plica) infection. Vet. Parasitol. 202, 45–48.
[8] Guimar˜aes, A., Aguilera, V.C., Gomes, D.P., Zanesco, E.V., Oliveira, ´A.F., Stocco, N.V., Andrade, G.F., Souza, N.C., Souza, H.J., Baldani, C.D., 2020. Urinary capillariosis in a cat from Rio de Janeiro, Brazil-clinical, morphological and phylogenetic characterization. Veterin. Parasitol. Region. Stud. Rep. 20, 100409.
[9] Pagnoncelli, M., França, R.T., Martins, D.B., Howes, F., dos Anjos Lopes, S.T., Mazzanti, C.M., 2011. Capillaria sp. in a cat. Acta Sci. Vet. 39, 1–3.
[10] Rossi, M., Messina, N., Ariti, G., Riggio, F., Perrucci, S., 2011. SymptomaticCapillaria plicainfection in a young European cat. J. Feline Med. Surg. 13, 793–795.
[11] Whitehead, M., 2009. Urinary capillariosis in a cat in the UK. Vet. Rec. 165, 757.
[12] Krone, O., Guminsky, O., Meinig, H., Herrmann, M., Trinzen, M., Wibbelt, G., 2008. Endoparasite spectrum of wild cats (Felis silvestris Schreber, 1777) and domestic cats (Felis catusL.) from the Eifel, Pfalz region and Saarland, Germany. Eur. J. Wildl. Res. 54, 95–100.
[13] Sr´eter, T., Sz´ell, Z., Marucci, G., Pozio, E., Varga, I., 2003. Extraintestinal nematode infections of red foxes (Vulpes vulpes) in Hungary. Vet. Parasitol. 115, 329–334.
[14] Torres, J., Miquel, J., Motj´e, M., 2001. Helminth parasites of the Eurasian badger (Meles melesL.) in Spain: a biogeographic approach. Parasitol. Res. 87, 259–263.
[15] Del-Angel-Caraza, J., Quijano-Hern´andez, I.A., Soriano-Vargas, E., Barbosa-Mireles, M. A., Martínez-Casta˜neda, J.S., 2018. Urinary bladder worm (Pearsonemasp.) infection in domestic dogs and cats in Mexico at a high altitude. Parasitol. Res. 117, 1979–1983.
[16] Thilakaratne, I., Rajapaksha, G., Hewakopara, A., Rajapakse, R., Faizal, A., 2003. Parasitic infections in freshwater ornamental fish in Sri Lanka. Dis. Aquat. Org. 54, 157–162.
[17] Thilakarathne, S.S., Rajakaruna, R.S., Fernando, D.D., Rajapakse, R., Perera, P.K., 2021. Gastro-intestinal parasites in two subspecies of toque macaque (Macaca sinica) in Sri Lanka and their zoonotic potential. Veterin. Parasitol. Region. Stud. Rep. 24, 100558.
[18] Perera, P., Rajapakse, R., Rajakaruna, R., 2013. Gastrointestinal parasites of dogs in Hantana area in the Kandy District. J. Natl. Sci. Found. 41.
[19] De Silva, T.K., Rajakaruna, R.S., Mohotti, K.M., Rajapakse, R., Perera, P.K., 2022. First molecular identification of Ancylostoma species in dogs in a rural tea Estate Community in Sri Lanka and the detection of other zoonotic gastro-intestinal parasites. Acta Parasitol. 67, 1086–1096.[20] Fernando, S., Jayasinghe, J., 1963. Methyridine as an anthelmintic forHeterakisspp. andCapillariaspp. in domestic geese. Ceylon Veterin. J. 11, 97–98.