
| 品种:短毛猫 | |
| 年龄:5岁 | |
| 性别:雌 | |
| 诊断:诺卡氏菌感染 | |
01 主诉及病史
经历了两个月的间歇性发热和食欲不振及厌食。
居住在澳大利亚首都堪培拉,是家里唯一的宠物,与其他动物没有接触。主要生活在室内,有室外通道。接种了最新的疫苗和抗寄生虫药物,吃商业干湿混合食品。
1个月前,在当地兽医处接受了剖腹探查和活组织检查,发现化脓性肉芽肿性肠系膜脂膜炎伴Splendore-Hoeppli物质、轻度淋巴浆细胞性胆管炎和混合性回肠炎。手术期间发现右肾表面回肠结肠淋巴结肿大和坚固的线状束。在肠系膜的组织病理学切片中可见革兰氏阳性球菌,而在血琼脂上有氧培养时,液体吸出物没有菌落生长。猫免疫缺陷病毒(FIV)和猫白血病病毒(FeLV)检测呈阴性。
除轻度高球蛋白血症(59 g/L [28-51])外,轻度贫血(0.27 L/L [0.303-0.523]),中性粒细胞增多(17.69×10^9/L [2.30-10.29]),单核细胞增多(0.88 × 10^9/L [0.05-0.67])。尽管使用阿莫西林克拉维酸(14 mg/kg PO BID)、马博沙星(12.5 mg/只PO SID)和米氮平(2 mg PO QD)治疗,但临床症状仍然存在。
02 检查
脱水10%,体况评分5/9,发热(直肠温度39.1°C),粘膜苍白,收缩压125 mmHg。
严重的氮质血症(肌酐853μmol/L [68-167];尿素30.5 mmol/L [4.3-11.7])、高磷血症(3.35 mmol/L [0.8-1.9])和高胆红素血症(13.7μmol/L [0.2-4.2])。
非再生性贫血(0.22 L/L [0.30-0.45]),网织红细胞计数0.0046×10^12/L,中性粒细胞增多(20.33×10^9/L [1.88-10.26])和单核细胞增多(0.69×10^9/L [0.00-0.62])。
胸部X线正常。腹部超声显示,腹膜后内侧髂淋巴结水平有一个低回声、轻度不均匀的血管肿块(6.4×2.6×2.2 cm),边缘不规则,肿块头部有一个高回声的管状结构(下图)。右输尿管与该肿块密切相关,左右肾盂均扩张,伴有突出的肾憩室。脾脏尾缘附近有第二个低回声区域(0.7×0.8 cm),边缘不规则,血流可疑。目前尚不清楚扩张的管状结构是脓肿还是扩张的输尿管。腹膜回声普遍增加,少量无回声腹腔积液。
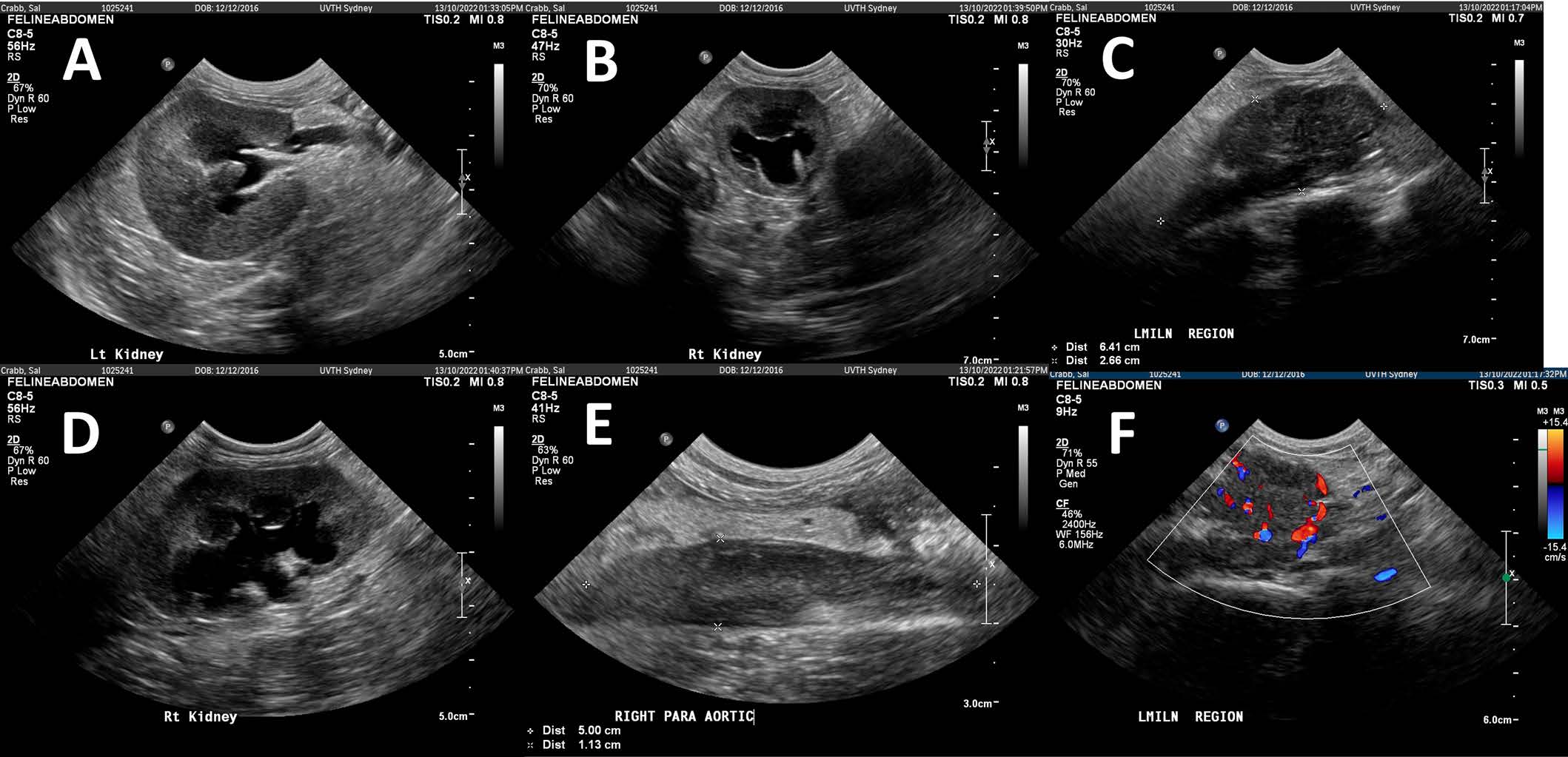
↑ (A)左肾横断面图,显示肾盂扩张,憩室突出。(B)右肾横断面图,显示肾盂明显扩张,憩室突出,输尿管近端扩张。(C)左髂内淋巴结水平腹膜后肿块的纵向视图。(D)右肾纵切面显示肾盂明显扩张,憩室突出,输尿管近端扩张。(E)腹膜后肿块的低回声管状结构。(F)彩色多普勒超声显示腹膜后肿块的血管化。
03 治疗及预后
这只猫被认为患有由腹膜后肿块压迫引起的双侧输尿管梗阻。该肿块疑似与之前发现的化脓性肉芽肿性炎症有关,并怀疑为感染引起。
与主人讨论了放置临时肾造瘘管、皮下输尿管旁路装置或输尿管支架以及更有针对性的抗菌治疗。然而,由于所有选择都存在潜在的并发症,考虑到可能与尚不清楚的病原体感染有关,再加上经济条件的限制,主人选择了安乐死。
04 尸检
粘膜苍白,有一个6厘米长的愈合良好的腹部中线切口,腹侧腹部和左后肢的皮下组织有中度水肿。腹腔内约有5 mL薄而浑浊的红色液体,一些肠环的浆膜表面被纤维蛋白线粘附在腹壁上。
与左肾(4.2×2.5×1.9 cm)相比,右肾略有增大(4.5×3.5×2.5 cm),右肾盂中度扩张,髓质萎缩。左肾盂轻度扩张。左、右近端输尿管中度扩张,穿过腹膜后肿块。
腹膜后肿块约4.0×3.5×3 cm,形状不规则,呈分叶状,灰白色,牢固,与下方的肌肉组织粘附(下图)。切开后渗出少量绿色或黄色的粘稠不透明液体。膀胱是空的。肠系膜淋巴结中度增大(3.7×1.0×0.6 cm)。空肠和回肠的远端部分牢固地粘在一起形成一个环(可能为之前的手术活检部位)。
↑ (A)腹膜后肿块(箭头)的位置。注意双侧输尿管近端扩张和输尿管穿过肿块。膀胱标有星号。(B)肾脏、输尿管和膀胱的大体图像,显示右肾中度肾盂积水(左侧),腹膜后肿块碎片牢牢粘附在两根输尿管上。
尸检时对腹膜后肿块进行了细针穿刺,并用DiffQuik染色,显示大量退化的中性粒细胞、巨噬细胞和偶尔染色阳性的链状杆菌簇(下图)。
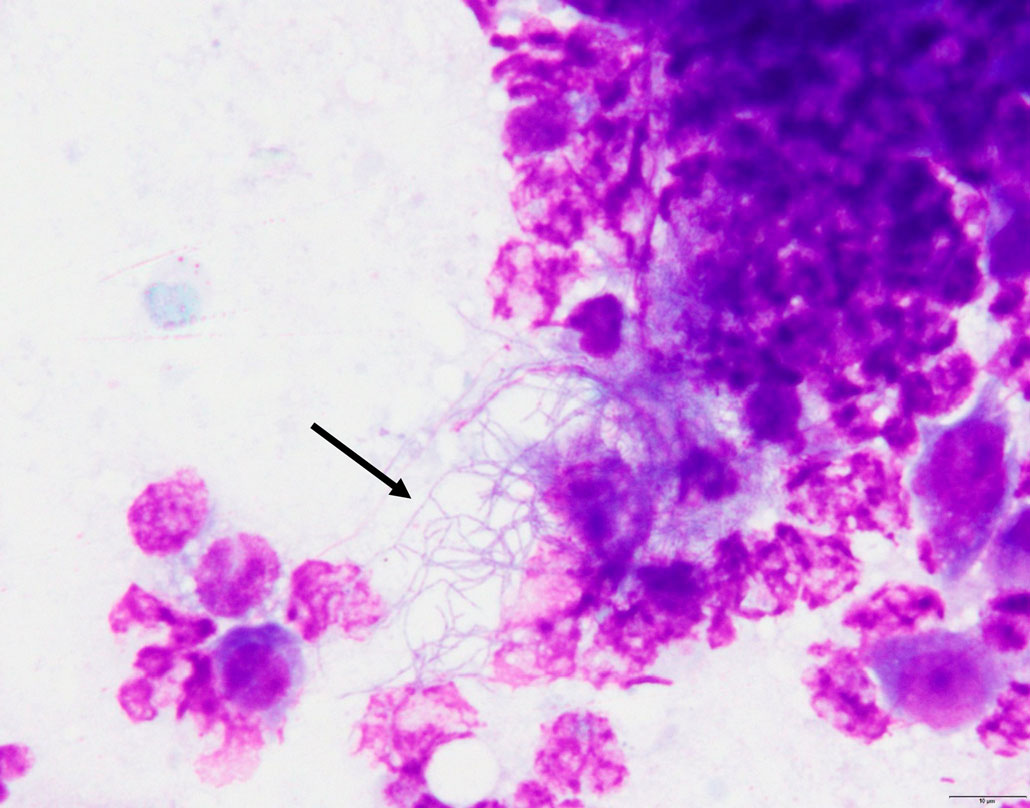
↑ 细胞学显示,中性粒细胞、巨噬细胞和丝状分支呈阳性染色的链状杆菌(箭头)。
在组织病理学检查中,腹膜后肿由明显的化脓性肉芽肿炎症和纤维化组成(下图)。炎症细胞主要由巨噬细胞和中性粒细胞组成,浆细胞和淋巴细胞较少,淋巴细胞有时会聚集成泡。炎症区域周围有大量的纤维胶原。整个肿块中经常出现嗜酸性圆形结构,周围有放射状嗜酸性物质(Splendore-Hoeppli现象)。圆形结构中包含的革兰氏阳性细丝数量从少到多不等。丝状细菌在标准Ziehl-Neelsen染色中不耐酸,但在改良的Wade-Fite技术中耐酸。肿块中偶尔还含有脂肪细胞、罕见的小神经、不同数量的坏死细胞碎片和水肿液,以及小面积出血。
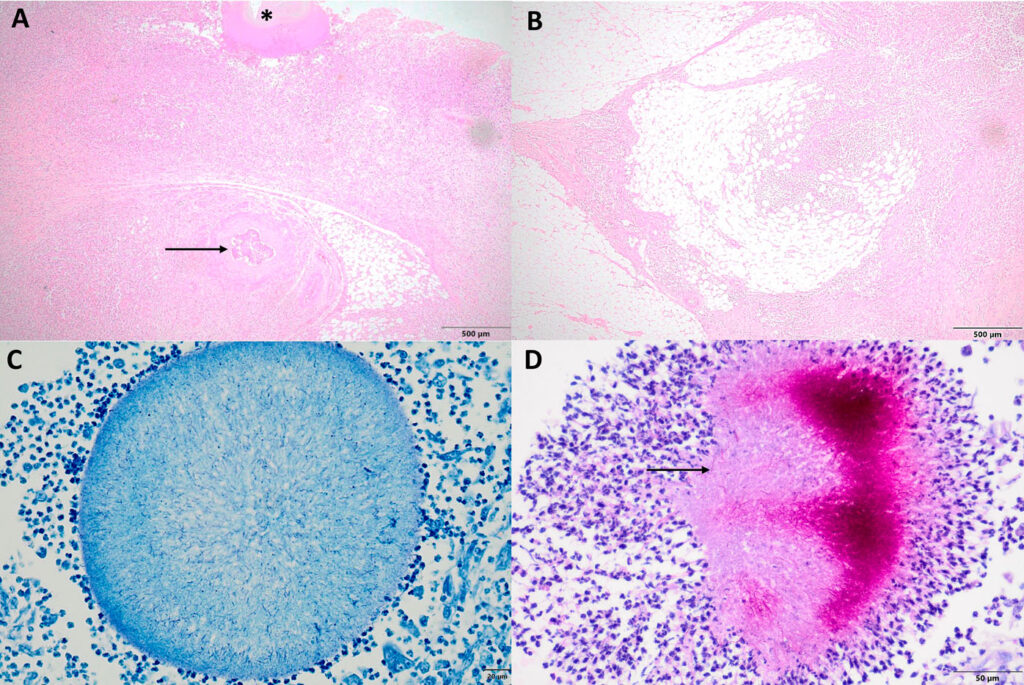
↑ (A)显示输尿管嵌顿(箭头)和Splendore-Hoeppli现象(星号)。(B)腹膜后脂肪组织浸润的脓毒症炎症和纤维化。(C)没有抗酸细菌。(D)抗酸丝状菌的存在。
其他组织病理学发现包括胸骨淋巴结的化脓性肉芽肿性淋巴结炎、淋巴增生、轻度至中度腹膜炎、轻度淋巴细胞性膀胱炎、轻度双侧淋巴浆细胞间质性肾炎,伴有右肾肾小管扩张,以及轻度淋巴浆细胞门静脉肝炎。
尸检时,从腹膜后肉芽肿内部取出拭子进行培养,在有氧条件下于28°C的血琼脂上培养24小时,观察到轻度生长,并通过MALDI-TOF质谱鉴定出代表性菌落为巴西诺卡氏菌(Nocardia brasiliensis)。
Kirby-Bauer药敏试验显示对阿莫西林/克拉维酸、庆大霉素、甲氧苄啶/磺胺、替卡西林/克拉维甲酸、阿米卡星和亚胺培南敏感,对红霉素中度敏感,对氨苄西林、多西环素、万古霉素和利福平耐药。
05 讨论
诺卡氏菌(Nocardia)是一组革兰氏阳性丝状细菌,属于需氧放线菌[1,2],在人和动物中可引起化脓性肉芽肿感染[3]。这些细菌是普遍存在的腐生菌,在环境中广泛存在,通常在土壤中。人或动物感染通常与意外接触有关(如穿透性创伤),通常与免疫功能低下的宿主有关[4]。
这些细菌不是共生菌,但可以通过机械方式转移到爪子或皮肤上,例如在猫抓伤后[3]。澳大利亚猫中报告的大多数诺卡氏菌感染,主要来自新南威尔士州,已被归类为Nocardia nova[5]。
在世界各地的猫中发现了其他种,包括美国一只猫的巴西诺卡氏杆菌(N. brasiliensis)[3,6]。N. brasiliensis是一种常见的诺卡氏菌,可导致人类的皮肤和皮下疾病,在美国西南部、中美洲和南美洲以及澳大利亚某些地区更为常见[3]。据报道,N. brasiliensis也是一只澳大利亚狗皮肤诺卡氏菌病的病因[7]。
猫的诺卡氏菌感染最常见的表现是皮肤伤口有脓肿和/或窦道,或不太常见的呼吸系统受累或播散性疾病[5,8]。局部腹腔内诺卡氏菌病在人和动物中都不常见[9,10],只有少数人类腹膜后诺卡氏菌病的报告,通常与免疫抑制和腹膜透析或肾移植有关[11]。
大多数情况下,感染途径被认为是由于肺部或经皮接种后的血液传播,或直接穿透腹部[11]。组织学上,诺卡氏菌感染的特征是结节状至弥漫性化脓性肉芽肿性炎症[12]。生物体偶尔会被Splendore-Hoeppli反应包围,代表辐射性强的嗜酸性物质,由抗体-抗原复合物和炎性细胞碎片组成,通常与某些微生物感染或异物有关[13]。
本病例感染的腹膜后位置导致两条输尿管不同程度的压迫,从而导致继发性肾盂积水和肾后氮质血症。尽管偶尔有报告称输尿管梗阻继发于感染性和炎性疾病,特别是狗的播散性真菌感染和人的结核病[16-18],但在许多情况下,梗阻是管腔内的,因为血液传播到肾脏并随后发生输尿管下行感染,而不是因为管腔外压迫。
总之,本病例代表了一种罕见的猫诺卡氏菌感染,发生在免疫功能正常的猫身上,感染部位累及腹膜后间隙,导致输尿管梗阻和继发性肾盂积水。由于培养微生物的困难、感染的异常表现和不确定的发病机制,死前没有得到明确的诊断,这突显了了解致病机制以进行有效诊断和治疗的重要性。
文献来源:Lee K, Pritchard E, Donahoe SL, Malik R, Krockenberger M. Retroperitoneal granuloma in a cat caused by Nocardia brasiliensis resulting in bilateral ureteral entrapment and unilateral hydronephrosis. Aust Vet J. 2024 Oct 12.
参考文献
1. Conville PS, Brown-Elliott BA, Smith T et al. The complexities of Nocardia taxonomy and identification. J Clin Microbiol 2018; 56:e01419–17.
2. Salinas-Carmona MC. Nocardia brasiliensis: from microbe to human and experimental infections. Microbes Infect 2000; 2: 1373–1381.
3. ES Jane, editor. Chapter 43–Nocardiosis. In: Canine and feline infectious diseases. W.B. Saunders, Saint Louis, 2014; 409–417.
4. Mochon AB, Sussland D, Saubolle MA. Aerobic Actinomycetes of clinical significance. Microbiol Spectr 2016; 4.
5. Malik R, Krockenberger MB, O’Brien CR et al. Nocardia infections in cats: a retrospective multi-institutional study of 17 cases. Aust Vet J 2006; 84: 235–245.
6. Ajello L, Walker WW, Dungworth DL et al. Isolation of Nocardia brasiliensis from a cat with a review of its prevalence and geographic distribution. J Am Vet Med Assoc 1961; 138: 370–376.
7. Siak MK, Burrows AK. Cutaneous nocardiosis in two dogs receiving ciclosporin therapy for the management of canine atopic dermatitis. Vet Dermatol 2013; 24(453–456): e102–e453.
8. Intrieri JM, de Almeida GPS, Bonfim IV et al. Pyothorax caused by Nocardia sp. in a cat–case report. Braz J Vet Med 2023; 45:e005522.
9. Mund GM, Häußler TC, Aurich SH et al. Successful treatment of peritoneal nocardiosis caused by Nocardia paucivorans in a dog. N Z Vet J 2021; 69: 355–360.
10. Tilgner SL, Anstey SI. Nocardial peritonitis in a cat. Aust Vet J 1996; 74: 430–432.
11. Tramèr L, Mertz KD, Huegli R et al. Intra-abdominal Nocardiosis-case report and review of the literature. J Clin Med 2020; 9: 9.
12. Faccin M, Wiener DJ, Rech RR et al. Common superficial and deep cutaneous bacterial infections in domestic animals: a review. Vet Pathol 2023; 60: 796–811.
13. Gopinath D. Splendore-Hoeppli phenomenon. J Oral Maxillofac Pathol 2018; 22: 161–162.
14. Combs M, Decker A, Young P et al. Grass seed foreign body-related disease in dogs and cats: a wide spectrum of clinical presentations. Austr Vet Pract 2017; 47: 13–24.
15. Kil EH, Tsai CL, Kwark EH et al. A case of nocardiosis with an uncharacteristically long incubation period. Cutis 2005; 76: 33–36.
16. Bianchi MV, Laisse CJM, Vargas TP et al. Intra-abdominal fungal pseudomycetoma in two cats. Rev Iberoam Micol 2017; 34: 112–115.
17. Acierno MM, Ober CP, Goupil BA et al. Ureteral obstruction secondary to disseminated penicilliosis in a German shepherd dog. Can Vet J 2016; 57: 1242–1246.18. Matsui K, Furumoto A, Ohba K et al. Use of corticosteroids for urinary tuberculosis patients at risk of developing ureteral obstruction. Intern Med 2016; 55: 3539–3542.