
| 品种:拉布拉多犬 | |
| 年龄:6岁 | |
| 性别:雄 | |
| 诊断:牙本质发育不全 | |
01 主诉及病史
恒牙表面变色,磨损严重。
在8周大时从一窝10只幼犬中被挑选出来领养。领养后不久的检查显示牙齿和身体健康。7个月大时,发现乳牙延迟脱落,其中一颗乳牙犬齿出现复杂的牙冠断裂。10个月大时,乳牙完全脱落,恒牙透光度异常。
其他方面发育正常,15个月大时,发现明显的牙齿磨损。由于没有出现明显口腔不适,主人决定不治疗,每隔6个月监测牙髓暴露情况。开始进食软食,不鼓励咀嚼硬物和玩具。
牙齿磨损情况不断恶化,5岁时出现了口腔不适,包括咀嚼硬质食物时疼痛、偏爱软质食物、不愿喝水、不愿参加日常活动和与其他狗玩耍。口腔检查发现牙本质严重脱落,牙齿变色。建议转诊至牙科。
02 检查
身体状况良好,体重24.5千克,全身体格检查无异常。
口腔检查发现所有牙齿都有严重磨损。暴露的牙本质呈琥珀棕色。有些牙齿磨损到了龈缘的水平。牙结石中度堆积,没有牙周炎迹象。左下颌第二门齿(302)和右下颌第一门齿(401)缺失,其他牙齿完整,咬合正常。
全麻下的口腔检查(下图)显示,右上颌第四前磨牙(108)和右下颌第一磨牙(409)有两个窦道。轻度牙龈炎,牙周探诊深度无异常,软组织无其他病变。
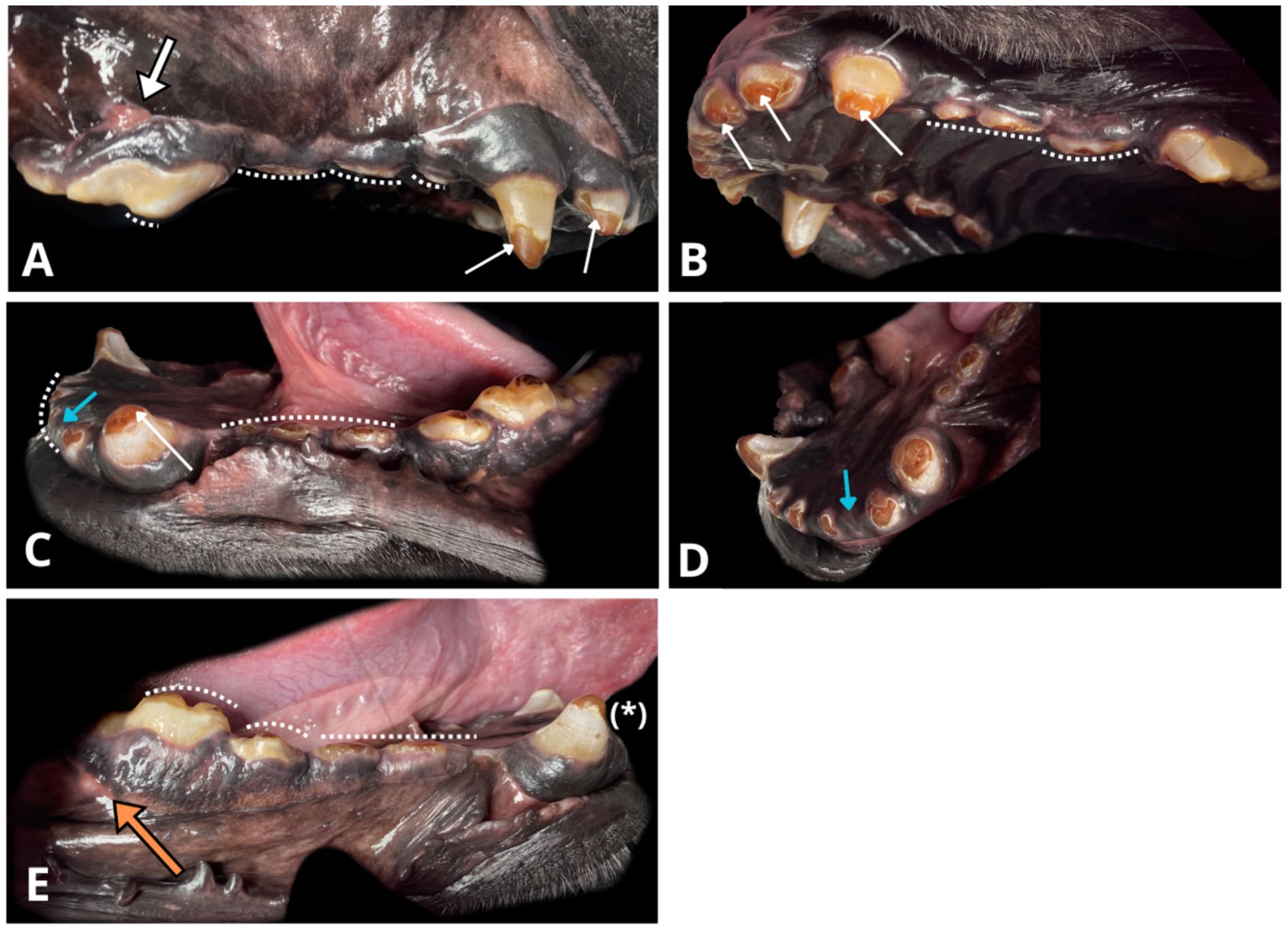
↑ 暴露的牙本质呈琥珀棕色,剩余的牙釉质呈灰棕色(白色窄箭头)。由于异常磨损(白色虚线)和咬合面牙釉质变薄,牙冠严重脱落。(A)108远端牙根周围有明显的根尖周炎,粘龈交界处有引流道(白色粗箭头)。(B)左上颌和腭部视图。(C)302(蓝色箭头)和401的牙冠在牙本质-牙釉质交界处骨折,牙根在原位。(D)缺失的302(蓝色箭头)的另一个角度,牙根被健康牙龈覆盖。(E)404(星号)牙釉质缺损。409远端根部有明显的引流道(橙色粗箭头),伴有根尖周增生。
所有剩余的下颌门齿、16颗前臼齿中的11颗,包括双上颌第一、第二和第三前臼齿(105、106、107、205、206、207)、双下颌第一和第二前臼齿(305、306、405、406)以及左下颌第三前臼齿(307)的咬合面上都有严重磨损的区域,牙冠上的牙本质流失到牙龈边缘的水平。其余牙齿的牙冠也有磨损,但程度较轻。
所有牙齿的牙釉质分布都很有限,只延伸到剩余牙冠的颈部和中部,咬合面上没有发现。在右下颌犬齿(404)和右下颌第一臼齿(409)上发现了牙釉质缺损。暴露的牙本质呈现出广泛的琥珀棕色变色。牙釉质呈灰褐色。
头部CT造影显示,所有牙齿的根尖周围都有严重程度不等的低密度影,提示牙根尖周炎(下图)。所有4颗犬齿(104、204、304、404)、左上颌第三前磨牙(207)、左右上颌第四前磨牙(108、208)、左下颌第四前磨牙(308)和左右下颌第一磨牙(409、309)根尖的低增亮区域最大。
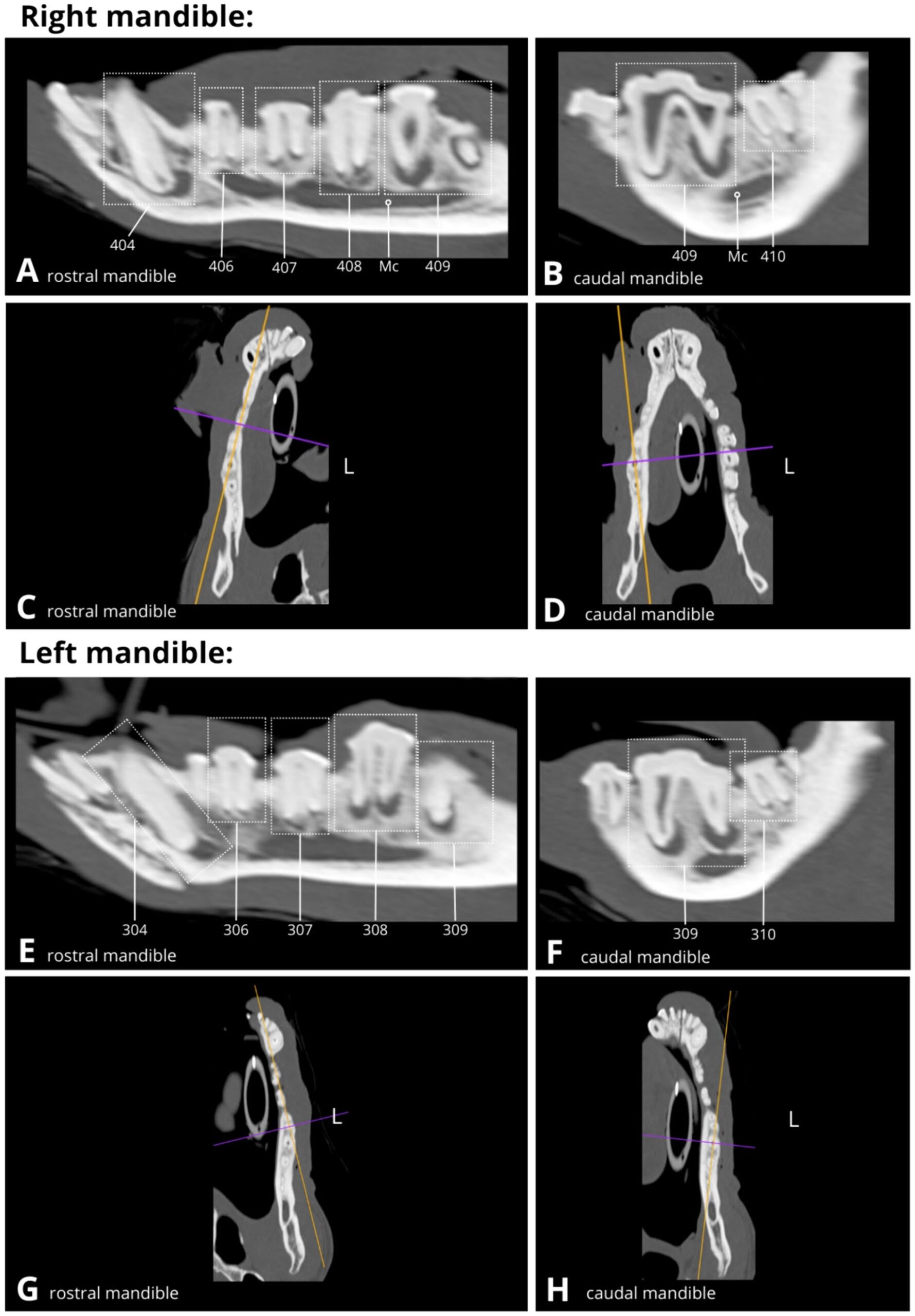
↑ 略微倾斜的矢状面(ABEF)和背侧(BCGH)CT重建显示了左右下颌骨牙体(虚线矩形),显示出多个大小不一的根尖周炎低增生区域(ABEF)。下颌管(Mc),左侧(L)。
牙槽骨内的多个硬化区域也很明显,围绕着根尖周低平的外围,符合剥脱性骨膜炎,在与右下颌犬齿(404)相关的右下颌骨喙突处最为明显,而在右上颌第四前磨牙(108)、左上颌第三和第四前磨牙(207和208)、左下颌第四前磨牙(308)、左下颌第一磨牙(309)以及右下颌第三前磨牙和第一磨牙(407和409)附近则相对不明显。
在右上颌第四前磨牙(108)远端牙根、右下颌第一磨牙(409)远端牙根以及左上颌第三前磨牙(207)远端牙根的部分区域,还发现了小面积的颊部皮质灶性溶解,表明可能存在引流道,这些区域均与根尖周的低增生相融合。在这些牙齿的旁边,下颌骨和上颌骨的颊侧以及左下颌第一磨牙(309)的外侧都有非常轻微的、不规则的骨膜反应,表明存在增生性骨膜炎或骨髓炎。
牙根的长度和形状看起来都很正常,所有牙齿的根尖都是闭合的。由于牙齿硬组织损失严重,对牙冠形态的全面评估受到限制。有3处牙冠骨折:右下颌第一前磨牙(405)的牙冠顶端、右下颌第一门齿和左下颌第二门齿(401和302)的牙本质-牙釉质交界处,牙根都在原位。
在牙科X光片上,可以观察到根尖周病变牙齿的牙髓腔和根管宽度存在差异(下图)。例如,左下颌第四前磨牙(308)的根管似乎比左下颌第三前磨牙(307)或其对应的右下颌第四前磨牙(408)的根管宽。左下颌第一磨牙(309)的根管明显比右下颌第一磨牙(409)的根管窄,牙髓腔几乎完全消失。在下颌骨的咬合视图上(下图H),右下颌犬齿(404)的根管空间比其对应的左下颌犬齿(304)相对宽大。
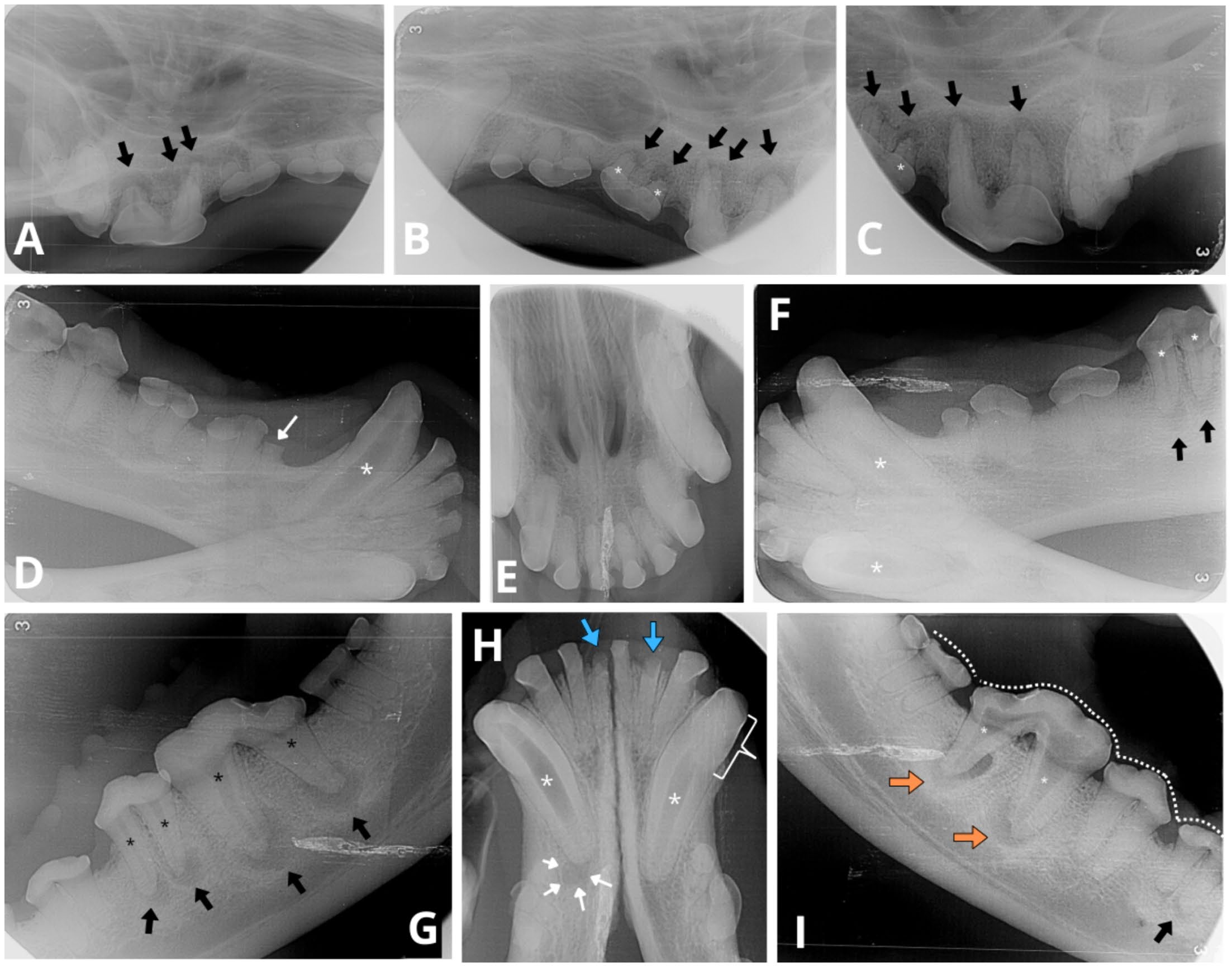
↑(A)108(黑色箭头)每个根尖周围的牙槽骨有根尖周炎迹象。(BC)207和208(黑色箭头)牙根周围都有类似的根尖骨缺损。与邻牙(206)相比,207的根管(白色星号)异常宽大。(D)405的牙槽骨线牙冠上方有一处骨折(白色细箭头)。404(白色星号)的牙髓腔和根管异常宽大且呈放射状。(E)没有明显的根尖周病变迹象或根管宽度异常。(F)304的中根和远根有明显的根尖周病变(黑色箭头)。404、304和308(白色星号)异常宽大的牙髓腔和根管提示牙髓病。(G)308和309(黑色箭头)根尖均有根尖周透明。异常宽的根管也很明显(黑色星号)。308和408的根管宽度相对不同,后者的两个根管宽度都符合狗的年龄。(H)404(白色细箭头)根尖周围骨质出现根尖周炎。两颗下颌犬齿都有异常宽大的根管(白色星号)。与304相比,404髓腔更加透亮,提示髓腔内存在气体成分。304髓腔部分闭塞,表现为冠状面(白色括号)锥形变窄,类似火焰状空腔。302和401的牙冠出现明显骨折(蓝色粗箭头),牙根保留。门牙牙根顶端周围的牙周韧带间隙不明显,表明存在外部替代吸收。(I)大部分牙齿根尖变钝(白色虚线)。409有牙髓病迹象,吸收的牙根周围骨质流失,两个根管异常宽大(白色星号)。在远端和中端牙根上都有环形根尖周透明区(橙色箭头)。409的牙本质壁比309薄,表明409的成熟期较早。409和309的牙根顶端部分形状不规则,表明外部炎性吸收。407的中侧牙根有轻度根尖周炎迹象(黑色箭头)。
右下颌犬齿(404)和左下颌犬齿(304)的根管空间都异常宽大,但发育停滞的程度不同(下图)。
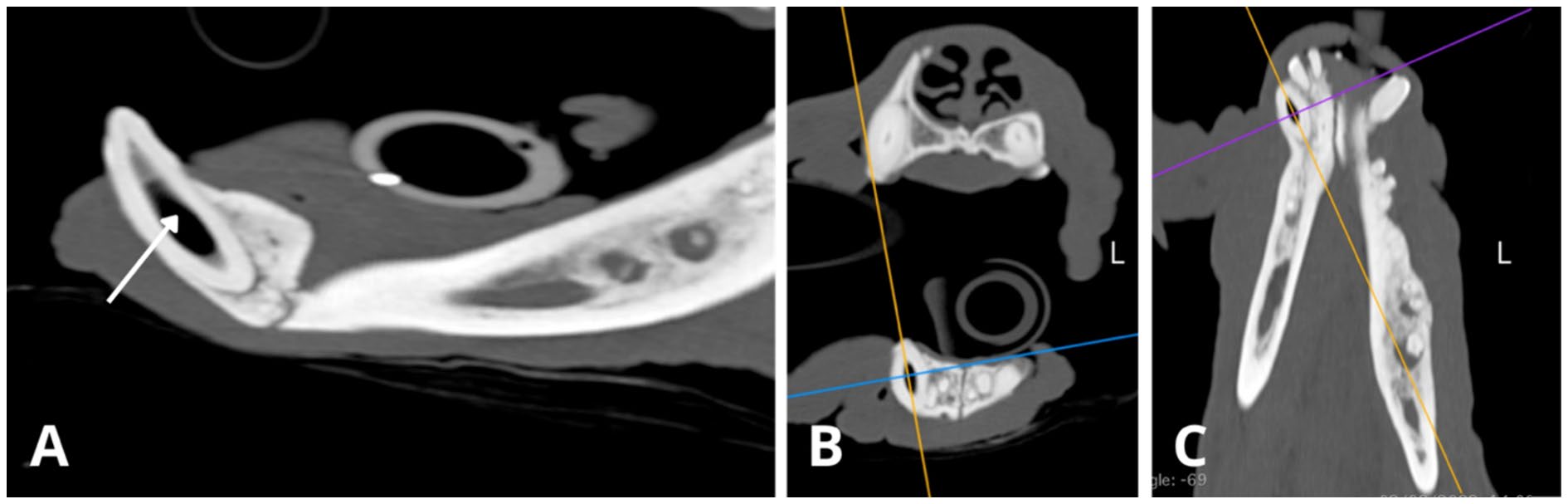
↑ 略微倾斜的矢状面(A)、横断面(B)和背侧(C)CT重建图显示了404的情况。牙髓腔异常宽大,牙髓腔中央部分有气体积聚(白色箭头)。
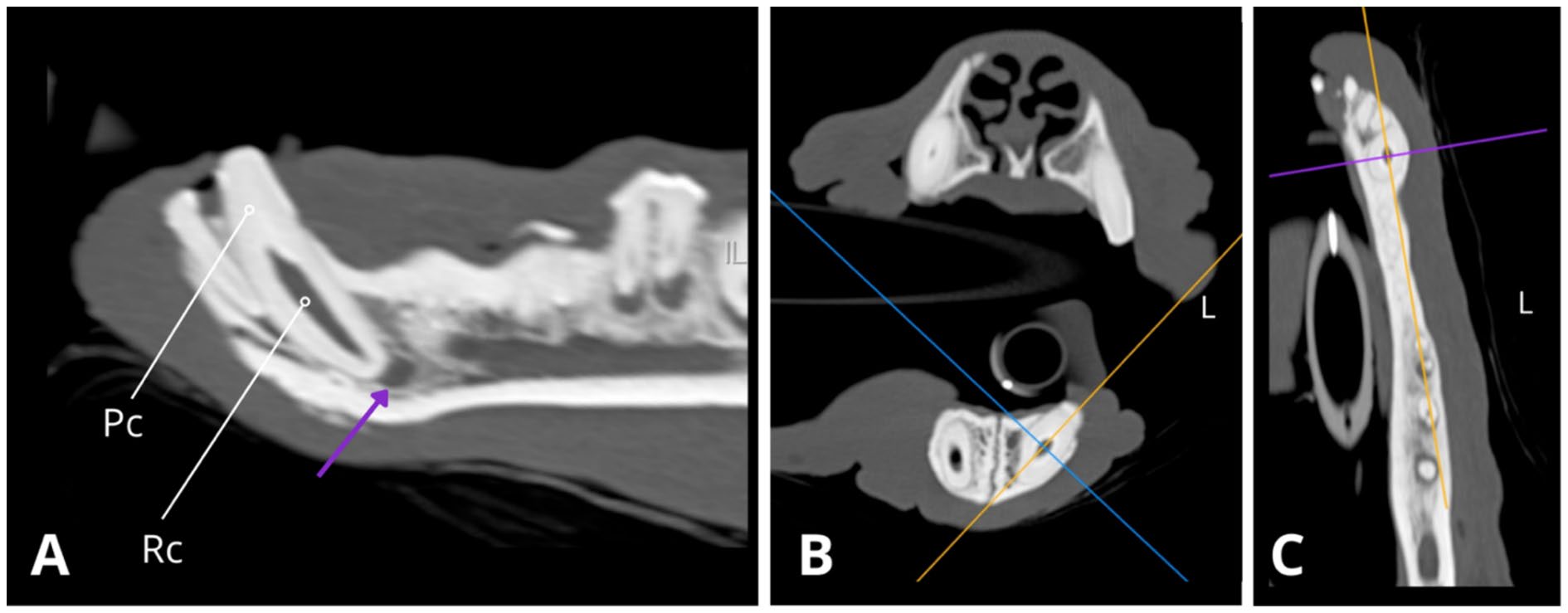
↑ 略微倾斜的矢状面(A)、横断面(B)和背侧(C)CT重建图显示了304,根管(Rc)异常宽大,牙髓腔(Pc)部分闭塞,其冠状面呈锥形狭窄。根尖存在根尖周围低增生(紫色箭头),提示根尖牙周炎。
左下颌犬齿(304)的牙髓腔部分闭塞,其冠状面呈锥形变窄,导致牙髓腔外观呈火焰状(下图)。有11颗牙齿无法看到缩小的根管空间,这表明牙髓腔几乎完全阻塞。
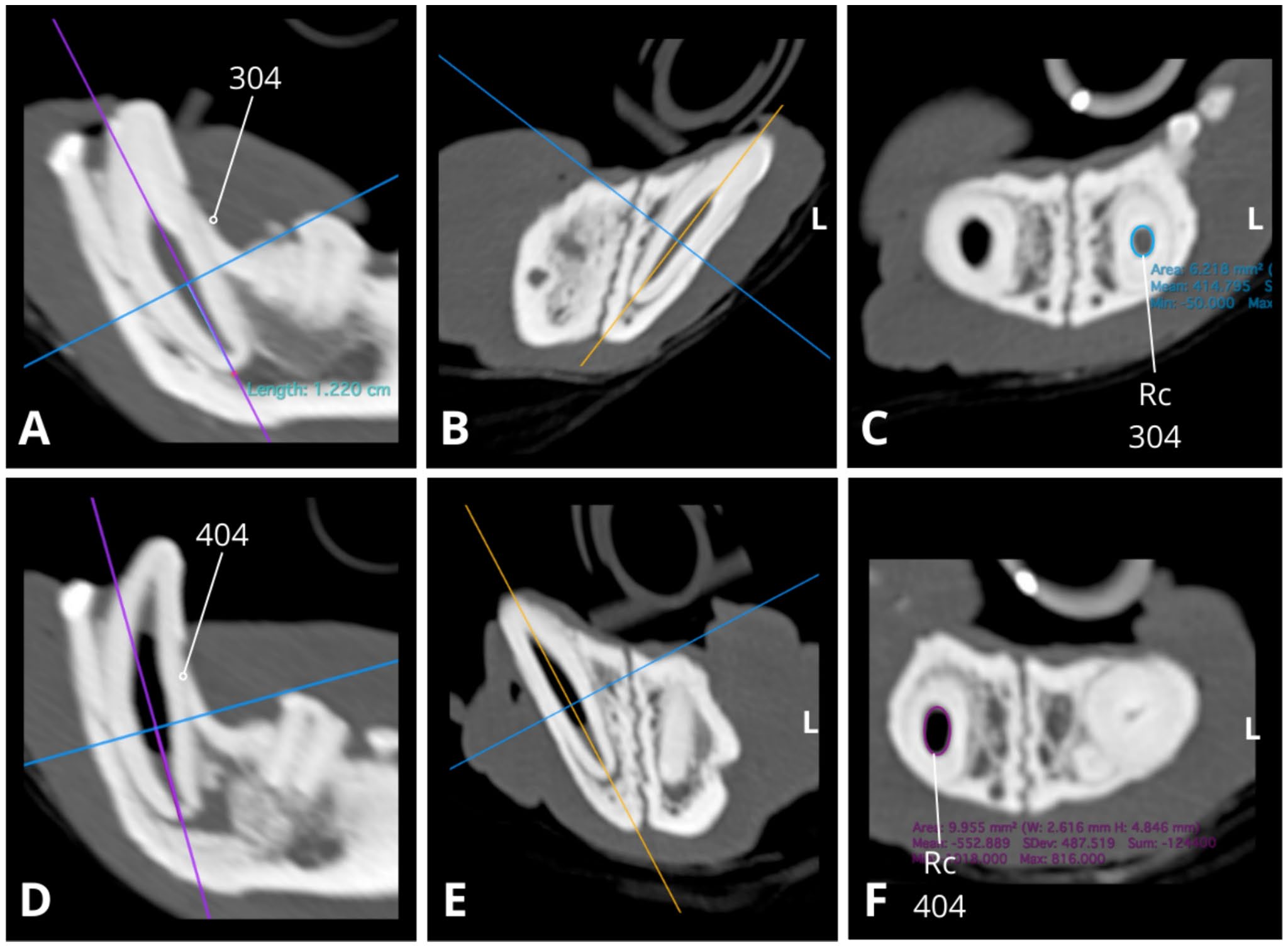
↑ 略微倾斜的矢状(AD)、横向(BE)和背侧(CF)CT重建图显示了304、404根管宽度的相对差异,其中右下颌犬齿根管明显较宽(DF)。根管横截面(Rc)的测量是在沿牙根长轴的一致水平上进行的(距根尖边界1.22 cm),略微倾斜的背侧CT重建(CF)用于获得根管的横向图像。304的根管横截面积约为6.218平方毫米(C,蓝色圆圈;2.4×3.3 mm),而404的根管横截面积为10.0平方毫米(F,紫色圆圈;2.6×4.8 mm)。
在左下颌第一磨牙和右下颌第一磨牙(309、409)、左上颌第三前磨牙(207)和左上颌第四前磨牙(208)的两个牙根尖都观察到外部炎性吸收。
除了牙科X射线检查结果外,CT成像还显示其他几颗牙齿的牙髓腔异常增宽:右下颌第一磨牙(409)明显异常增宽,左右上颌第四前磨牙(108、208)和左上颌第三前磨牙(207)均有轻度异常增宽。在右下颌犬齿(404)的牙髓腔中央部分检测到气体,这在CT图像上很明显,在X光片较轻微。
牙髓宽度的这些变化,再加上根尖周的透亮,表明在患者发生了继发性牙本质生成停止,然后是牙髓坏死。此外,CT扫描显示头骨外观正常,颈椎也正常。最终诊断是根据牙齿的临床、放射学和组织病理学综合做出的。由于没有全身性疾病或病理性长骨骨折,加上正常的姿态和身体比例,排除了同时存在成骨不全症的可能性。鉴于放射学证据显示牙本质发育不全的形式较轻,最终诊断是II型牙本质发育不全。
03 治疗
由于每颗牙齿都有牙髓病和根尖周炎,建议进行全口拔牙。治疗分两次进行。
第一次手术中,使用0.5%布比卡因(0.7 mL)分别对右侧口内下牙槽和上颌进行局部麻醉神经阻滞。通过手术拔除了右上颌和下颌的所有牙齿。牙齿都非常脆弱,使用骨膜剥离子时很容易碎裂,因此拔牙具有挑战性。完全拔除经X光片证实。使用4-0缝线进行简单的连续缝合,对口腔粘膜进行骨膜松解,以实现拔牙部位的无张力闭合。
麻醉恢复顺利,当天出院。术后口服药物包括扑热息痛加可待因(400 mg/9 mg,每次半片,每天三次)、美洛昔康(1.5 mg/mL口服混悬液,每次0.1 mg/kg,每天一次)、金刚烷胺(100 mg,每次4 mg/kg,每天两次)。建议在术后两周内食用软食。
术后14天,检查显示手术部位愈合顺利。建议主人安排第二阶段拔牙。
首次手术11周后,再次接受了第二阶段拔牙手术,自首次手术以来,每天都服用美洛昔康。接受了相同的术前、麻醉和止痛方案,包括左侧口内下牙槽和上颌牙神经阻滞,每个注射部位使用0.7 mL 0.5%布比卡因。左上颌和下颌的剩余牙齿被拔除。当天出院,出院时服用了美洛昔康、扑热息痛加可待因和金刚烷胺以控制疼痛。术后指导和复查方案保持不变。
对右下颌犬齿(404)进行了组织学评估,样本中的原生牙本质和次生牙本质中的牙本质小管与正常的覆盖牙本质和牙骨质一起呈现出弥漫性紊乱(下图)。牙本质染色不均匀表明可能存在低矿化。牙齿的某些区域在原生牙本质和次生牙本质之间有明显的分界线。组织学特征支持牙本质发育不全的诊断。与其他已发表的犬病例相比,这颗牙齿的牙本质较厚,牙本质小管的紊乱程度较轻。这些特征归因于患者的年龄以及疾病严重程度可能存在的差异。
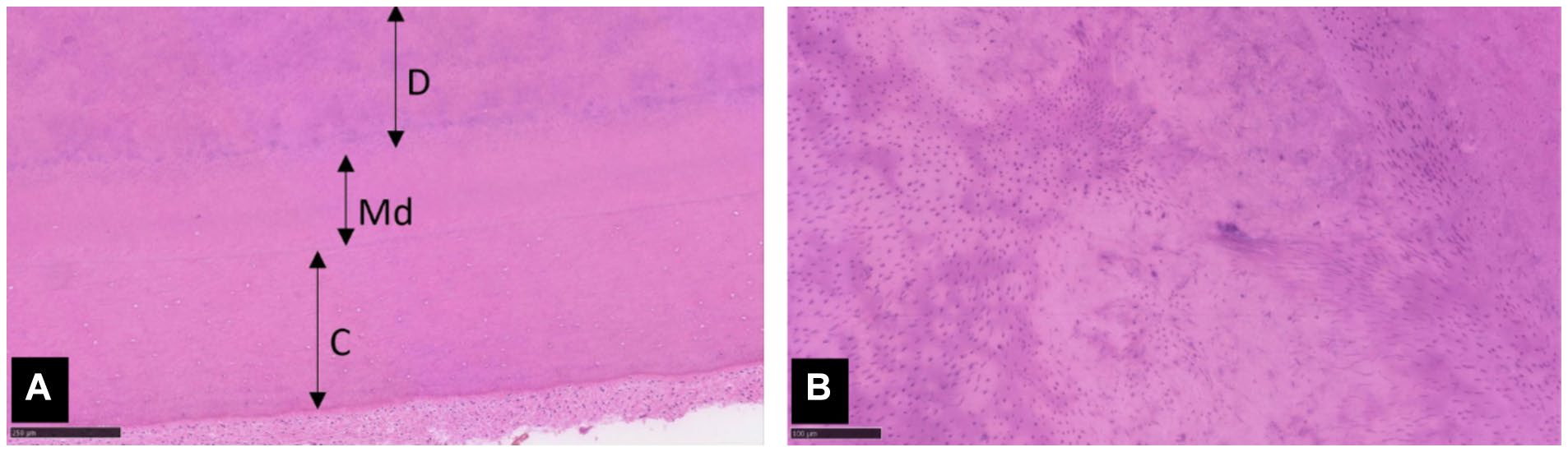
↑ (A)牙本质(D),小管轻度至中度紊乱,与正常覆盖牙本质(Md)和牙骨质(C)相连。(B)牙本质的高倍放大图显示,均匀分布的小管与小管混乱的区域相间。
04 讨论
牙本质发育不全(Dentinogenesis imperfecta,DGI)是一种常染色体显性遗传性疾病,其特点是牙本质形成缺陷,影响乳牙和恒牙。牙齿异常包括牙变色(通常为琥珀棕色)、牙齿脆性增加、牙冠/牙根病理性折断以及严重的牙齿磨损[1]。
DGI可分为3个亚型:I型(DGI-I)与成骨不全症同时发生,II型和III型(DGI-II、DGI-III)为非综合征,仅限于牙齿症状。在DGI中,由于牙本质-牙釉质连接处异常和/或牙釉质矿化不足,牙釉质很容易从牙齿表面剥落。这就暴露了下面较软的牙本质,导致牙齿磨损加速[1-4]。
根据Shield牙科表型分类,在原发性牙本质疾病中,有3种DGI亚型和2种牙本质形成不良(dentine dysplasia,DD)亚型,即I型(DD-I)和II型(DD-II)。DGI-II被认为比III型轻微,而DGI-I是成骨不全症的牙科表现,主要由COL1A1或COL1A2基因突变引起[5,6]。
最近的遗传学研究表明,DGI-II、DGI-III和DD-II是由牙本质涎磷蛋白(DSPP)基因突变引起的[7,8]。DSPP基因突变个体的表型差异表明,DD-II和DGI-II是同一基因条件下的不同表现形式,而不是不同的疾病[8,9]。
DD-I在遗传起源和临床表现上都不同于其他原发性牙本质疾病。它与无根牙和牙髓失常有关[5,10]。据报道,DD-I在人类中是常染色体显性遗传,最近又被确定为一种与VPS4B、SSUH2和SMOC2等基因突变有关的遗传异质性疾病[5,11]。
由于这种疾病在狗身上的罕见性和研究的有限性,有人建议将人类的原发性牙本质疾病分类法应用于兽医牙科。包括本病例在内,仅有4例与人类DGI-II相似的非综合征性DGI病例在犬中报道,由于症状严重,所有病例均接受了拔牙治疗[12,13]。
鉴于病例数量有限[12,13],目前仍无法确定广泛用于人类牙科疾病的Shield分类法是否可直接用于犬,尤其是在区分非综合征DGI亚型方面。在人类中,DGI-II被认为是一种较轻的形式,而DGI-III则被认为是一种较严重的变异[14]。然而,目前还不清楚这种区分是否适用于狗。本研究选择在适用的情况下采用这种分类方法,以避免与成骨不全相关的综合征型DGI(DGI-I)混淆。
尽管人类遗传学取得了进步,但Shield分类法仍适用于牙本质疾病的诊断,提供了一种清晰易懂的分类方法。在人类中,基因检测有助于确定DGI-II、DGI-III和DD-II的正确诊断、治疗和预后。在兽医实践中,唯一可用的基因检测方法是检测COL1A1、COL1A2和SERPINH1基因中与成骨不全症相关的突变。成骨不全症患者的牙齿组织学特征与DGI患者的牙齿组织学特征相同,因此无法将两者区分开来;不过,这有助于将牙本质疾病与釉质疾病区分开来[15]。
要将人类牙科的DGI-II治疗策略移植到兽医领域,就必须调整原则和技术,以适应动物在解剖学和生理学方面的差异。与人类一样,鉴于迄今为止记录的犬非综合征性DGI的严重程度各不相同,早期诊断对于获得良好的预后至关重要。选择性拔牙或分期全口拔牙通常是首选的治疗方法[12,13]。
狗乳牙会迅速脱落,且存在时间较短,因此修复或镶牙治疗不切实际[13]。尽管如此,如果牙冠骨折并伴有牙髓暴露、感染或疼痛,则应在乳牙完全脱落前及早进行拔牙干预。
在家中坚持良好的口腔卫生习惯,执行饮食建议,如避免坚硬的食物,包括可能磨损牙齿的玩具,在绝育手术期间在牙齿表面涂抹氟化物,以及定期复诊,这些都是必不可少的预防策略。
总之,兽医从业人员必须考虑到动物及其主人的特殊需求和依从性,确保治疗有效且实用。定期随访和放射学监测对于及早发现和处理并发症至关重要,从而提高非综合征DGI狗的整体治疗成功率。为保护这些患者的牙齿,可能需要进行多次全麻,并产生高昂的费用。因此,良好的患者选择和对整体临床健康状况的考虑在治疗决策中至关重要。
文献来源:Piekos KM, Freeman A, Fleming K, Bell C. Dentinogenesis imperfecta in a 6-year-old male neutered Labrador retriever: Case report with atypical clinical presentation and treatment review. Front Vet Sci. 2024 Nov 4;11:1473390.
参考文献
1. Barron MJ, McDonnell ST, MacKie I, Dixon MJ. Hereditary dentine disorders: dentinogenesis imperfecta and dentine dysplasia. Orphanet J Rare Dis. (2008) 3:31.
2. Gallusi G, Libonati A, Campanella V. SEM-morphology in dentinogenesis imperfecta type II: microscopic anatomy and efficacy of a dentine bonding system. Eur J Paediatr Dent. (2006) 7:9–17.
3. Lee S, Lee K, Hwang Y, Kida M, Tsutsumi T, Ariga T, et al. Identification of the DSPP mutation in a new kindred and phenotype–genotype correlation. Oral Dis. (2011) 17:314–9.
4. Lee SK, Lee KE, Jeon D, Lee G, Lee H, Shin CU, et al. A novel mutation in the DSPP gene associated with Dentinogenesis imperfecta type II. J Dent Res. (2009) 88:51–5.
5. Shields ED, Bixler D, El-Kafrawy AM. A proposed classification for heritable human dentine defects with a description of a new entity. Arch Oral Biol. (1973) 18:543.
6. Van Dijk FS, Cobben JM, Kariminejad A, Maugeri A, Nikkels PGJ, Van Rijn RR, et al. Osteogenesis imperfecta: a review with clinical examples. Mol Syndromol. (2011) 2:1–20.
7. Maciejewska I, Chomik E. Hereditary dentine diseases resulting from mutations in DSPP gene. J Dent. (2012) 40:542–8.
8. McKnight DA, Suzanne Hart P, Hart TC, Hartsfield JK, Wilson A, Wright JT, et al. A comprehensive analysis of normal variation and disease-causing mutations in the human DSPP gene. Hum Mutat. (2008) 29:1392–404.
9. Beattie ML, Kim JW, Gong SG, Murdoch-Kinch CA, Simmer JP, Hu JCC. Phenotypic variation in Dentinogenesis imperfecta/dentin dysplasia linked to 4q21. J Dent Res. (2006) 85:329–33.
10. Kim JW, Simmer JP. Hereditary dentin defects. J Dent Res. (2007) 86:392–9.
11. Chen D, Li X, Lu F, Wang Y, Xiong F, Li Q. Dentin dysplasia type I—A dental disease with genetic heterogeneity. Oral Dis. (2019) 25:439–46.
12. Mack Wilson J, Bell C, Queck K, Scott K. A review of Dentinogenesis imperfecta and primary dentin disorders in dogs. J Vet Dent. (2022) 39:376–90.
13. Venet K. Dentinogenesis imperfecta in a 1-year-old female Labrador retriever dog: a case report and literature review. J Vet Dent. (2023) 08987564231208359.
14. Simmer JP, Zhang H, Moon SJH, Donnelly LAJ, Lee YL, Seymen F, et al. The modified Shields classification and 12 families with defined DSPP mutations. Gen Dent. (2022) 13:858.
15. Murphy BG, Bell CM, Soukup JW. Veterinary oral and maxillofacial pathology. Hoboken: Wiley Blackwell; (2020).