
| 品种:短毛猫 | |
| 年龄:12岁 | |
| 性别:未知 | |
| 诊断:注射部位肉瘤 | |
01 主诉及病史
因左侧胸腰部软组织肿块而转诊。
曾被诊断为糖尿病,已缓解两年,未接受任何治疗。肿块是2个月前首次发现的,为一个巨大、多分叶、坚实、不连续、溃烂的软组织肿块。细针穿刺细胞学检查提示为肉瘤,并有坏死区域。1个月前进行了两次活检,结果显示是纤维肉瘤。此次转诊拟进行大范围手术切除。
02 检查
神志清醒,反应灵敏,体重6.97千克,体况评分6/9。胸部听诊和腹部触诊均无异常。左侧胸腰部有一个坚实、不活动的肿块,大小约39×45×32 mm。先前活检部位有轻度浆液性分泌物。
胸部和腹部CT显示,在左侧背外侧腹壁的皮下组织和肌肉层中有一个混合软组织和软组织-液体衰减、轮廓清晰的多叶状肿块,从L2椎骨延伸至L4椎骨,大小为48×31×42 mm(下图)。肿块与左侧脊柱旁肌肉(腰长肌和腰髂耻肌)的最深处接触,导致这些肌肉和邻近腹壁偏离,但没有明显浸润。肿块最深处的外围有一条粗线状延伸,位于肿块的外侧。颈浅淋巴结、颈深淋巴结、腋窝淋巴结和附属腋窝淋巴结肿大。未发现明显转移。其他发现包括胸腺残留物、左胸壁和右大腿皮下结节、轻度弥漫性支气管肺型、非特异性脾病、左肾肾结石/萎缩性矿化以及弥漫性皮肤改变。
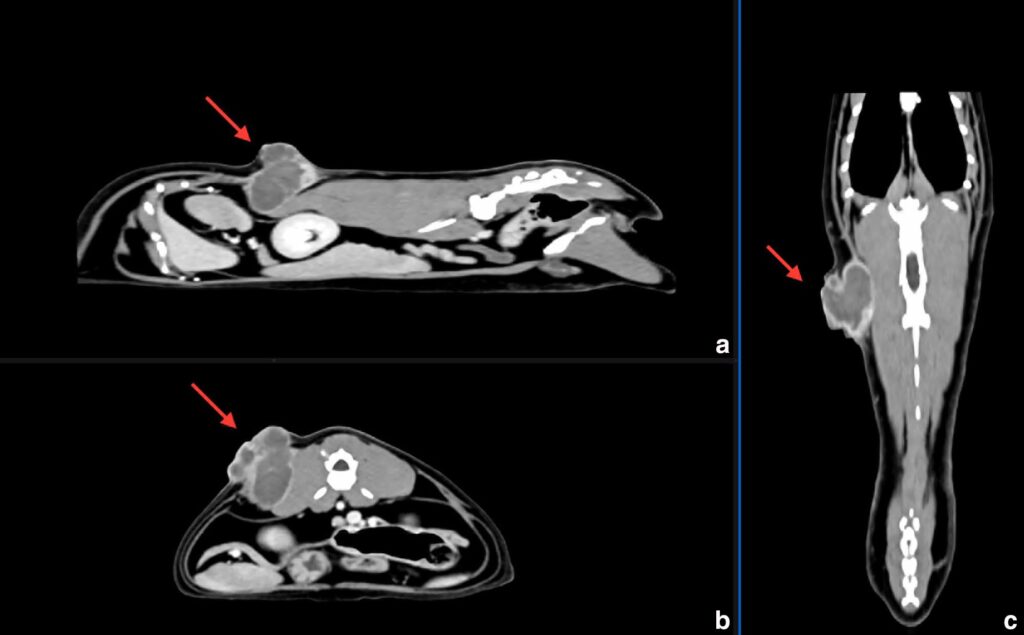
↑ 腹部和胸部的多平面重建CT图像,显示左侧背外侧腹壁的肿块,与猫注射部位肉瘤(红色箭头)相符。图像为对比后图像,在软组织窗口中显示:(a)矢状、(b)冠状和(c)正面。
肿大淋巴结的细针穿刺细胞学检查显示有反应性变化,没有转移特征。皮下结节的细胞学诊断为良性角化病变,主人拒绝同时切除这些结节。
03 手术
建议对肿块进行大范围手术切除,由于患者的相关原因,手术在21天后进行。术前静脉注射了0.035 mg美托咪定和1.40 mg美沙酮。使用异氟醚吸入剂和氧气维持麻醉。
取右侧卧位。在肿块周围切开皮肤,切缘5 cm(下图)。
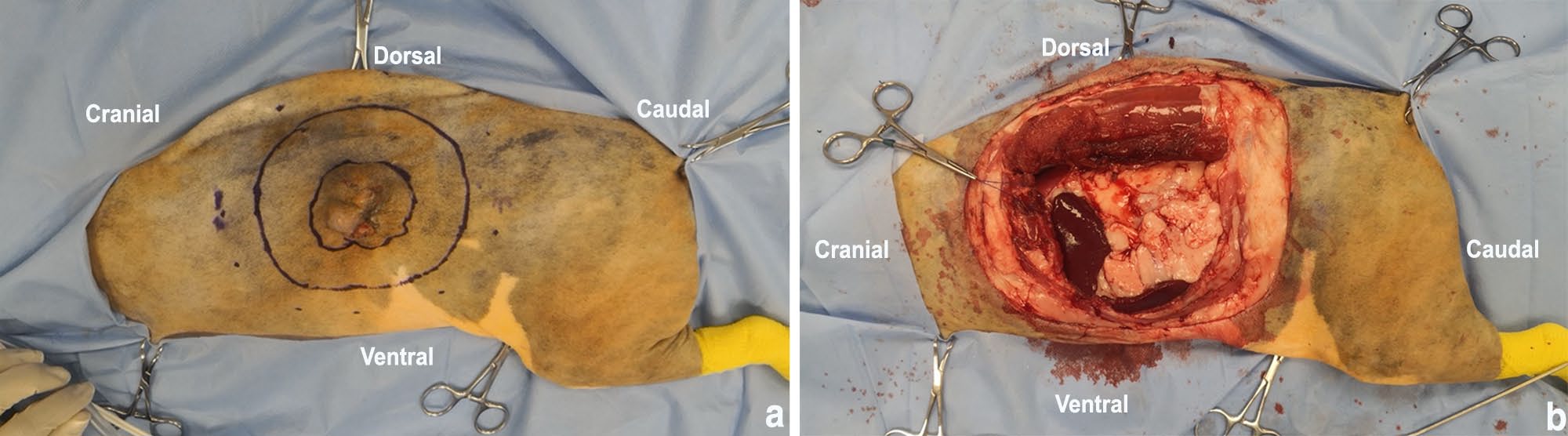
↑ (a)猫注射部位肉瘤出现在左侧腹部,肿块可触及边缘(内侧连续线)和5 cm侧缘(外侧虚线)有无菌手术笔标记。(b)切除肿物后的体壁缺损,外侧边缘为5 cm。
以5 cm的侧缘切除下层组织,包括切除左侧第13根肋骨、背阔肌尾部区域、全层腹壁以及L2和L3的部分肩胛肌(下图a)。在直视下放置了胸腔造口引流管,并固定在皮肤上。胸壁和腹壁的重建包括膈肌前移和侧移,方法是切开膈肌凹面的浆膜,将膈肌前移和侧移缝合到第12肋骨上。切开背阔肌背侧筋膜,将皮瓣向腹侧旋转。通过切开腹内斜肌的腹侧筋膜并将皮瓣向背侧和头侧旋转,在尾部也形成了一个皮瓣。将腹内斜肌肌瓣缝合到横膈膜游离边缘和背阔肌头侧(下图b),背侧缝合到腹横肌腹外侧的剩余筋膜,腹侧缝合到剩余的腹内斜肌筋膜。然后将剩余的腹外斜肌背向缝合到背阔肌肌瓣的腹侧边缘,并背向缝合到腹内斜肌肌瓣。这种肌瓣组合可在无张力的情况下完全闭合(下图c)。
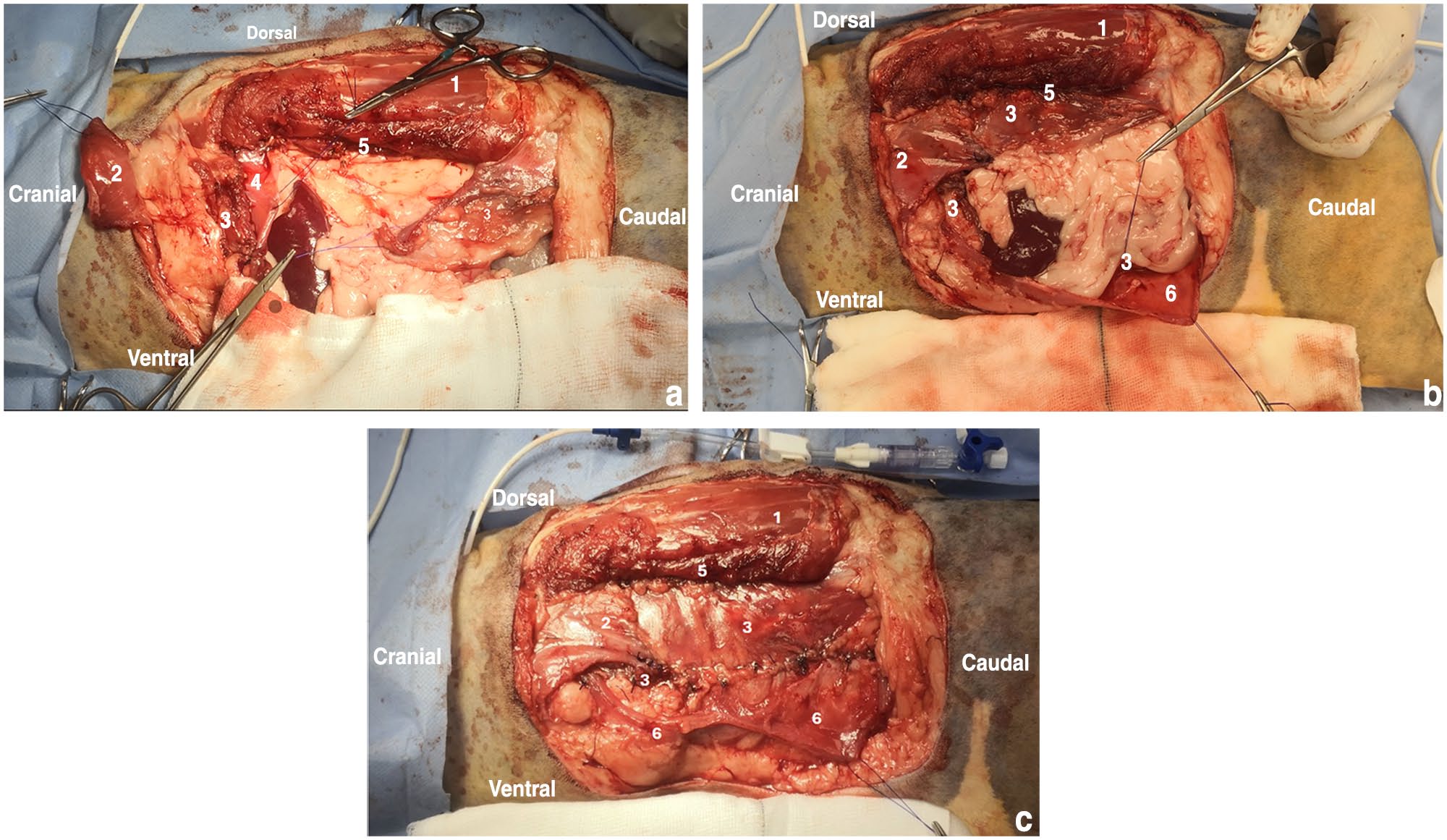
↑ (a)腹部肿块广泛切除后的腹壁缺损。腰背肌1和腹横肌残余5位于缺损背侧。在背阔肌2、膈肌4和腹内斜肌3的尾部边缘进行留置缝合。(b)腹内斜肌肌瓣3头侧与背阔肌2和膈肌的游离边缘缝合,背侧与腹横肌5缝合。在腹外斜肌6和腹内斜肌腹侧残余部分进行留置缝合。(c)腹外斜肌6背侧与腹内斜肌3缝合,头侧与背阔肌2和腹内斜肌残余缝合。这使得缺损完全闭合。
通过胸腔造口引流管引流。在无张力的情况下缝合皮肤,需要转位腹股沟侧褶皮瓣。皮下组织和皮肤用2-0缝线进行多处简单间断缝合。皮下层用3-0缝线简单连续缝合,皮肤用皮肤钉缝合(下图)。切除的组织送去做组织病理学检查。

↑ 腹股沟侧褶皮瓣转位的皮肤闭合术。
组织病理学确诊为完全切除的肉瘤,与猫注射部位肉瘤相吻合。从切缘算起,最窄的组织学无瘤距离为:深部6 mm、头侧32 mm、背侧40 mm、尾侧13 mm和腹侧48 mm。样本中的骨骼(肋骨)切片未显示病理变化。
04 预后
麻醉后恢复顺利,住院期间接受了静脉输液治疗和氯胺酮恒速输注(14-35 μg/分)。药物包括美洛昔康口服混悬液(0.69 mg,q24h,14天)、加巴喷丁片(50 mg,q8h,14天)和头孢氨苄(150 mg,q12h,10天)。
术后1天,移除胸腔引流管。
术后3天,出院。
术后9天,电话随访显示进展良好。
术后14天,拆除缝线。伤口愈合良好,左腿跗关节处有一片干燥的皮炎,没有开裂或坏死的迹象。
术后16天,恢复了正常状态(下图)。腹股沟皮瓣供体部位(左侧跗骨)旁有一小块表皮淤青,采取保守治疗。主人对手术结果很满意。
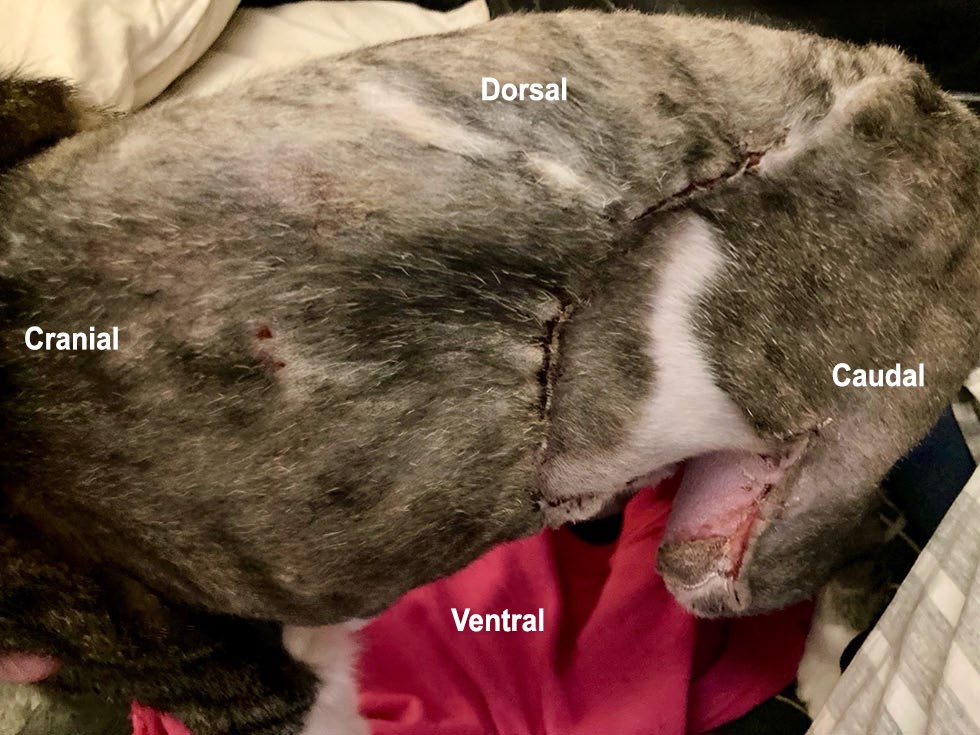
术后36周,手术部位已完全愈合,没有可触及的体壁缺损或局部复发迹象。
术后47周,仍保持正常状态(下图),没有丧失任何功能,也没有明显的外观变化。
05 讨论
猫注射部位肉瘤(Feline injection site sarcoma,FISS)是一种间质来源的肿瘤,表现为注射部位的皮下肿块[1-3],注射部位通常是疫苗注射部位,但也有化疗和植入芯片的情况[4,5]。
这些肿瘤通常表现为局部侵袭性,但转移率相对较低[1]。它们最常发生在频繁注射的部位(肩胛间、胸侧壁或腹壁)。现有文献显示,FISS可在注射后4个月至2-3年间发生[2]。
文献报道,手术切除后的复发率为26-59%,原因是局部组织浸润[6-9]。目前推荐的治疗方法包括根治性或广泛手术切除,切缘5 cm,深达两个筋膜平面[6,10]。局部复发是一个负面的预后指标,如果肿瘤切除不彻底,复发的可能性会增加10倍[6]。
在一项研究中,有3%的FISS在切除时边缘不完整,全部都是III级纤维肉瘤。在这些猫中,14%的患者在切缘5 cm内切除且未进行辅助治疗后出现局部复发,其中包括1/3边缘不完整的患者[10]。
已有多种用于犬腹部大块缺损闭合的肌肉瓣,但在猫身上却缺乏相关文献。在切除浸润性肿块后,腹部大面积缺损很常见。已对狗的腹内斜肌和腹外斜肌肌瓣、膈肌前移肌瓣和背阔肌肌瓣进行了描述,结果良好[11-14]。
肌皮瓣重建技术的典型并发症包括伤口开裂和坏死[15]。有报道称,在6只接受纤维肉瘤根治性切除术的猫身上使用了聚丙烯网片和尾浅上腹部轴型皮瓣,所有猫的疗效都很好,没有局部复发的迹象[16]。既往研究[17]描述了半侧骨盆切除术后不使用原生肌肉组织的闭合情况,并报告了这些病例的良好疗效。其中一个病例使用了聚丙烯网片[17]。
在本病例中,大范围切除导致腹壁和胸壁组织大量缺失。以前曾有报道称,完全使用皮下组织和皮肤进行闭合可成功闭合半侧骨盆切除术后的大块缺损[17]。在本病例中,由于缺损面积较大,且需要对胸腔进行可靠的气密性闭合,因此排除了这一选择。
推荐的FISS治疗方法包括根治性或广泛的手术切除,包括从可触及的肿块外侧边缘起5厘米和两个筋膜平面深处[24]。边缘不完整会增加复发风险[10]。辅助或新辅助放射治疗也被用于局部治疗,特别是在手术切缘不宽或在手术切除前缩小肿瘤的情况下[9,24,25]。
在本病例中,由于肿块被完全切除,组织学切缘宽而整齐,因此没有进行放疗。多模式化疗辅助治疗与单纯手术治疗的无病间隔时间没有明显差异[8,25-29]。然而,这些研究大多研究不足,因此在得出结论时应谨慎。在目前的兽医文献中,广泛或根治性手术切除仍被认为是首选治疗方法。
总之,本病例报告描述了在一只猫的主要体壁组织切除术后,结合使用腹内斜肌和腹外斜肌肌瓣、背阔肌肌瓣以及膈肌前移和侧移,取得了极佳的效果。这种组合可被视为重建猫主要体壁缺损的可行方案。
文献来源:Kooner K, Rubiños C. Reconstruction of a body wall defect using diaphragm lateralisation and advancement, latissimus dorsi, and internal and external abdominal oblique muscle flaps in a cat. JFMS Open Rep. 2024 Dec 16;10(2):20551169241285257.
参考文献
1. Martano M, Morello E, Buracco P. Feline injection-site sarcoma: past, present and future perspectives. Vet J 2011; 188: 136–141.
2. Srivastav A, Kass PH, McGill LD, et al. Comparative vaccine-specific and other injectable-specific risks of injection-site sarcomas in cats. J Am Vet Med Assoc 2012; 241: 595–602.
3. Couto SS, Griffey SM, Duarte PC, et al. Feline vaccine-associated fibrosarcoma: morphologic distinctions. Vet Pathol 2002; 39: 33–41.
4. Martano M, Morello E, Iussich S, et al. A case of feline injection-site sarcoma at the site of cisplatin injections. J Feline Med Surg 2012; 14: 751–754.
5. Dean RS, Pfeiffer DU, Adams VJ. The incidence of feline injection site sarcomas in the United Kingdom. BMC Vet Res 2013; 9: 17.
6. Giudice C, Stefanello D, Sala M, et al. Feline injection-site sarcoma: recurrence, tumour grading and surgical margin status evaluated using the three-dimensional histological technique. Vet J 2010; 186: 84–88.
7. Davidson EB, Gregory CR, Kass PH. Surgical excision of soft tissue fibrosarcomas in cats. Vet Surg 1997; 26: 265–269.
8. Bregazzi VS, LaRue SM, McNiel E, et al. Treatment with a combination of doxorubicin, surgery, and radiation versus surgery and radiation alone for cats with vaccine-associated sarcomas: 25 cases (1995–2000). J Am Vet Med Assoc 2001; 218: 547–550.
9. Kobayashi T, Hauck ML, Dodge R, et al. Preoperative radiotherapy for vaccine associated sarcoma in 92 cats. Vet Radiol Ultrasound 2002; 43: 473–479.
10. Phelps HA, Kuntz CA, Milner RJ, et al. Radical excision with five-centimeter margins for treatment of feline injection-site sarcomas: 91 cases (1998–2002). J Am Vet Med Assoc 2011; 239: 97–106.
11. Cronin A, Hall JL. A novel internal abdominal oblique muscle flap to close a major abdominal wall defect. J Small Anim Pract 2019; 62: 55–58.
12. Alexander LG, Pavletic MM, Engler SJ. Abdominal wall reconstruction with a vascular external abdominal oblique myofascial flap. Vet Surg 1991; 20: 379–384.
13. Huang Y, Wang P, Hao J, et al. The external oblique muscle flap technique for the reconstruction of abdominal wall defects. Asian J Surg 2023; 46: 730–737.
14. Gilman O, Ogden D. Lateralization of the diaphragm for thoracic wall reconstruction in a dog. J Am Vet Med Assoc 2021; 258: 85–88.
15. Feng YC, Chen KS, Chang SC. Reconstruction with latissimus dorsi, external abdominal oblique and cranial sartorius muscle flaps for a large defect of abdominal wall in a dog after surgical removal of infiltrative lipoma. J Vet Med Sci 2016; 78: 1717–1721.
16. Lidbetter DA, Williams FA, Krahwinkel DJ, et al. Radical lateral body-wall resection for fibrosarcoma with reconstruction using polypropylene mesh and a caudal superficial epigastric axial pattern flap: a prospective clinical study of the technique and results in 6 cats. Vet Surg 2002; 31: 57–64.
17. Griffin MA, Altwal J, Culp WTN, et al. Modified hemipelvectomy techniques in dogs and cats appear well tolerated with good functional outcomes. J Am Vet Med Assoc 2023; 261: 1–9.
18. Mejía S, Boston SE, Skinner OT. Sartorius muscle flap for body wall reconstruction: surgical technique description and retrospective case series. Can Vet J 2018; 59: 1187–1194.
19. Gregory CR, Gourley IM, Koblik PD, et al. Experimental definition of latissimus dorsi, gracilis, and rectus abdominus musculocutaneous flaps in the dog. Am J Vet Res 1988; 49: 878–884.
20. Luce EA, Hyde G, Gottlieb SE. et al. Total abdominal wall reconstruction. Arch Surg 1983; 118: 1446.
21. Cady B, Brooke-Cowden GL. Repair of massive abdominal wall defects: combined use of pneumoperitoneum and marlex mesh. Surg Clin North Am 1976; 56: 559–570.
22. Mori N, Takano K, Miyake T, et al. A comparison of prosthetic materials used to repair abdominal wall defects. Paediatr Surg Int 1983; 94: 392–398.
23. Bowman K, Birchard S, Bright R. Complications associated with the implantation of polypropylene mesh in dogs and cats: a retrospective study of 21 cases (1984–1996). J Am Anim Hosp Assoc 1998; 34: 225–233.
24. Zabielska-Koczywąs K, Wojtalewicz A, Lechowski R. Current knowledge on feline injection-site sarcoma treatment. Acta Vet Scand 2017; 59: 47.
25. Hendrick MJ, Brooks JJ. Postvaccinal sarcomas in the cat: histology and immunohistochemistry. Vet Pathol 1994; 31: 126–129.
26. Martano M. Surgery alone versus surgery and doxorubicin for the treatment of feline injection-site sarcomas: a report on 69 cases. Vet J 2005; 170: 84–90.
27. Cohen M, Wright JC, Brawner WR, et al. Use of surgery and electron beam irradiation, with or without chemotherapy, for treatment of vaccine-associated sarcomas in cats: 78 cases (1996–2000). J Am Vet Med Assoc 2001; 219: 1582–1589.
28. Bray J, Polton G. Neoadjuvant and adjuvant chemotherapy combined with anatomical resection of feline injection-site sarcoma: results in 21 cats. Vet Comp Oncol 2014; 14: 147–160.
29. Poirier VJ, Thamm DH, Kurzman ID, et al. Liposome-encapsulated doxorubicin (doxil) and doxorubicin in the treatment of vaccine-associated sarcoma in cats. J Vet Intern Med 2002; 16: 726–731.