
| 品种:美国短毛猫 | |
| 年龄:10岁 | |
| 性别:雌 | |
| 诊断:鸟分枝杆菌感染 | |
01 主诉及病史
2023年12月7日接诊,长期食欲不振,体重减轻(2023年8月28日体重4.4千克)。
只在室内活动,食物包括商业干粮,从未喂过生肉或未经消毒的牛奶。曾于2023年5月23日和7月13日两次接受甲强龙(16 mg)治疗,用于治疗鼻腔脓毒血症炎症,并最终治愈。当时采集的活组织切片未发现感染性病原体。
02 检查
体重3.1千克。无精打采,呼吸频率加快,低热(直肠温度39.4℃)。怀疑有潜在的全身感染或肿瘤。
注射了米氮平(2 mg用于刺激食欲)和皮下注射哈特曼溶液以纠正脱水。血液学和血生化显示:低白蛋白血症(24 g/L [25-38])、低胆固醇血症(1.8 mmol/L [2.2-5.5])、低血肌酐(0.07 mmol/L [0.08-0.20])和淋巴细胞减少(0.5×10^9/L [0.9-7.0])。
2024年1月16日,再次就诊。体重进一步下降(2.89千克)、严重嗜睡、低热(直肠温度39.4℃),左下颌区域有一巨大肿块。虽然对该肿块进行的细针穿刺没有得出结论,但怀疑这是左下颌淋巴结肿大。接受了50 mg阿莫西林/克拉维酸(每日两次)和0.5 mg美洛昔康治疗。
腹部超声发现左肾附近有一个大肿块。对该肿块进行了细针穿刺检查,细胞学发现巨噬细胞群中含有大量胞质内阴性染色杆菌。ZN染色证实这些细菌是耐酸性菌(下图)。

↑ (A)肾肿块细针穿刺涂片,经改良赖氏染色法染色。黑色箭头显示巨噬细胞内含有大量胞质内透明染色杆菌,还有少量中性粒细胞。(B)用齐氏-奈尔森(ZN)染色法染色,以突出耐酸菌。图像显示有大量呈阳性染色的细胞内耐酸杆菌。
鉴于该猫预后不良且临床症状明显持续恶化,于2024年1月19日实施了安乐死,并进行了尸体解剖。
03 尸检
重2.9千克。全身未见皮肤损伤。左下颌淋巴结明显肿大(2.3×2.2×1.5 cm),质硬,呈淡褐色,有不同程度的砂砾感(下图AB)。甲状腺左叶和右叶各有一个中度分界、稍硬的淡黄色结节(左0.3×0.2×0.1 cm;右0.8×0.6×0.3 cm)(下图C)。一个大的(3.9×3.8×2.1 cm)、中度分界、坚硬、淡黄绿色、砂砾状、轻微空洞化的肿块紧贴在左肾的头侧及其上覆的肾囊上,并延伸到下层肾实质(下图DE)。肿块上散布着许多针尖大小的灰白色砂砾状病灶。
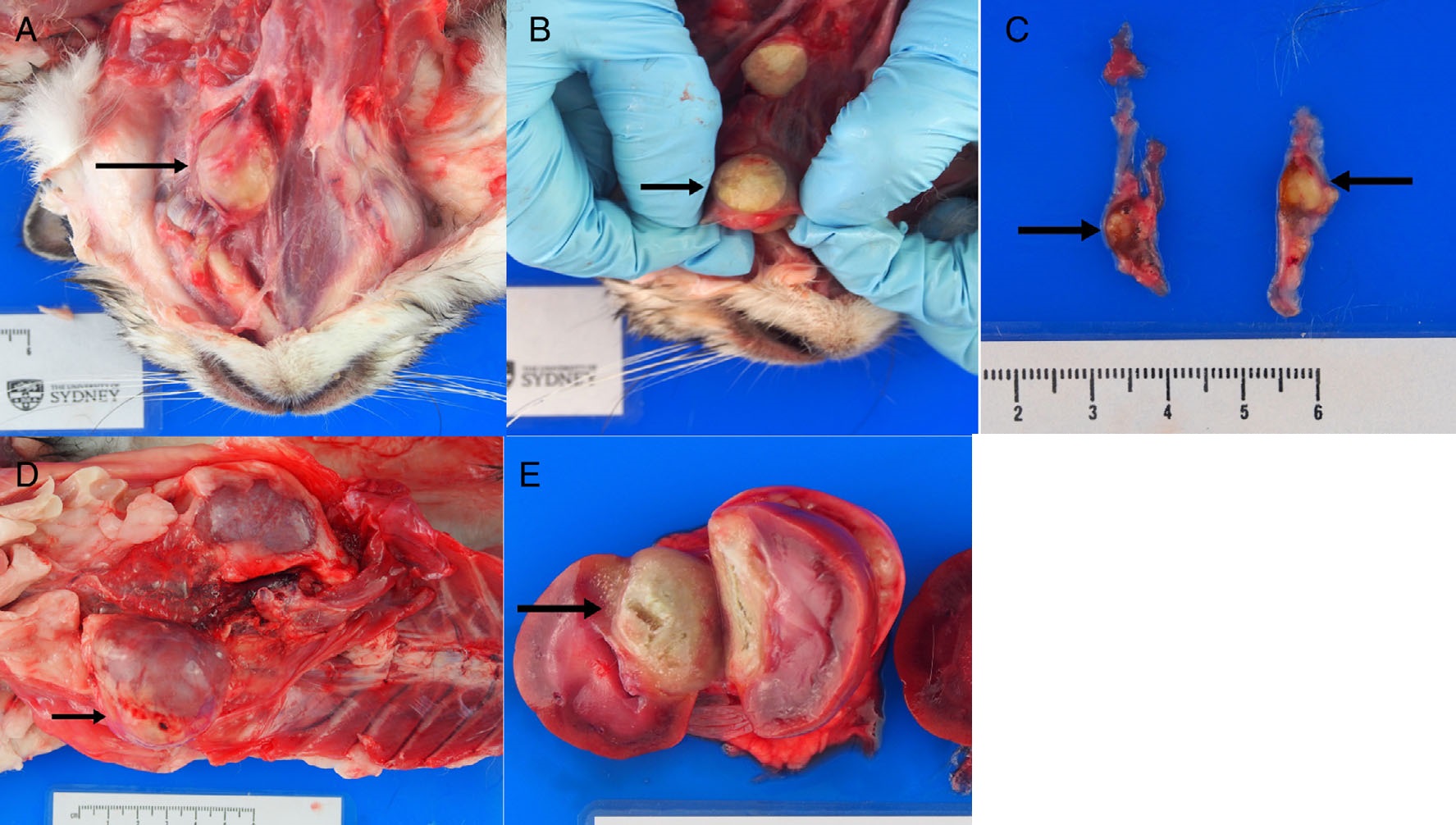
↑ (A)黑色箭头显示左下颌淋巴结明显肿大。(B)左下颌淋巴结明显肿大的切面(黑色箭头)。(C)甲状腺左叶和右叶。每个甲状腺叶上都有一个分界不清、略微坚硬的淡黄色结节(黑色箭头)。(D)原位腹部器官。黑色箭头表示左肾有一个大肿块。(E)尸检时切除的肾脏。黑色箭头表示与左肾相关的巨大肿块的切面。该肿块延伸至下层皮质和髓质,并将其挤出。
与左下颌淋巴结、左肾和甲状腺有关的肿块符合脓性肉芽肿,其中含有大量巨噬细胞,并不同程度地混有淋巴细胞、浆细胞和多形核白细胞。肺、脾和肝也发现了肉芽肿性炎症。在所有有炎症的组织中,ZN染色显示存在组织内耐酸杆菌(2-3 μm),在左肾和下颌淋巴结组织中最为常见(下图F)。在左肾和右肾中也观察到血管内(大静脉)细胞外耐酸杆菌(下图AB)。
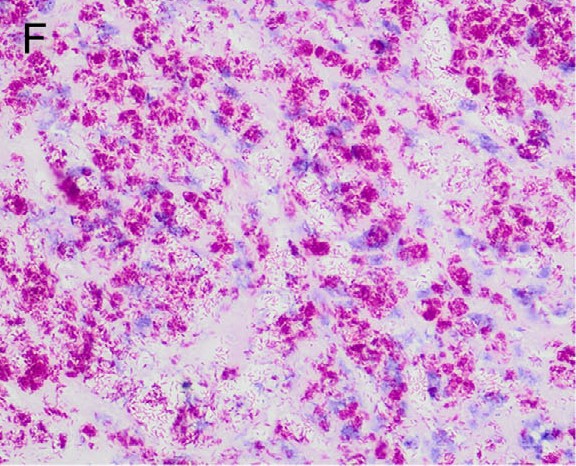
↑ (F)左肾肉芽肿的高倍显微照片,用ZN染色法突出显示耐酸杆菌。图像显示病变部位有大量呈阳性染色的细胞内耐酸杆菌。
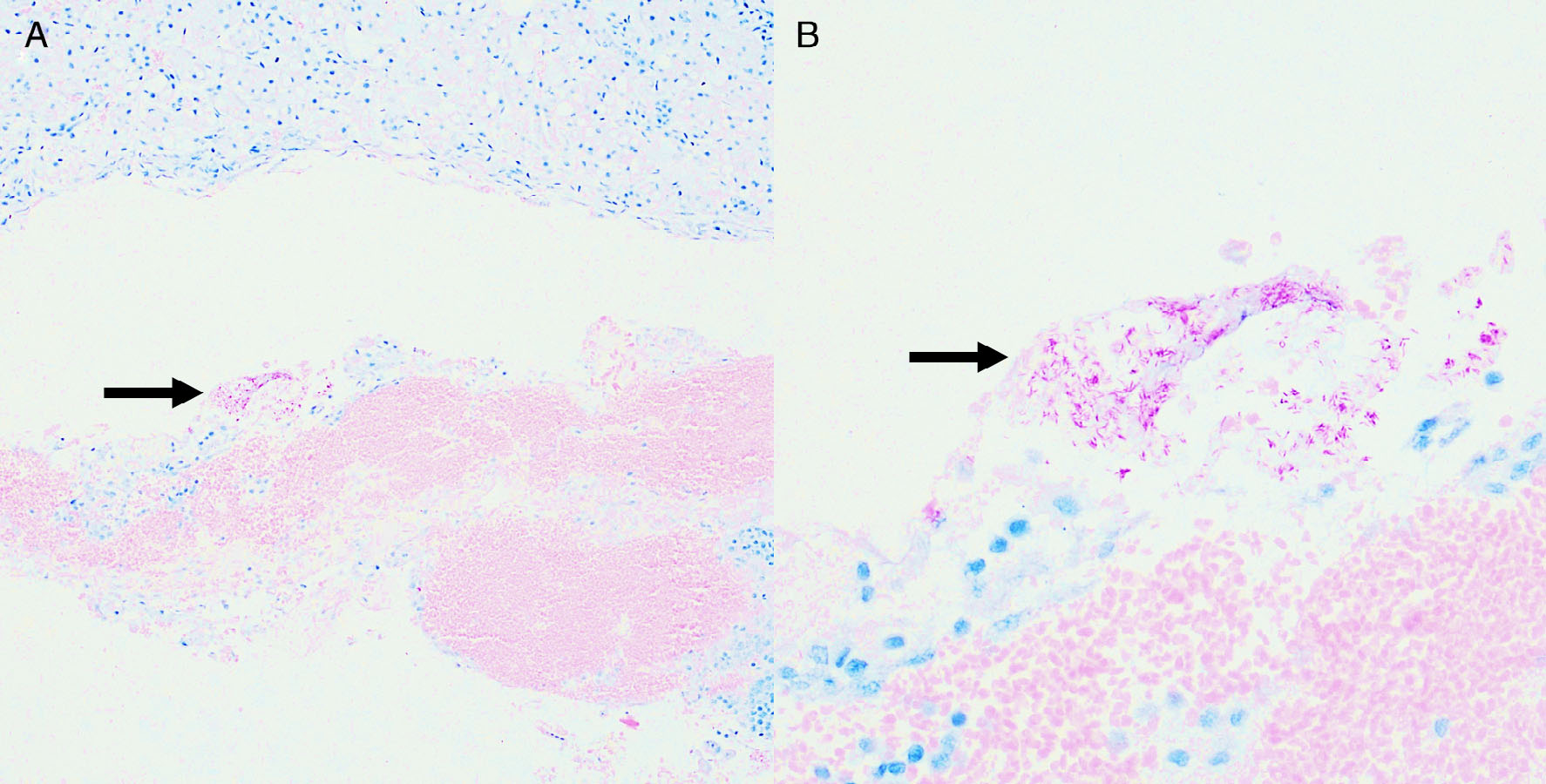
↑ (A)肾血管的低倍显微照片,用ZN染色法染色以突出显示耐酸菌。黑色箭头显示血管腔内有一簇耐酸杆菌。(B)同一切片的高倍显微照片。黑色箭头显示血管腔内有一簇耐酸杆菌。
对样本进行了分枝杆菌培养和PCR检测,所有样本的鸟-胞内分枝杆菌复合群(MAC)检测结果均为阳性。样本分别在37℃和30℃下培养,通过金胺染色,所有样本的直接涂片均呈阳性。37℃培养下在7天(淋巴结和肾脏)、9天(肺、肝脏和甲状腺)和20天(脾脏)时对抗酸杆菌呈阳性。
04 讨论
由于分枝杆菌感染在环境中分布广泛且难以治疗,因此对人和动物都是一项重大的全球性健康挑战[1,2]。治疗的复杂性是由多种因素共同造成的,其中包括必须使用多种药物治疗(通常疗程较长)、存在内在和获得性耐药、经济挑战、长期给猫用药的困难以及某些药物的潜在毒性[3,4]。分枝杆菌在宿主亲和性和致病潜力方面存在很大差异[1,2,4-7]。
分枝杆菌是一种生长缓慢的生物,需要特殊的培养基才能达到最佳生长状态。因此,最常见的诊断方法是通过细胞学和/或组织学检查直接观察区域内的“耐酸”杆菌(AFB)、DiffQuik染色细胞学制剂中的阴性染色杆菌以及分子技术,如特定基因靶点的聚合酶链式反应(PCR),然后对产生的扩增子进行序列分析[4,6]。由于难以对分枝杆菌进行明确诊断和分型,导致诊断和治疗具有挑战性[3]。尤其是考虑到不同分枝杆菌种类对药物的敏感性可能不同[3]。
在猫身上,分枝杆菌感染通常会引起皮肤感染,根据其生物学行为通常可分为三大类——结核复合群、非结核分枝杆菌(NTM)群和日益复杂的“猫犬麻风病群”[2,4-6,8]。结核复合群包括结核分枝杆菌、牛结核分枝杆菌和微小分枝杆菌[4,6,9]。
结核分枝杆菌主要是人类病原体,是与人类结核病相关的致病病原体[1,4,6]。在猫中,感染结核分枝杆菌的情况并不常见,但在摄入未接受肉类检查的受感染野味(如鹿肉)后也可能发生[10]。猫结核病通常表现为皮肤损伤,较少见的是肺部或腹部受累的全身性疾病[4,6]。牛结核分枝杆菌可感染牛、狗、猫、獾和负鼠等宿主以及人类。历史上,它曾通过饮用未经巴氏消毒的牛奶传播给人和猫[1,6,11]。微小分枝杆菌最常见的致病原因是下颌淋巴结病和/或易被动物咬伤部位的皮肤病变,如面部、腿部和尾根部[6]。
非结核分枝杆菌群由大量分枝杆菌种类组成,其中最重要的是鸟-胞内分枝杆菌复合群(M. avium-intracellulare complex,MAC),该菌群包括鸟分枝杆菌鸟亚种、M. avium subsp. Hominissuis和鸟分枝杆菌副结核亚种(牛羊约翰氏病的病原体)[4-6,8]。
MAC是机会性病原体,很少在猫中引起肉芽肿性疾病,但一旦发病,要么与免疫功能正常宿主的皮肤和皮下局部感染有关(如猫抓伤后),要么与免疫功能低下宿主的播散性疾病有关,如遗传倾向不明的阿比西尼亚猫[4-6,12]。
在以前的猫播散性鸟分枝杆菌感染病例报告中,最常受影响的器官包括淋巴结、肺、肝脏和脾脏[12]。其他不常见或极少报道的器官包括骨髓、肠、肾、网膜、脑、肠系膜、腹膜、外阴、胰腺,之前有一例报道称甲状腺受累[12,13]。
猫犬麻风病群包括鼠麻风分枝杆菌(M. lepraemurium)、M. visible、M. tarwinense、M. lepraefelis和犬麻风肉芽肿病原体[4,6]。溃疡分枝杆菌(M. ulcerans)是人类布路里溃疡的病原体,以前也有报道称猫感染该菌后会形成皮下肉芽肿[14]。
本报告描述了一例罕见的由鸟分枝杆菌引起的猫播散性分枝杆菌病,病变分布不典型。该病例还罕见地记录了甲状腺受累以及在肾周出现一个巨大的富含抗酸杆菌的肉芽肿,这也支持了该病例的非典型分布[5,12,13]。因此,腹内肿块和/或淋巴结肿大的患者应考虑全身性分枝杆菌病,尤其是有皮肤病史或接受过免疫抑制治疗的患者。
文献来源:Teh A, Robertson J, Donahoe SL, Crighton T, Boyd S, Malik R. Atypical presentation of disseminated mycobacteriosis due to Mycobacterium avium in an aged cat. Aust Vet J. 2024 Dec 22.
参考文献
1. LoBue PA, Enarson DA, Thoen CO. Tuberculosis in humans and animals: an overview. Int J Tuberc Lung Dis 2010;14:1075–1078.
2. Munro MJL, Byrne BA, Sykes JE. Feline mycobacterial disease in northern California: epidemiology, clinical features, and antimicrobial susceptibility. J Vet Intern Med 2021;35:273–283.
3. Gunn-Moore DA. Feline mycobacterial infections. Vet J 2014;201:230–238.
4. Lloret A, Hartmann K, Pennisi MG et al. Mycobacterioses in cats: ABCD guidelines on prevention and management. J Feline Med Surg 2013;15:591–597.
5. Baral RM, Metcalfe SS, Krockenberger MB et al. Disseminated Mycobacterium avium infection in young cats: overrepresentation of Abyssinian cats. J Feline Med Surg 2006;8:23–44.
6. Maxie MG. Introduction to the diagnostic process. In: Jubb, Kennedy, and Palmer’s pathology of domestic animals volume 1. 6th edn. El Sevier, Missouri, 2016.
7. Primm TP, Lucero CA, Falkinham JO 3rd. Health impacts of environmental mycobacteria. Clin Microbiol Rev 2004;17:98–106.
8. To K, Cao R, Yegiazaryan A et al. General overview of nontuberculous mycobacteria opportunistic pathogens: Mycobacterium avium and mycobacterium abscessus. J Clin Med 2020;9:9.
9. O’Halloran C, Barker EN, Hope JC et al. Canine tuberculosis: a review of 18 new and 565 previously reported confirmed cases. Vet J 2024;304:106089.
10. O’Halloran C, Tørnqvist-Johnsen C, Woods G et al. Feline tuberculosis caused by Mycobacterium bovis infection of domestic UK cats associated with feeding a commercial raw food diet. Transbound Emerg Dis 2021;68:2308–2320.
11. Collins ´ AB, Floyd S, Gordon SV et al. Prevalence of Mycobacterium bovis in milk on dairy cattle farms: an international systematic literature review and meta-analysis. Tuberculosis (Edinb) 2022;132:102166.
12. Webster J, Marchesi F, Gunn-Moore D et al. Disseminated Mycobacterium avium infection in a cat on long-term ciclosporin therapy and potential latent infection of an in-contact cat. JFMS Open Rep 2022;8:20551169221109442.
13. Pekkarinen H, Airas N, Savolainen LE et al. Non-tuberculous mycobacteria can cause disseminated Mycobacteriosis in cats. J Comp Pathol 2018;160:1–9.
14. Elsner L, Wayne J, O’Brien CR et al. Localised mycobacterium ulcerans infection in a cat in Australia. J Feline Med Surg 2008;10:407–412.