
| 品种:混种犬 | |
| 年龄:4岁 | |
| 性别:雌 | |
| 诊断:眼眶囊肿 | |
01 主诉及病史
2021年12月就诊,原因是反复出现右眼(OD)眼眶肿胀。
曾在2018年诊断出青光眼后接受了眼球摘除手术。2019年2月出现眼眶肿胀,兽医抽出了清黄色液体。每隔6-9个月,眼眶需要通过人工抽吸引流。直到此次发病前6个月,眼眶每隔3-4周都需要抽吸一次。
02 检查
眼科检查发现,右眼眶外侧有中度絮状、柔软、无痛感的肿胀(下图)。左眼(OS)正常,但有多灶性点状折射性白色角膜翳,考虑为代谢沉积物。

↑ 大体照片,右眼 (OD) 位置疑似有眼眶囊肿。
超声证实眼眶内有一个2.03×1.78 cm囊性结构,并伴有中度回声碎片(下图)。眼科诊断结果为眼眶囊肿。建议进行眼眶探查和手术切除,或进行囊肿造影和化学消融。主人选择了后者。
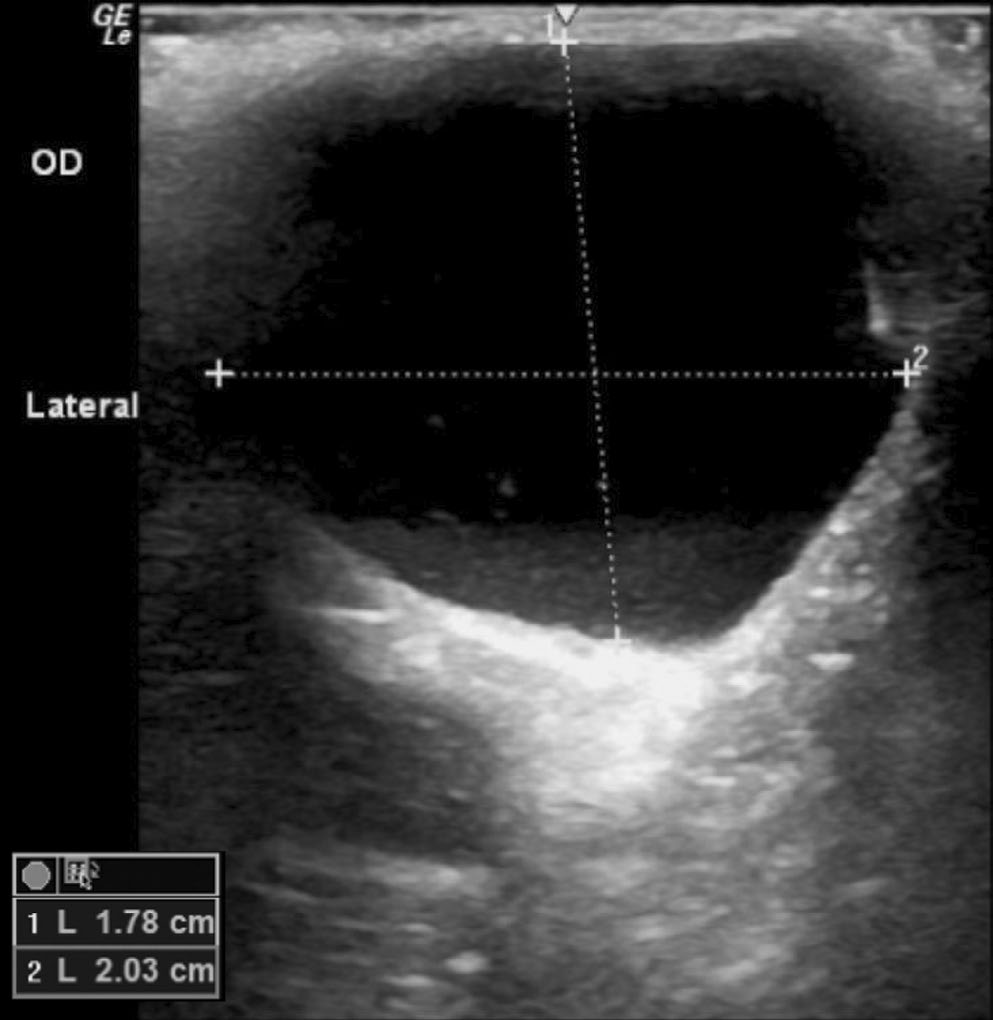
↑ 超声显示,在之前的眼球摘除术部位有一个界限清晰的无回声结构,并伴有中等量的回声碎片,证实为眼眶囊肿。
全血细胞计数和血生化均无异常。
03 治疗
使用布托啡诺(0.3 mg/kg IV)、乙酰丙嗪(10 μg/kg IV)和右美托咪定(7.5 μg/kg IV)进行镇静。
取左侧卧位,暴露右眼眶区域并用稀释的聚维酮碘消毒。在眼眶肿胀外侧放置一根22号导管,抽吸2.5 mL透明液体。随后患者用爪子拍打面部,导致导管脱落。放置了一根新导管,并在数字减影血管造影下通过导管注入碘对比剂(碘海醇240 mg/mL),证实导管不在囊肿内。造影剂充满了眼眶(下图)。
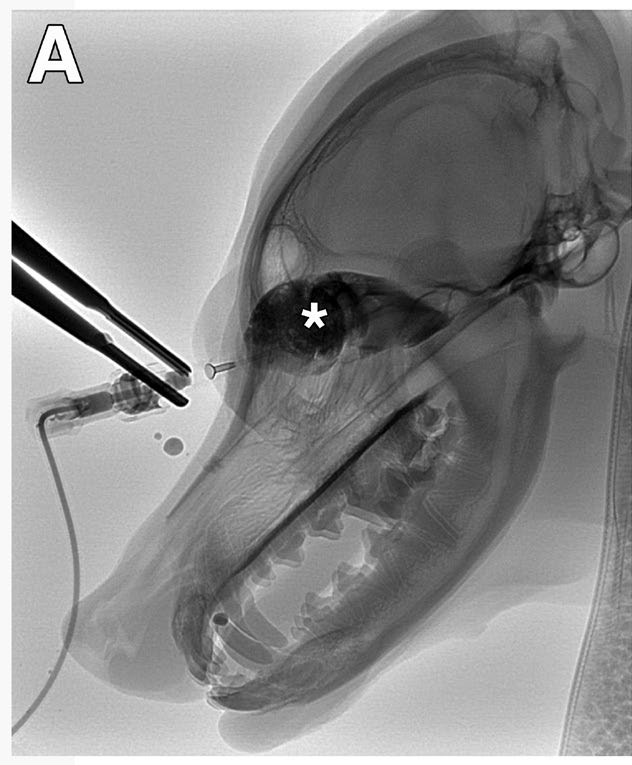
↑ 第一次尝试时的造影显示22 G导管不在囊肿内,因为患者移动后造影剂(*)外渗,因此没有注射1%的聚多卡醇。
由于1%聚多卡醇无法注射,于是用阿替美唑肌注复苏了该犬。收集到的液体经细胞学检查显示为低核细胞液,含有少量蛋白碎屑和少量矿化碎屑。液体的需氧和厌氧培养均未发现生长。
6周后,第二次尝试进行眼眶囊肿造影和注射1%聚多卡醇。接受了美沙酮(1 mg/kg IM)和右美托咪定(5.3 μg/kg IM)的预处理。使用丙泊酚(2.6 mg/kg IV)诱导全麻,并使用吸入式异氟醚维持麻醉。
将22号导管插入眼眶囊肿,抽吸出1.5 mL透明液体。在数字减影透视下,通过导管注入碘对比剂(3 mL碘海醇)。让造影剂停留5分钟,由于没有发现外渗或漏出(下图),从眼眶囊肿中吸出2 mL造影剂,然后立即注射2 mL 1%聚多卡醇。拔出导管,用组织钳闭合通路部位2-3分钟,通路部位未见渗出。
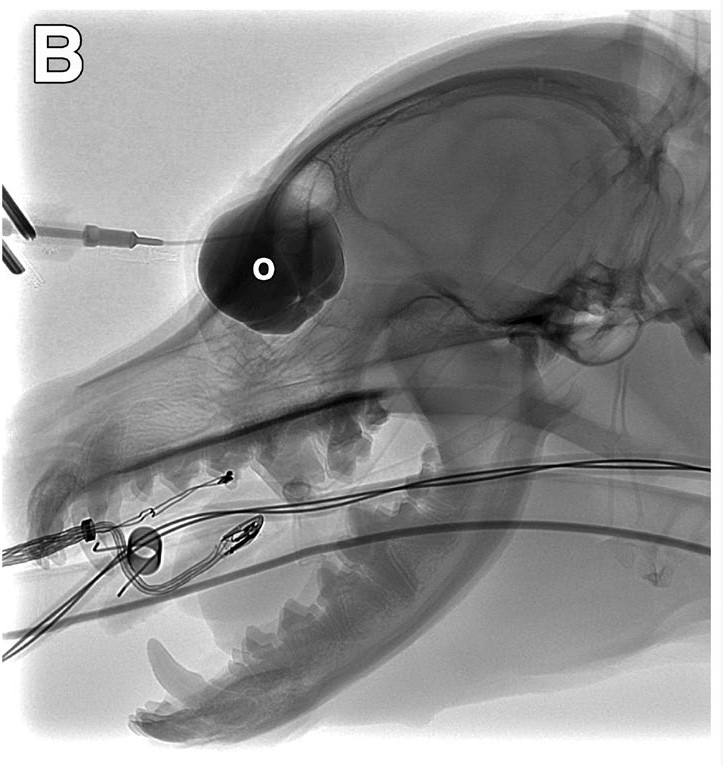
↑ 6周后再次进行的造影显示了眼眶囊肿(o)的位置和范围,没有外渗,因此向该结构注射了1%的聚多卡醇。
04 预后
麻醉后恢复顺利,当天出院,并开始接受为期5天的卡洛芬治疗,每12小时一次,每次2.2 mg/kg(口服)。
眼眶囊肿在24小时内消退,但在注射后25天又复发了。
第一次注射9周后,接受了第二次眶囊肿消融术,术中使用了1%的聚多卡醇。在超声引导下,将22号导管推进眼眶囊肿,吸出0.5 mL黄色清液。采用改良的Tessari方法,以1:4的硬化剂:空气比例制造出1%的聚多卡醇泡沫。将3个6 mL的一次性注射器连接到两个医用三通阀上,在一个注射器中注入1 mL的 1%聚多卡醇,在另外两个注射器中注入4 mL空气。注射器的活塞来回移动20次,以产生泡沫。向眼眶囊肿中注入4 mL 1%聚多卡醇泡沫(下图)。当天出院,并接受了美洛昔康(0.1 mg/kg PO q24h)7天治疗。
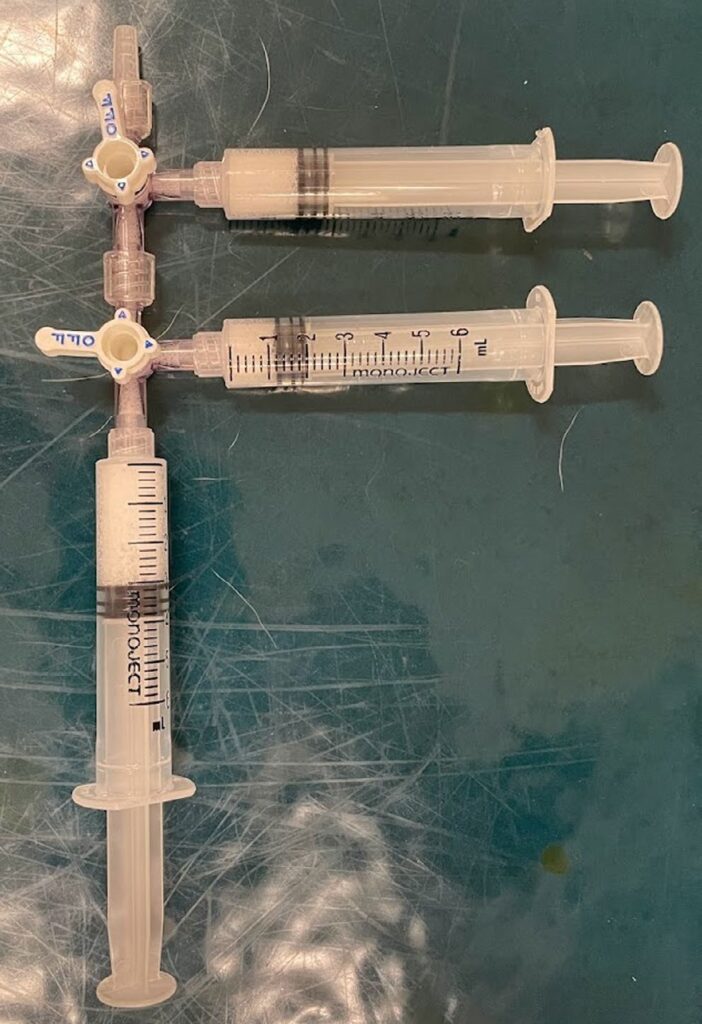
↑ 改良Tessari法生成1%聚多卡醇泡沫。
眼眶囊肿在注射1%聚多卡醇泡沫12周后复发。
注射泡沫后18周,进行了手术切除囊肿。在常规无菌术准备后,用15号刀片在囊性肿物上做了一个线性切口。用腱鞘剪钝性分离并解剖出囊肿。手术过程中,囊肿不慎穿孔,流出透明液体。右眼眶的所有眼眶组织都被切除。用4-0缝线缝合睑板皮下边缘及皮肤。当天出院,出院时使用美洛昔康(0.1 mg/kg,q24h PO)以及加巴喷丁(12.3 mg/kg,q8-12h PO)5天。
病理学检查证明,囊肿由多发性色素性结膜上皮组成。轻微的肉芽肿和淋巴浆细胞炎多发于囊肿上皮。未发现肿瘤细胞。
05 讨论
眼球摘除术是一种常见的外科手术,用于无法接受其他治疗的失明和疼痛的眼球。术后最常见的并发症是出血和肿胀[1]。眼眶囊肿的形成是眼球摘除术中不常见的远期并发症,是由于眼眶分泌组织(泪腺和结膜组织)滞留所致[2]。结膜下眼球摘除术更常见的情况是分泌组织和附件组织未完全切除[3]。此外,眼外伤也是术后眼眶囊肿的诱发因素之一[2]。
囊肿的滞留会影响美观,并可能导致瘘管的形成[2,3]。眼眶囊肿的金标准治疗方法是手术切除囊肿和残留的分泌组织[4],这需要全身麻醉。已报道的其他手术方法包括用染料观察囊肿后进行切除、用注射器针刺、Nd:YAG激光或氩激光、热烧灼或化学烧灼、高频无线电波手术、冷冻疗法和大气低温等离子体[5,6]。
1%的聚多卡醇(羟基聚氧十二烷)是一种合成的长链脂肪醇,是一种常用的硬化剂,它能诱导囊肿内膜裂解,导致纤维化[7]。有报道称,在人、马和狗的眼眶囊肿、血管畸形、泪腺囊肿和淋巴管瘤中使用1%聚多卡醇进行硬化疗法取得了成功[7-10]。额外的镇痛效果使注射过程相对无痛[11]。在人类医学中,经常将硬化剂与造影剂结合使用,以便观察和防止非目标组织因疏忽而发生硬化[12,13]。
据报道,1%聚多卡醇可成功治疗狗的唾液腺粘液瘤[7]、马的眼眶浅静脉畸形[10]和狗的疑似鼻泪管囊肿[17]。然而,反复注射1%聚多卡醇治疗狗的畸形眼眶囊肿并不成功[18]。
在这只狗身上注射1%聚多卡醇可能没有取得持久疗效,因为1%聚多卡醇的作用靶点是内皮,而囊肿的内层组织是结膜上皮。另一个可能的原因是,可能需要注射两次以上才能达到持久效果[15]。虽然1.5 mL的1%聚多卡醇用于5 mL左右的囊肿能成功硬化一只狗的鼻泪管囊肿,但注射总量可能也不够[17]。
总之,本病例报告介绍了使用透视引导下的硬化疗法治疗眼球摘除术后眼眶囊肿的方法。该囊肿对1%聚多卡醇溶液和泡沫治疗均无效。最终,该囊肿被手术切除。治疗失败的原因可能是1%聚多卡醇针对的是内皮,而囊肿内衬是上皮,或者需要注射两次以上。在注射硬化剂之前,对比造影成功地区分了囊肿边缘。本文强调了在眼球摘除手术中彻底切除结膜的重要性。
文献来源:Matthews MR, Jones KEV, Flanders H, Wotman K, Cleymaet A, Scansen BA. Attempted ablation of an orbital cyst in a dog with 1% polidocanol using fluoroscopy and contrast cystography. Vet Ophthalmol. 2025 Jan 7.
参考文献
1. Pot S, Voelter K, Kircher P. Diseases and Surgery of the Canine Orbit. Veterinary Ophthalmology. 6th ed. John Wiley & Sons Inc; 2021: 879-922.
2. Ramsey DT, Fox DB. Surgery of the orbit. Vet Clin North Am Small Anim Pract. 1997; 27(5): 1215-1264.
3. Ward AA, Neaderland MH. Complications from residual adnexal structures following enucleation in three dogs. J Am Vet Med Assoc. 2011; 239(12): 1580-1583.
4. Spiess BM. Diseases and surgery of the canine orbit. Essentials Vet Ophthalmol. 2013;1: 35.
5. Park J, Lee S, Suh E. Removal of conjunctival cyst with high-frequency radio-wave electrosurgery. Can J Ophthalmol. 2015; 50(5): 378-383.
6. Nejat F, Jadidi K, Pirhadi S, Adnani SY, Nabavi NS, Nejat MA. A novel approach to treatment of conjunctival cyst ablation using atmospheric low-temperature plasma. Clin Ophthalmol. 2020; 14: 2525-2532.
7. Stuckey JA, Miller WW, Almond GT. Use of a sclerosing agent (1% polidocanol) to treat an orbital mucocele in a dog. Vet Ophthalmol. 2012; 15(3): 188-193.
8. Steinmetz A, von Bomhard W, Mülling C. Dacryops with extensive lacrimal and maxillary bone defects in four dogs. Vet Ophthalmol. 2021; 24(2): 195-202.
9. Wiegand S, Eivazi B, Zimmermann AP, Sesterhenn AM, Werner JA. Sclerotherapy of lymphangiomas of the head and neck. Head Neck. 2011; 33(11): 1649-1655.
10. Stonex TM, Zibura AE, Andres M, Gilger BC, Oh A. Polidocanol monotherapy for a superficial orbital venous malformation in a horse. Vet Ophthalmol. 2022; 25(5): 412-418.
11. Nagpal S, Goel R. Sclerosing agents in ophthalmology. J Delhi Ophthalmol Soc. 2013; 23(3): 221-226.
12. Chiramel GK, Keshava SN, Moses V, Mammen S, David S, Sen S. Percutaneous sclerotherapy of congenital slow-flow vascular malformations of the orbit. Cardiovasc Intervent Radiol. 2015; 38(2): 270-279.
13. Heit JJ, do HM, Prestigiacomo CJ, et al. Guidelines and parameters: percutaneous sclerotherapy for the treatment of head and neck venous and lymphatic malformations. J Neurointerv Surg. 2017; 9(6): 611-617.
14. Xu J, Wang YF, Chen AW, Wang T, Liu SH. A modified Tessari method for producing more foam. Springerplus. 2016; 5: 129.
15. Horbach SE, Lokhorst MM, Saeed P, de Goüyon Matignon de Pontouraude CM, Rothová A, van der Horst CM. Sclerotherapy for low-flow vascular malformations of the head and neck: a systematic review of sclerosing agents. J Plast Reconstr Aesthet Surg. 2016; 69(3): 295-304.
16. Alòs J, Carreño P, López JA, Estadella B, Serra-Prat M, Marinel-lo J. Efficacy and safety of sclerotherapy using polidocanol foam: a controlled clinical trial. Eur J Vasc Endovasc Surg. 2006; 31(1): 101-107.
17. Zimmerman KL, Stefanacci JD, Greenberg SM. Use of 1% polidocanol and pre- and post-computed tomography for treatment of a suspected nasolacrimal duct cyst in a dog. Vet Ophthalmol. 2019; 22(3): 374-380.