| 品种:孟加拉猫 | |
| 年龄:12岁 | |
| 性别:未知 | |
| 诊断:气性坏疽 | |
01 主诉及病史
因急性后肢瘫痪就诊。
主人称之前没有运动或心肺症状。
02 检查
痛苦且不安,双后肢瘫痪。后肢麻痹无力、发冷,股动脉搏动消失。没有退缩反射和疼痛感知。考虑主动脉血栓栓塞可能性大。
放入氧气笼中,以10升/分的流速输送氧气,随后以5升/分进行肌肉注射布托啡诺以提供镇静、抗焦虑和镇痛。约15分钟后,呼吸稳定,可进行进一步干预。将22号导管置入头静脉,缓慢注射咪达唑仑(0.1 mg/kg)。
全面的体格检查证实后肢发冷,股动脉搏动不足。呼吸频率最初为100次/分,腹部用力增加。胸部听诊显示心音柔和,呼吸音增加,有啰音和喘息声。心率180次/分,听不到心脏杂音或奔马律。
胸部X光片没有显示明显的心脏肥大或明显的腔室扩大,尽管由于弥漫性、斑片状间质性肺影被怀疑肺水肿,心廓在腹侧投影上有些模糊。心脏超声显示左心房扩大,含有自发回声对比。血生化和全血细胞计数均在参考范围内。总血清甲状腺素浓度为22 nmol/L [10-60]。NT-proBNP检测呈阳性。
初始治疗包括静脉注射一次呋塞米(2 mg/kg),然后每小时注射1 mg/kg,直到呼吸频率降至50次/分以下。
超声心动图显示左心房扩张(直径20.8 mm),心室和室间隔壁厚度正常,缩短分数略有降低(21%)(下图)。左心房内可见旋转自发回声。二尖瓣无明显收缩期前运动、隔膜缺损或瓣膜功能不全。左右心室流出道内的血流呈层流。在脉冲多普勒上,由于心动过速,观察到早期和主动的心室充盈波融合,从而无法进行全面的舒张评估。
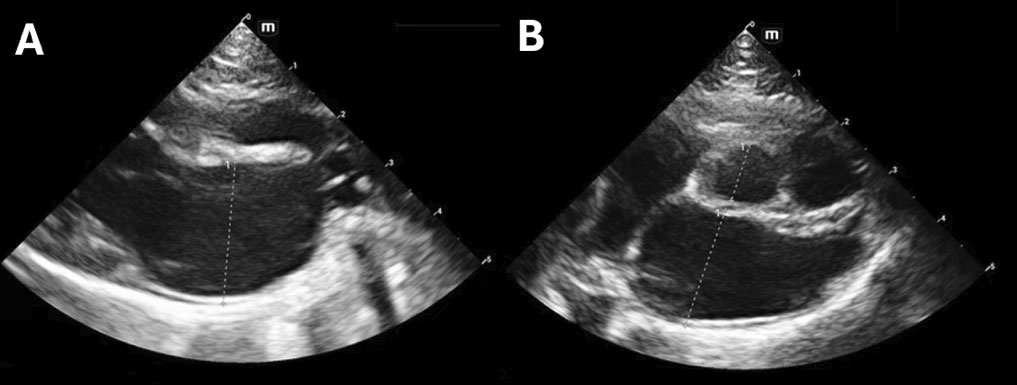
↑ 右胸骨旁长轴(A)和短轴(B)视图显示左心房扩张。
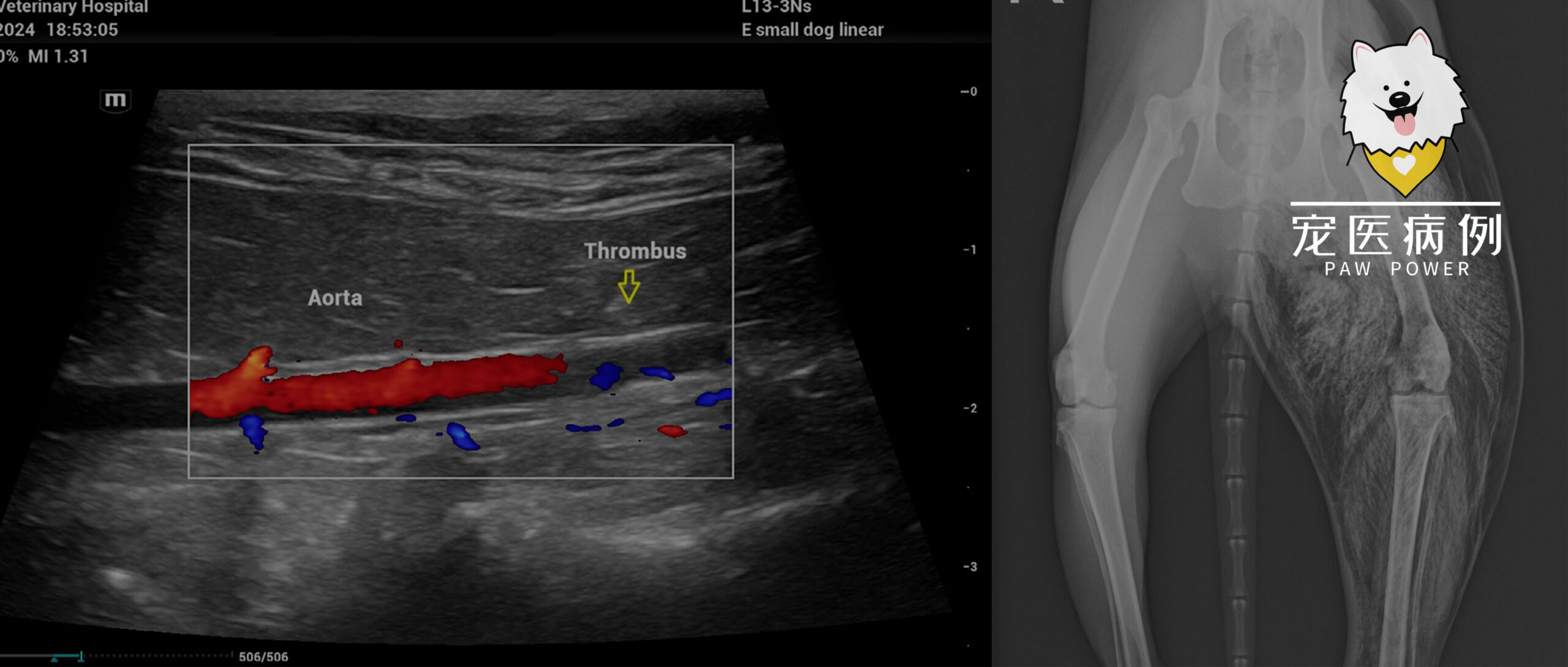
腹部超声显示腹主动脉远端存在高回声病变(下图),远端主动脉中的红色血流多普勒信号突然终止,使得远端主动脉或髂动脉中没有血流。这证实了栓子是后肢瘫痪的原因。
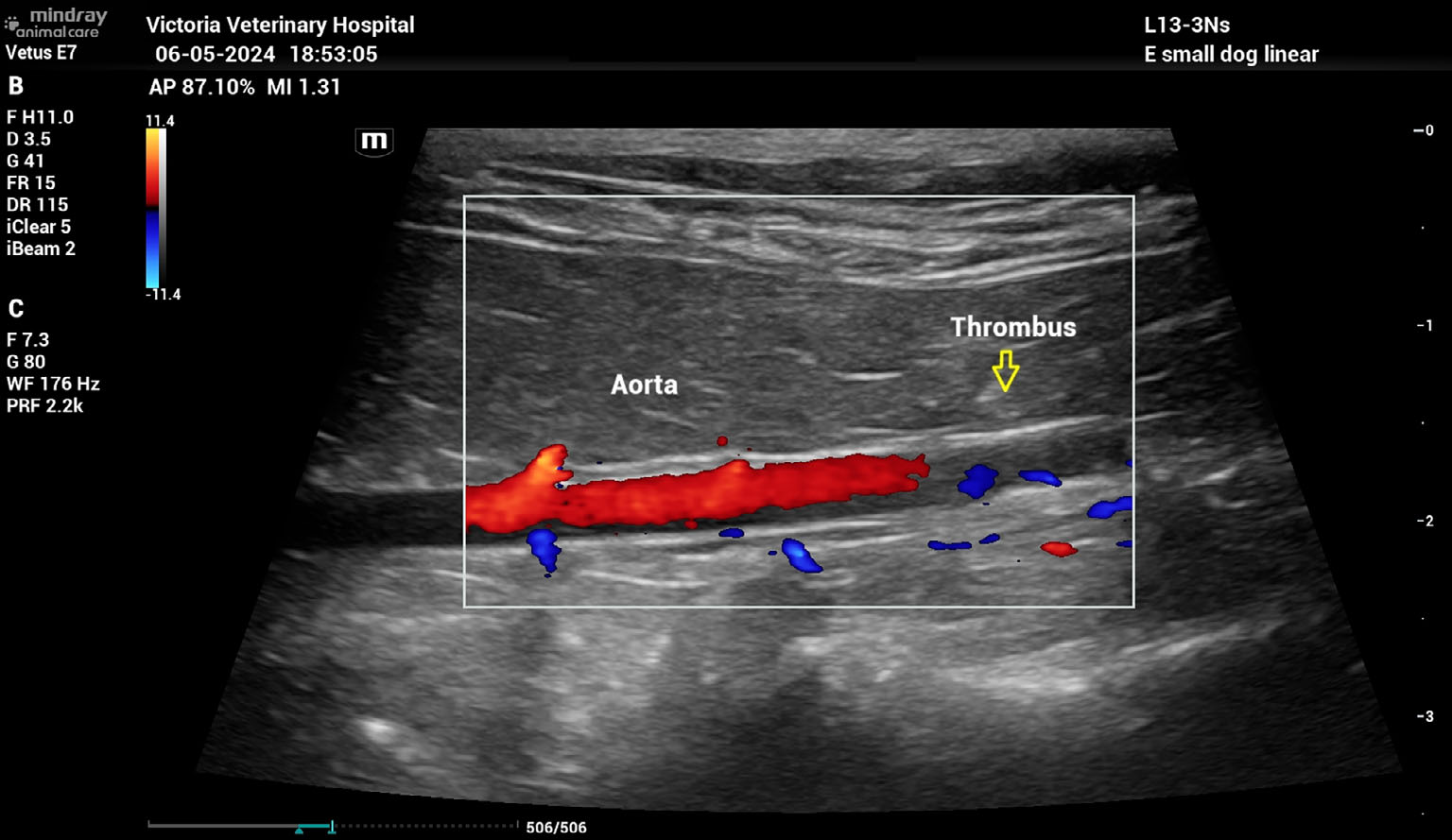
↑ 尾侧腹主动脉的彩色多普勒检查显示,由于远端腹主动脉中存在栓子,血流中断(黄色箭头)。
其他发现包括肾憩室矿化和空肠壁增厚,厚度在2.9-3.2 mm之间,伴弥漫性、中度肌层突出(下图)。
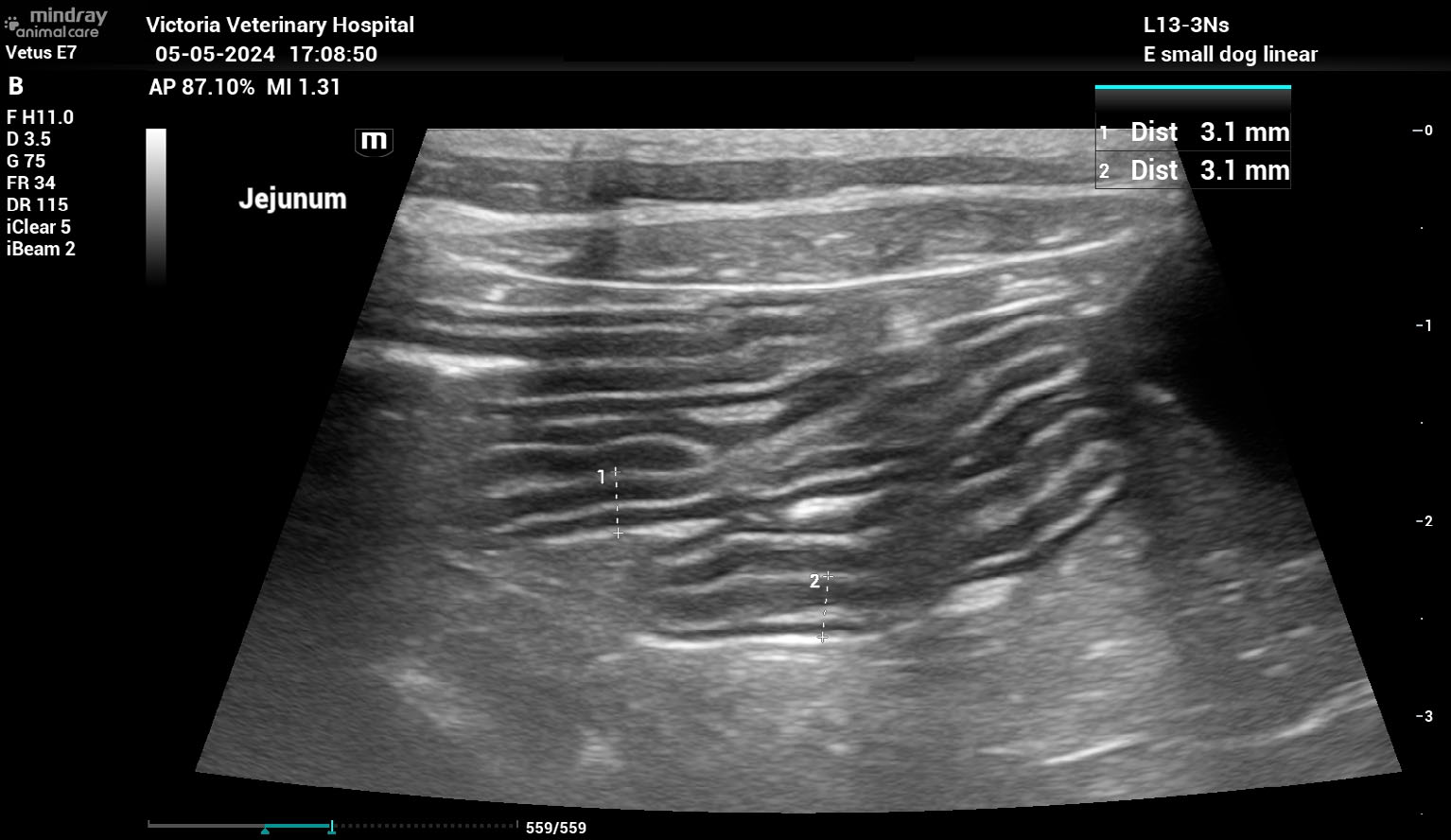
↑ 几个小肠袢的腹部超声图像。注意肠壁弥漫性增厚,肌层突出。
03 治疗
开始对腹主动脉栓塞进行特异性治疗。继续使用呋塞米(1 mg/kg IV q4h),直到呼吸频率降至40次/分以下,然后改为1 mg/kg IV q6h。在治疗方案中分别加入氯吡格雷(18.75 mg PO q24h)、利伐沙班(2.5 mg/kg q24h)和丁丙诺啡(0.02 mg/kg q6h),以促进缓慢进行的溶栓和镇痛。
04 预后
在治疗的前18小时内,临床症状明显改善。第二天早上,呼吸频率降至28次/分。能够站立和行走几步,但有残余的后肢无力和共济失调。使用上述药物方案继续治疗。
18小时后,突然出现极度痛苦,严重呼吸困难、张口呼吸和不断发声。体检发现左后肢明显肿胀,触诊时有“气泡膜”爆裂声。骨盆和后肢的X光片(下图)显示整个左后肢存在广泛的皮下和肌肉内气肿。考虑诊断为非创伤性气肿性肌炎(气性坏疽)。如果不进行紧急手术(通常是截肢)、静脉注射抗生素治疗,最好是高压氧治疗,这种情况会导致极高死亡率。
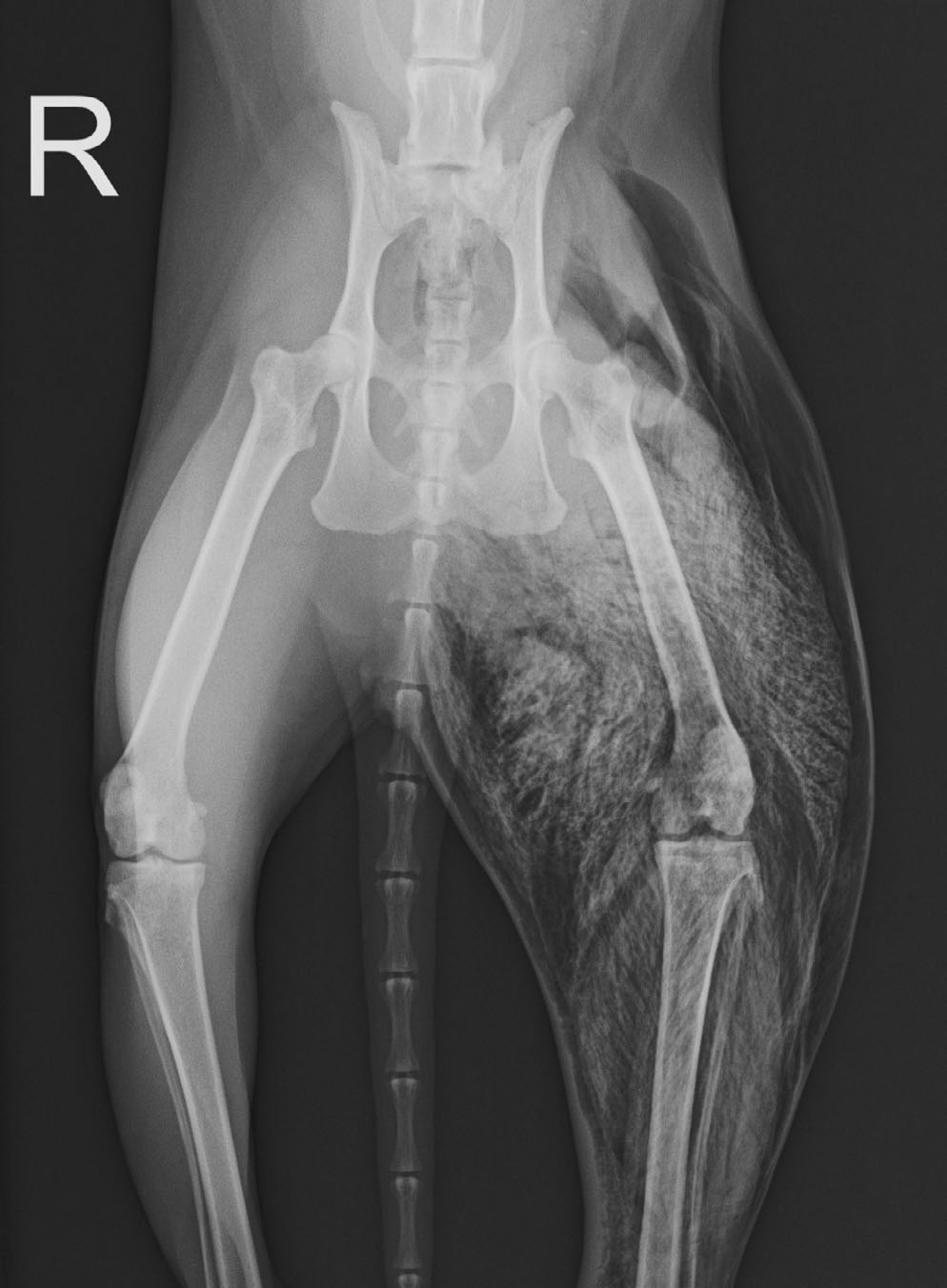
↑ 首次就诊后18小时拍摄的骨盆和后肢的腹侧X光片。
最终主人选择了安乐死。
安乐死后,立即用18 g针头对肢体进行减压,排出恶臭气体。通过细针抽吸从股四头肌群中取出多个样本。对这些吸出物制备的Diff-Quik染色涂片检查发现大量杆状细菌(下图)。
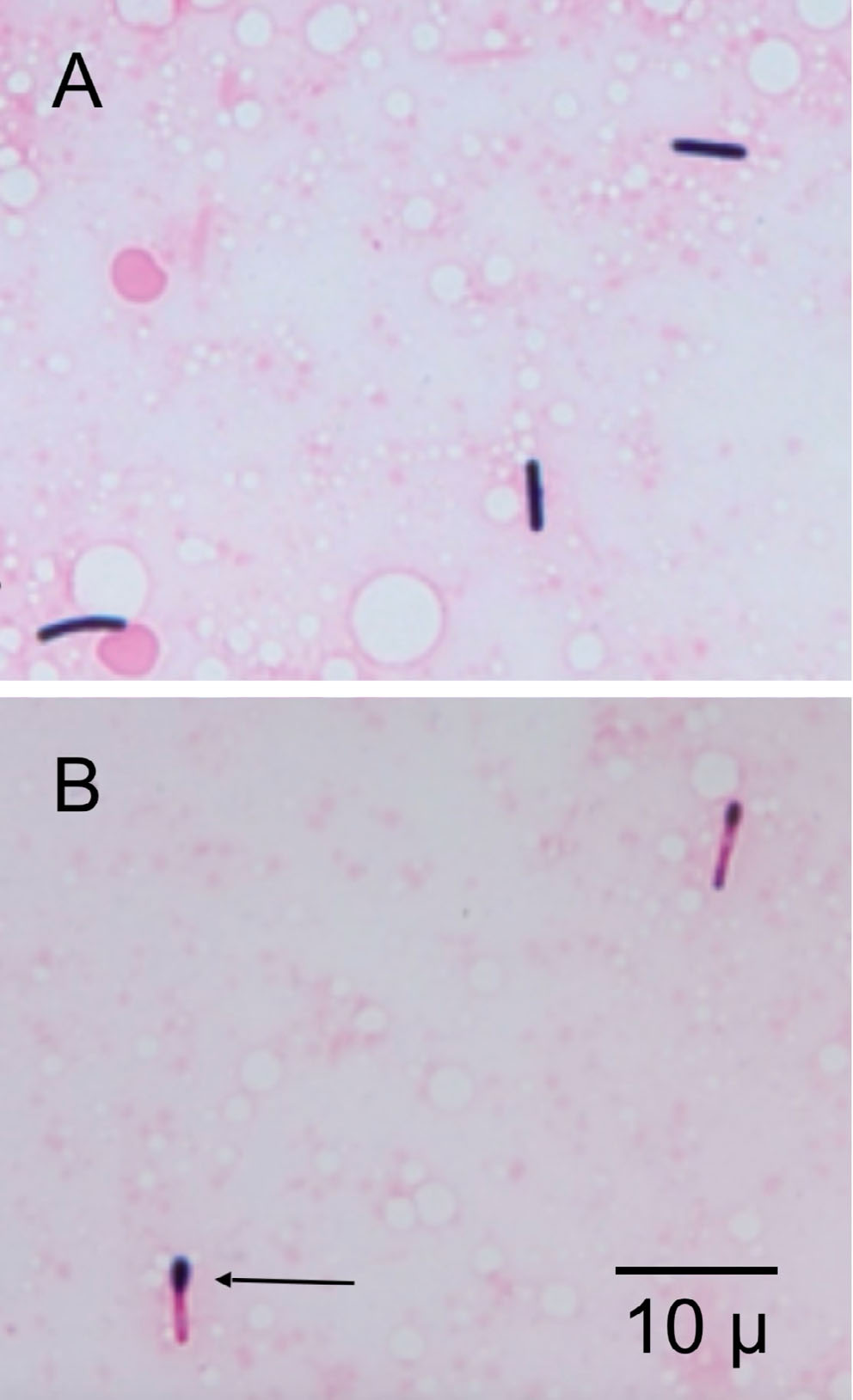
↑ 杆菌通常为革兰氏阳性(A),但溶血梭菌染色为革兰氏阴性(红色),而末端孢子染色为革兰氏阳性(紫色;箭头)(B)。
许多细菌在杆菌末端有阴性染色的透明空间(孢子),高度提示梭菌(下图)。对该样品进行长期厌氧培养后,在培养10天后最终分离出溶血梭状芽孢杆菌(Clostridium haemolyticum)。
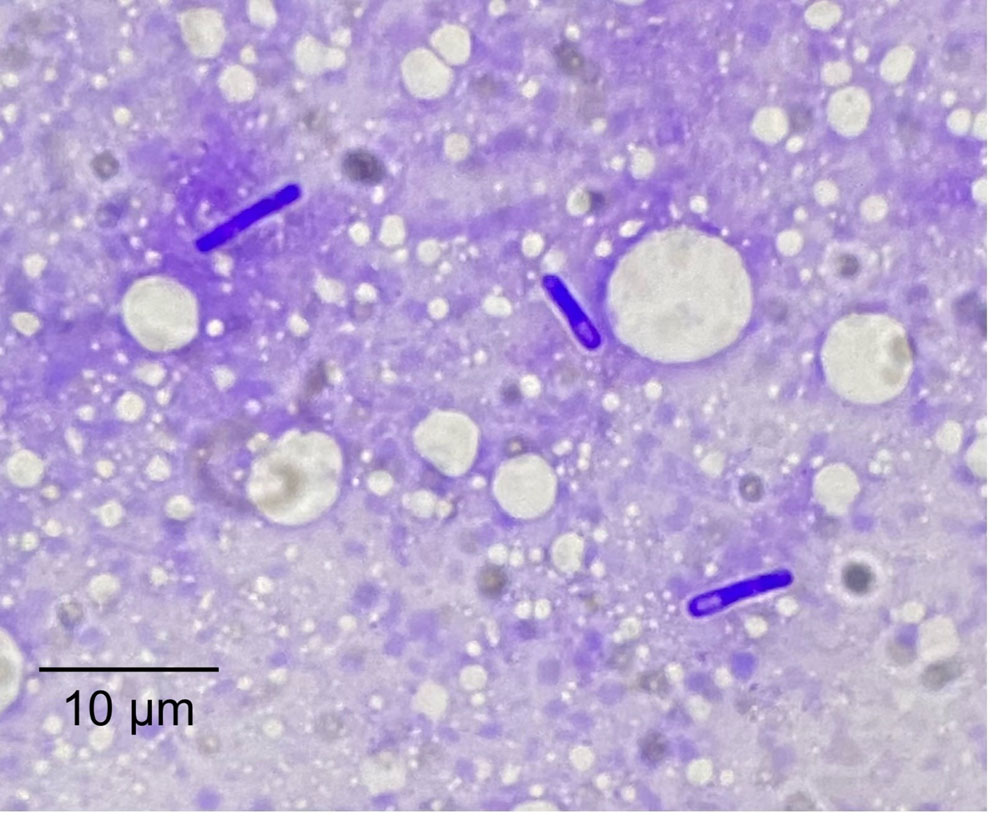
↑ Diff-Quik染色涂片,在空泡背景下显示三种杆菌,其中两种具有终末孢子形成。
05 讨论
本病例患有结构性心脏病、远端主动脉血栓,最终出现了气肿性坏死性梭菌性肌炎。作者认为,对这一发现的一个可能解释如下:梭菌孢子在血栓栓塞事件发生前可能已经在肌肉中休眠,由于血栓引起的缺血,感染梭菌的后肢肌肉的无氧条件有利于孢子萌发、梭菌增殖和肌坏死外毒素的形成,导致气性坏疽的灾难性后果。
溶血梭状芽孢杆菌(Clostridium haemolyticum)是一种产孢革兰氏阳性厌氧杆菌,被认为是最挑剔和对氧气敏感的厌氧菌之一[4]。梭菌通常存在于土壤和死水中,是健康动物大肠微生物组的常见成分[5]。
作为专性厌氧菌,它们很少在大肠外发生临床相关感染,而不会引发缺血/低氧血症、免疫功能低下。作为一个群体,梭状芽孢杆菌产生了许多强大的外毒素,这些外毒素与一系列疾病有关,包括一些人类和动物最快速进展和最致命的感染[4,5]。
在人类中,梭菌伤口感染在历史上与战场损伤有关,其中与战壕战相关的积水和污染土壤与创伤性损伤的厌氧环境共同导致了可怕的气性坏疽(梭菌性肌坏死)[6]。梭菌性肌坏死在人类中仍然是一种罕见但公认的疾病,最常见于创伤[6,7]。非创伤性梭菌感染可能与免疫功能低下状态(如艾滋病)或导致胃肠道屏障功能降低的疾病(如胃肠道肿瘤、溃疡或炎症性肠病)有关[6-8]。
在伴侣动物中,梭菌性肌坏死的报告很少见。个别病例报告描述了狗中与各种梭菌相关的非创伤性肺气肿性肌炎的发生,这些疾病总是致命的[15-17]。在之前的一份关于患有主动脉栓塞的猫发生梭菌性气性坏疽的报告中,分离出了新生梭菌和索德利梭菌[3]。该病例的作者没有提出梭菌孢子从肠道传播到肌肉的可能机制[3]。
作者认为,在获得进一步数据之前,应考虑将对梭菌具有良好活性的杀菌抗生素(如静脉注射青霉素、阿莫西林、甲硝唑或克林霉素)作为细菌预防纳入猫主动脉栓塞管理的护理中。对管理的改进,包括越来越广泛地使用氯吡格雷和Xa类抑制剂的联合治疗,促使人们重新考虑主动脉栓塞的预后。有证据表明,通过仔细管理,在某些情况下可以成功治疗[1,2]。由于梭菌在正常猫肌肉中的患病率尚不清楚,因此有必要进一步研究以确定这一发现的患病率。
文献来源:Simpson C, Baranger-Ete M, Leung J, Worthing K, Malik R. Gas gangrene due to Clostridium haemolyticum in a cat with aortic thromboembolism treated using clopidogrel and rivaroxaban. Aust Vet J. 2024 Dec 30.
参考文献
1. Guillaumin J. Feline aortic thromboembolism, recent advances and future prospects. J Feline Med Surg 2024;26:1–13.
2. Lo ST, Walker AL, Georges CJ et al. Stern JA dual therapy with clopidogrel and rivaroxaban in cats with thromboembolic disease. J Feline Med Surg 2022; 24(4):277–283.
3. Schiffer SP, Miller LM. Gas gangrene in a cat with aortic embolism. J Small Anim Pract 1982;23:359–363.
4. Hatheway CL. Toxigenic clostridia. Clin Microbiol Rev 1990;3:66–98.
5. Oliveira CA, Silva ROS, Lobato FCF et al. Uzal FA gas gangrene in mammals: a review. J Vet Diagn Invest 2020;32:175–183.
6. Stevens DL. Bryant AE necrotizing soft-tissue infections. N Engl J Med 2017; 377:2253–2265.
7. Leiblein M, Wagner N, Adam EH et al. Nau C clostridial gas gangrene – a rare but deadly infection: case series and comparison to other necrotizing soft tissue infections. Orthop Surg 2020;12:1733–1747.
8. Srivastava I, Aldape MJ, Bryant AE et al. Septicum gas gangrene: a literature review. Anaerobe 2017;48:165–171.
9. Hussein HA, El-Amir YO, Aamer AA et al. Bacillary hemoglobinuria in dairy cows: clinical, hematological, biochemical, and pathological alterations. Comp Clin Pathol 2013;22:1137–1143.
10. Navarro MA, Dutra F, Briano C et al. Uzal FA pathology of naturally occurring bacillary hemoglobinuria in cattle. Vet Pathol 2017;54(3):457–466.
11. Sousa AIJ, Cleideanny CG, Prhiscylla SP et al. A review of the agent and Management of the Disease in Brazil. Animals 2024;14(4):638.
12. Abreu CC, Blanchard PC, Adaska JM et al. Pathology of blackleg in cattle in California, 1991–2015. J Vet Diagn Invest 2018;30(6):894–901.
13. Valberg SJ, McKinnon AO. Clostridial cellulitis in the horse: a report of five cases. Can Vet J 1984;25(2):67–71.
14. Vengust M, Arroyo LG, Weese JS. Baird JD preliminary evidence for dormant clostridial spores in equine skeletal muscle. Equine Vet J 2003;35(5): 514–516.
15. Ribeiro MG, Silva ROS, Pires PS et al. Lobato FCF myonecrosis by clostridium septicum in a dog, diagnosed by a new multiplex-PCR. Anaerobe 2012;18: 504–507.
16. Salari Sedigh H, Rajabioun M, Razmyar J. Kazemi Mehrjerdi H an unusual necrotic myositis by Clostridium perfringens in a German shepherd dog: a clinical report, bacteriological and molecular identification. Vet Res Forum 2015;6(4): 349–353.
17. Sprohnle-Barrera CH, Gibson JS, Price R et al. Allavena RE fatal nontraumatic gas gangrene caused by Clostridium perfringens type a in a Siberian husky dog. J Vet Diagn Invest 2022;34:518–522.