
| 品种:混种犬 | |
| 年龄:3岁 | |
| 性别:雌 | |
| 诊断:胆绿素尿 | |
01 主诉及病史
4个月大时首次出现绿色尿液(下图)和再生性贫血。

家族病史不详。犬种血统测试报告显示,该犬可能混有的前四个犬种如下:边境牧羊犬(26%)、美国斯塔福德郡梗(19%)、拉布拉多猎犬(16%)和美国比特斗牛梗(11%)。
既往就诊时的尿液分析结果显示尿液持续呈绿色(尿培养无细菌生长)。全血细胞计数显示持续大红细胞低色素再生性贫血,血细胞比容25-33% [37-62],血清γ-谷氨酰转移酶 (GGT) 活性升高(4-40 IU/L [0-11])。
腹部超声显示肝实质回声减弱,双侧肾上腺较小。对肝脏抽吸样本进行的细胞学评估显示,肝细胞空泡化符合糖原或水化改变,非典型色素堆积符合铁增加和胆汁淤积,存在单核炎症和轻度髓外造血。脾脏抽吸物的细胞学评估显示,反应性淋巴组织伴有明显的髓外造血。
血清铁轻度增高(311 μg/dL [77-253])。寄生虫PCR结果均为阴性。不存在之前报道的导致磷酸果糖激酶缺乏症的两种基因变异。曾接受抗菌素、免疫抑制剂和其他药物治疗,但未能解决绿色尿和贫血问题。
02 检查
体重10.1千克。体格检查发现粘膜和巩膜有轻微灰褐色(下图),粪便呈浅棕色,略带绿色,肌肉轻度弥漫性萎缩。
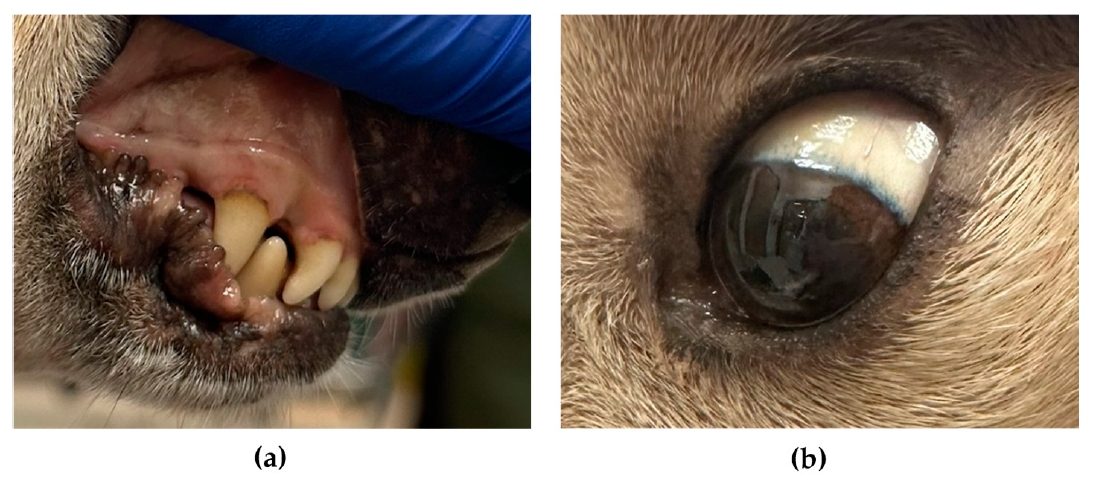
↑ 黏膜(a)和巩膜(b)略呈灰褐色。
在初次评估和为期9个月的两次随访中进行了多项诊断。尿液检查显示尿液呈绿色,并伴有蛋白尿(1+至2+)和胆红素尿(1+至2+)。全血细胞计数结果为大红细胞低色素再生性贫血(血细胞比容25-32% [40-55])。血清胆红素浓度在参考区间内(0.1 mg/dL [0.0-0.2]),但谷丙转氨酶持续升高(16-23 IU/L [0-9])。
还出现了与皮质类固醇治疗一致的其他轻度异常(血小板增多、中性粒细胞增多、单核细胞增多、血清葡萄糖浓度和碱性磷酸酶活性升高),这些异常在泼尼松龙治疗前并不存在。餐前和餐后血清胆汁酸浓度均正常。
腹部超声显示胆道系统正常(未发现胆结石),肝脏弥漫性高回声,有多个低回声结节,脾脏轻度网状结构,有几个大小不等的低回声结节,肾上腺轻度变小。
肝脏细胞学检查发现轻度肝细胞稀疏化、轻度淋巴细胞炎症和多种形态的色素明显聚集,包括棕黑色球状、蓝黑色针状和无定形绿蓝色(下图A-C)。部分色素的霍氏胆红素呈阳性,表明存在胆红素(下图D)。铜在罗丹宁染色法中没有记录(下图E),但一些细胞内和细胞外色素在普鲁士蓝中呈阳性(下图F)。脾脏细胞学检查显示有明显的铁积聚和髓外造血。
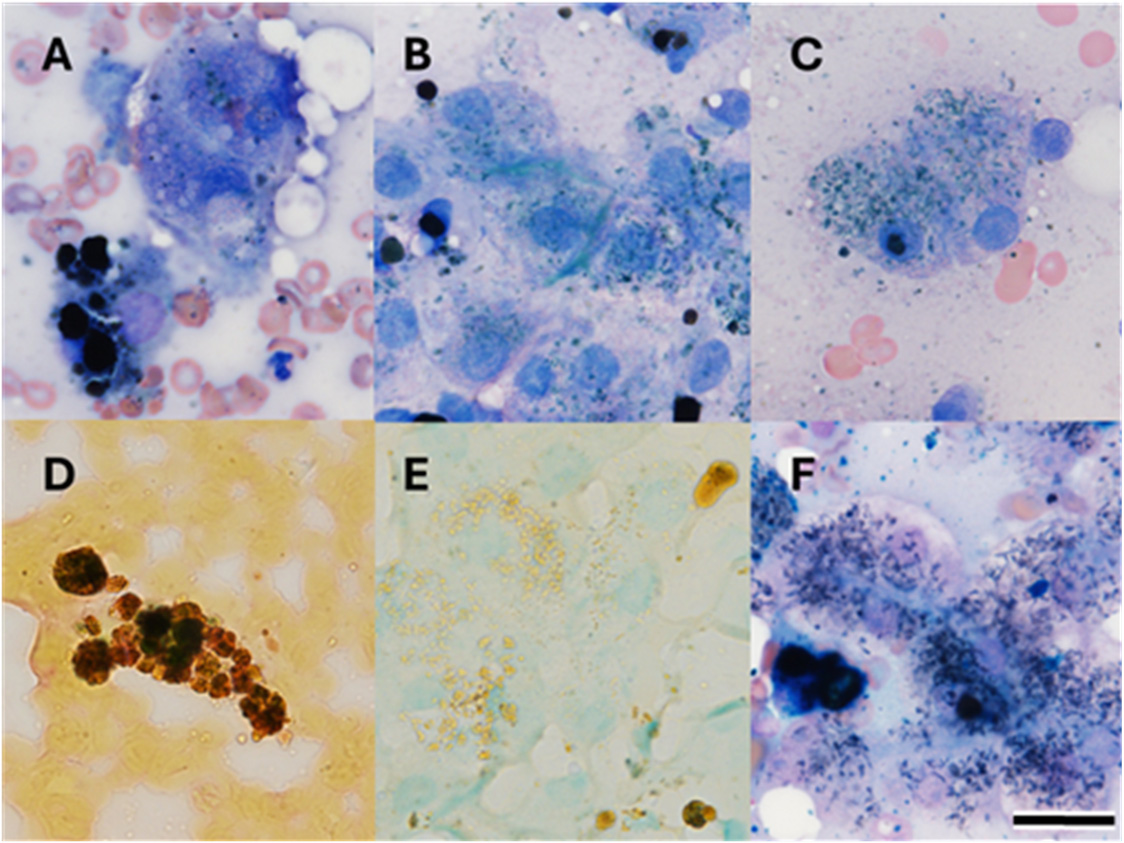
↑ 肝脏抽吸物显微照片显示明显的色素堆积。(A-C) Wright-Giemsa染色。(D)霍氏胆红素。(E)罗丹宁染色。(F)普鲁士蓝染色。
由于尿液持续呈绿色,且没有发现外部诱因,因此怀疑是遗传性胆绿素尿。目前还不清楚贫血和肝脏病变是与遗传性红细胞缺陷有关还是由遗传性红细胞缺陷引起。
 | 品种:混种犬 |
| 年龄:3岁 | |
| 性别:雄 | |
| 诊断:胆绿素尿 | |
03 主诉及病史
因从出生起尿液和粪便呈绿色(下图)就诊。

家族史不详,也未进行犬种血统研究。之前的多次尿检结果显示,尿液颜色从黄色到绿色不等,间歇性检出蛋白(微量)。胆红素一直呈阴性。尿培养无细菌生长。寄生虫抗原阴性。
多次全血细胞计数正常,血细胞比容53-58% [36-60],血生化结果也正常,其中胆红素为0.1 mg/dL [0.0-0.3]。餐前和餐后胆汁酸、甲状腺素、钴胺素、叶酸和Spec cPL的血清浓度均在参考区间内。胰蛋白酶样免疫反应升高(50 µg/L [5-35])。在急性饮食不节制后,曾进行过一次腹部X光检查,未发现异常。对于绿色尿液或粪便的治疗没有采取任何治疗措施。
04 检查
体重20.6千克。体格检查结果正常。寄生虫检测结果均为阴性。由于尿液持续呈绿色,且未找到诱发因素,因此怀疑该犬患有遗传性胆绿素尿症。
05 靶向代谢组学分析
对上述两个病例及各自的对照组(年龄相差2岁内、性别匹配)尿样中的胆绿素和胆红素浓度进行了靶向代谢组学定量分析。用于代谢组学研究的尿液样本分别采集自病例1的4.5岁时和病例2的3.9岁时,病例1的尿液样本呈绿色,而病例2的尿液样本呈黄色(下图)。

病例1和病例2的尿胆绿素/肌酐比率分别是对照组的43倍和10倍。相比之下,病例和对照组之间的尿胆红素/肌酐比率相似。
06 基因检测
对病例1的全外显子组测序结果进行了BLVRA变异分析。发现在chr18:6,532,022-6,551,313处有一个19,292 bp的基因缺失,横跨BLVRA 5-7号外显子。预测该变异会导致截短的mRNA产物。缺失的外显子涉及整个胆绿素还原酶催化结构域(下图),因此预测该缺失将导致酶活性丧失。
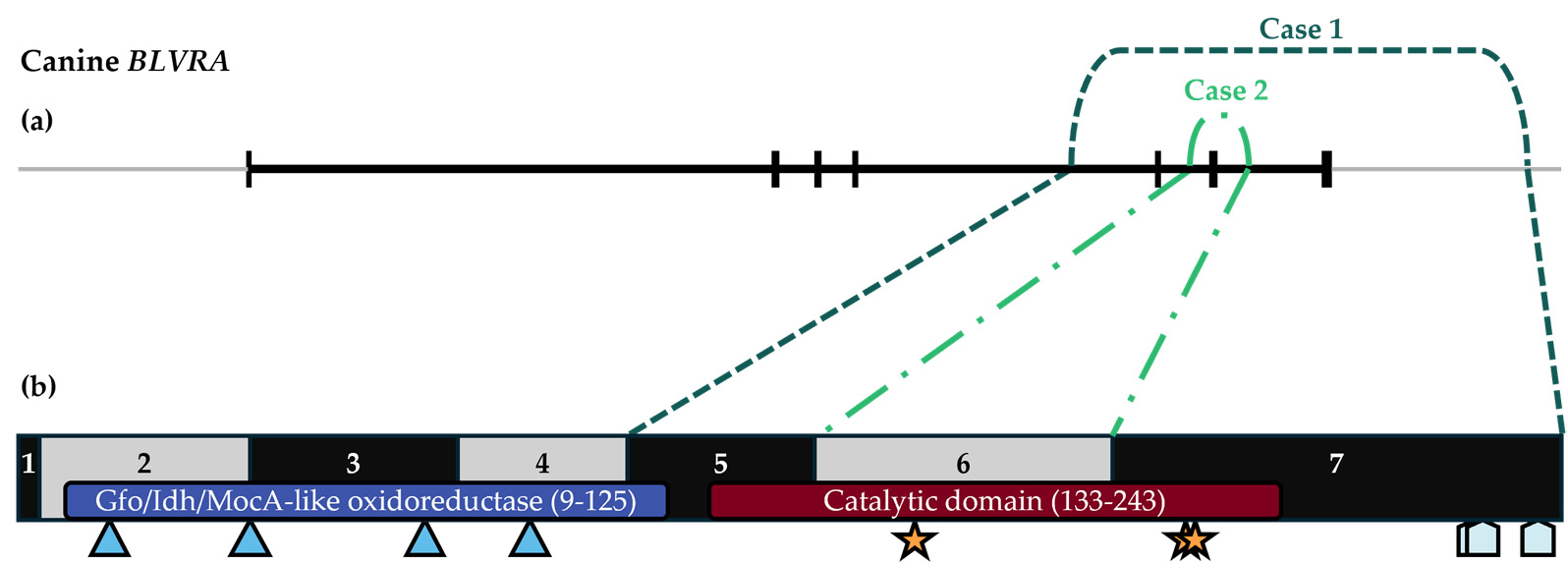
↑ 病例1和病例2基因缺失示意图。(a)BLVRA基因以黑色显示,垂直段线条代表外显子,病例1和病例2基因缺失的边界分别以深绿色(虚线)和浅绿色(点划线)显示;浅灰色线代表上下游基因间序列。(b)BLVRA蛋白显示了Gfo/Idh/MocA样氧化还原酶(蓝条)和催化结构域(红条)、NADP+结合位点(蓝色三角形)、羧基口袋残基(星形)和Zn2+结合位点(浅蓝色五边形)的位置。
通过对外周血RNA的cDNA测序分析,证实病例2的BLVRA基因缺失导致第6号外显子缺失(上图)。
07 讨论
绿色尿在哺乳动物中很少见。如果出现绿色尿,通常是一过性的,可能由食物色素、药物(如丙泊酚、阿米替林、亚甲蓝)或假单胞菌尿路感染引起[1-6]。持续性或复发性绿色尿极为罕见,与血红素分解过程中的先天性错误引起的胆绿素尿(biliverdinuria)一致。目前尚无家畜胆绿素尿的报道。
血红素降解的第一步是通过血红素加氧酶分解产生胆绿素、铁和一氧化碳[7]。在哺乳动物体内,胆绿素被胆绿素还原酶迅速还原成胆红素。有两种胆绿素还原酶同工酶A和B,分别由BLVRA和BLVRB基因编码。
胆绿素还原酶A的表达无处不在,是成人体内最主要的同工酶,而胆绿素还原酶B似乎只在胎儿和新生儿体内降低胆绿素[7]。在健康哺乳动物中,血清和血浆中胆绿素的浓度非常低,甚至检测不到,因为胆绿素还原酶A能有效地将胆绿素还原成胆红素[8-10]。
据报道,只有两种罕见的BLVRA变体会导致高胆绿素血症和胆绿素尿,在人类出现“绿疸”、肝硬化或阻塞性胆汁淤积的病例报告中也有报道[10,11]。皮肤和体液,包括血浆、血清、尿液和乳汁(一名哺乳期妇女)都呈现绿色[10,11]。这些变色是BLVRA缺乏症的主要临床表型。三名受影响的妇女也被诊断出患有胆石症[11],但无法确定高胆绿素血症是否导致了胆石症的形成。关于BLVRA缺乏症对健康的其他长期影响,尚未有任何描述。
在每只患有胆绿素尿的狗中,都发现了各自的BLVRA基因缺失为同卵状态,这与先天性代谢错误的常染色体隐性遗传一致。在之前一份关于人类胆绿素尿症患者的报告中,致病的BLVRA变体也是以同卵状态出现的[11]。然而,在另一位特征不完全的患者(未进行酶活性研究)中,只检测到一个杂合型BLVRA变异[10]。确定BLVRA缺乏症遗传性的一个复杂因素是,在没有胆汁淤积性疾病的情况下,高胆红素血症似乎具有不完全的渗透性[10,11]。
总之,本报告对两只没有血缘关系的成年混血犬进行了临床病理学、代谢和分子学调查,记录了首例非人类哺乳动物遗传性胆绿素尿病例。这两例病例均为不同外显子BLVRA缺失的同基因病例。这项研究极大地扩展了对这种异常罕见的先天性代谢错误的认识,并可能有助于临床识别和诊断今后出现在狗、人和其他哺乳动物身上的病例。
文献来源:Furrow E, Peralta JA, Moore AR, Minor KM, Guerrero C, Hemmila CR, DiCiccio V, Cullen JN, Friedenberg SG, Giger U. Biliverdinuria Caused by Exonic BLVRA Deletions in Two Dogs with Green Urine. Genes (Basel). 2024 Nov 30;15(12):1561.
参考文献
1.Flaherty D., Auckburally A. Green Discolouration of Urine Following Propofol Infusion in a Dog. J. Small Anim. Pract. 2017;58:536–538.
2.Lasica A., Cortesi C., Milani G.P., Bianchetti M.G., Schera F.M., Camozzi P., Lava S.A.G. Propofol-Associated Urine Discoloration: Systematic Literature Review. Pharmacology. 2023;108:415–422.
3.Moussa M., Chakra M.A., Papatsoris A.G., Dellis A. Green Urine Due to Pseudomonas Urinary Tract Infection: An Unusual Occurence. Am. J. Emerg. Med. 2022;52:249–250.
4.Greenberg M. Verdoglobinuria. Clin. Toxicol. 2008;46:485–486.
5.Koratala A., Leghrouz M. Green Urine. Clin. Case Rep. 2017;5:549–550.
6.Stone H.H., Martin J.D., Graber C.D. Verdoglobinuria: An Ominous Sign of Pseudomonas Septicemia in Burns. Ann. Surg. 1964;159:991–995.
7.Weaver L., Hamoud A., Stec D.E., Hinds T.D. Biliverdin Reductase and Bilirubin in Hepatic Disease. Am. J. Physiol.-Gastrointest. Liver Physiol. 2018;314:G668–G676.
8.Larson E.A., Evans G.T., Watson C.J. A Study of the Serum Biliverdin Concentration in Various Types of Jaundice. J. Lab. Clin. Med. 1947;32:481–488.
9.Garner R.J. Bile Pigment Metabolism in Cattle. J. Comp. Pathol. Ther. 1953;63:247–253.
10.Gåfvels M., Holmström P., Somell A., Sjövall F., Svensson J., Ståhle L., Broomé U., Stål P. A Novel Mutation in the Biliverdin reductase-A Gene Combined with Liver Cirrhosis Results in Hyperbiliverdinaemia (Green Jaundice) Liver Int. 2009;29:1116–1124.
11.Nytofte N.S., Serrano M.A., Monte M.J., Gonzalez-Sanchez E., Tumer Z., Ladefoged K., Briz O., Marin J.J.G. A Homozygous Nonsense Mutation (c.214C->A) in the Biliverdin Reductase α Gene (BLVRA) Results in Accumulation of Biliverdin during Episodes of Cholestasis. J. Med. Genet. 2011;48:219–225.