
| 品种:贵宾犬 | |
| 年龄:7岁 | |
| 性别:雌 | |
| 诊断:汗腺癌 | |
01 主诉及病史
在左侧第二乳腺附近的皮肤上长了几个米粒大小的椭圆形小结节。
食欲、饮水量、尿量和整体活力仍在正常范围内。
02 检查
体格检查时,肺部听诊可听到轻微的支气管吸气声,心脏听诊和心丝虫检测均正常。血液检查和胸片检查均未发现明显异常。
一个月后,腹部肿块覆盖的皮肤颜色变蓝,结节凝聚成一个较大的不规则肿块。肿块坚硬,导致皮肤明显突出(下图)。
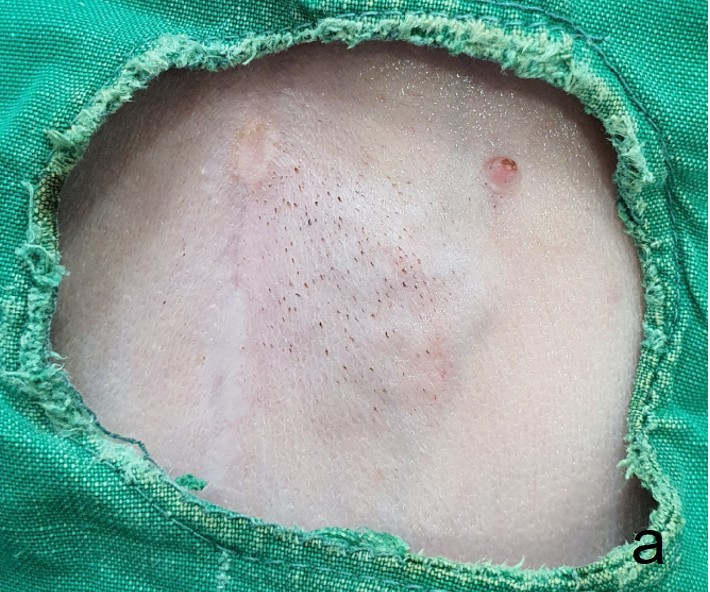
↑ 皮肤呈蓝色,许多结节形成不规则肿块,突出于皮肤。
03 治疗
进行了手术切除,手术过程中发现肿块与下层皮肤和皮下结缔组织紧密粘连,并有中度出血(下图)。肿块被成功切除,术后恢复顺利。
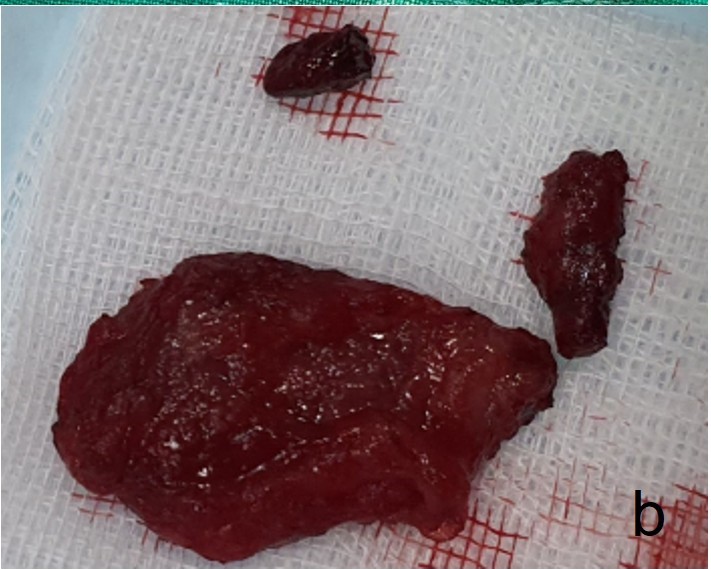
↑ 切除的肿瘤。肿块与皮肤和皮下结缔组织紧密粘连。
显微镜下,肿瘤被厚厚的纤维结缔基质分割成多个小叶。肿瘤呈异质结构形态,包括实性巢状、假腺体和充满粘液性物质的囊性形态(下图a)。圆形至椭圆形的肿瘤细胞具有嗜酸性细胞质和多形性细胞核,偶尔可见有丝分裂(下图b)。PAS染色证实了局部区域有粘蛋白生成和沉积。虽然在间质区域发现了一些炎症细胞,但没有坏死的迹象。
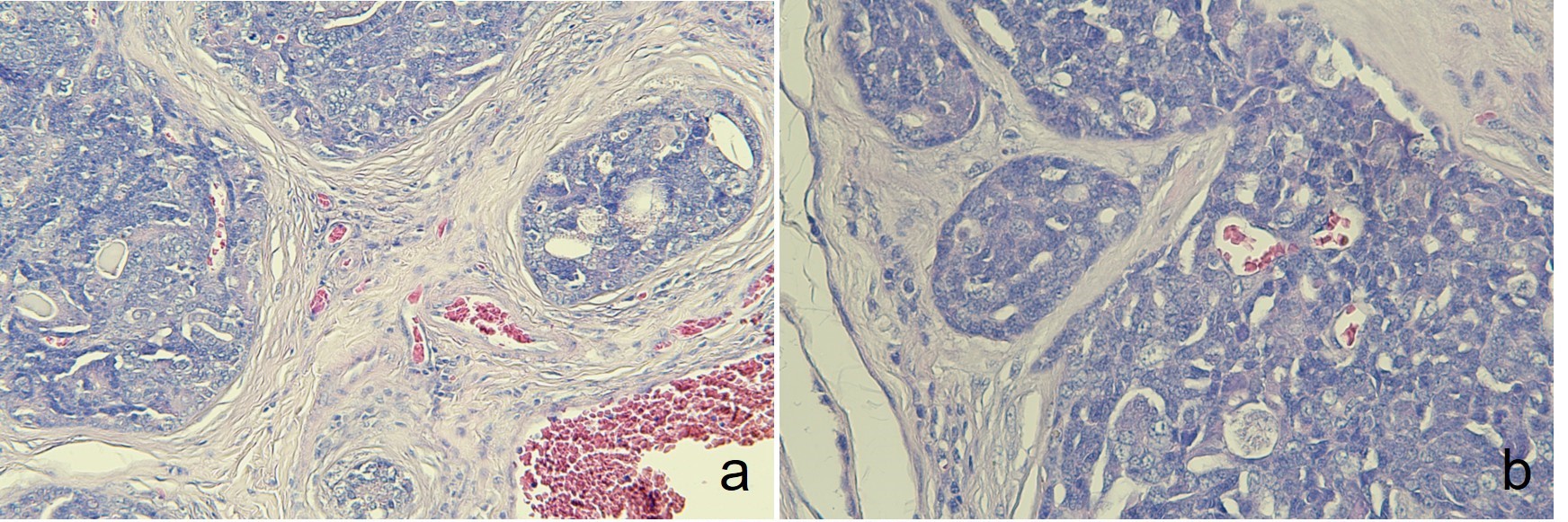
↑ (a)肿瘤显示出增厚的小叶基质。(b)在小叶内,某些区域发现周边苍白。核质平淡,有中度多形性,染色质呈弥漫性条纹状。
免疫组化显示,CK5、AE1/AE3+CK8/18和CK19、p63、波形蛋白和Sox9、E-cadherin和突触素染色阳性,而雌激素受体染色阴性(下图)。突触素染色阳性证实存在神经内分泌分化,加上整体组织形态学特征,最终诊断为分泌内分泌粘蛋白的汗腺癌。
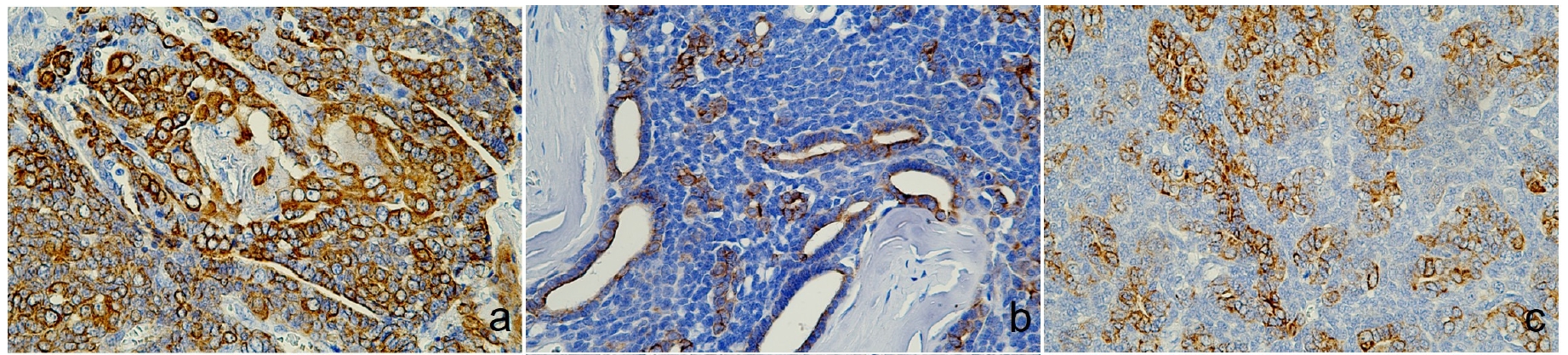
↑ (a)CK5阳性。(b)管腔瘤细胞AE1/AE3+CK8/18阳性。(c)CK19细胞质和细胞膜表达。
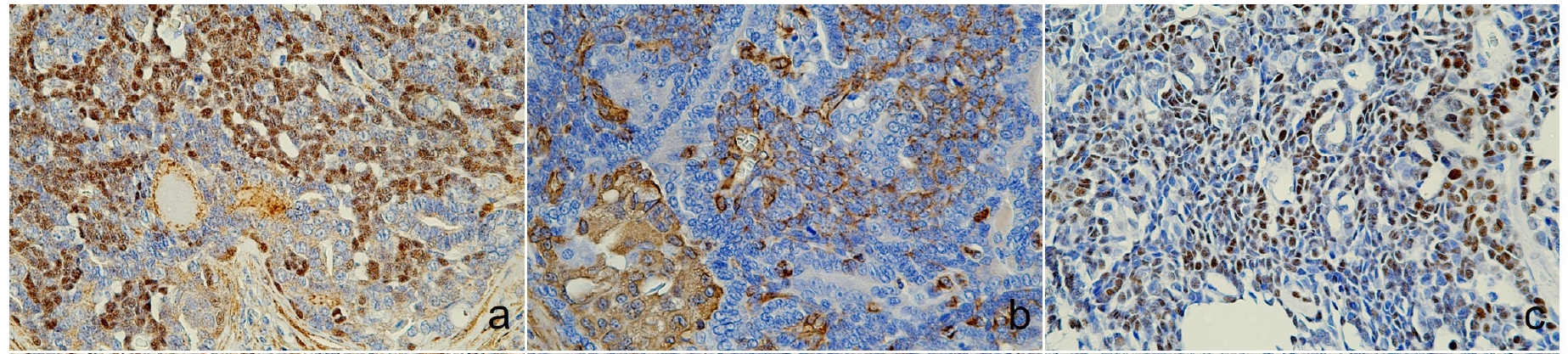
↑(a)核内p63阳性,(b)胞浆内波形蛋白阳性,(c)Sox9发现核表达。
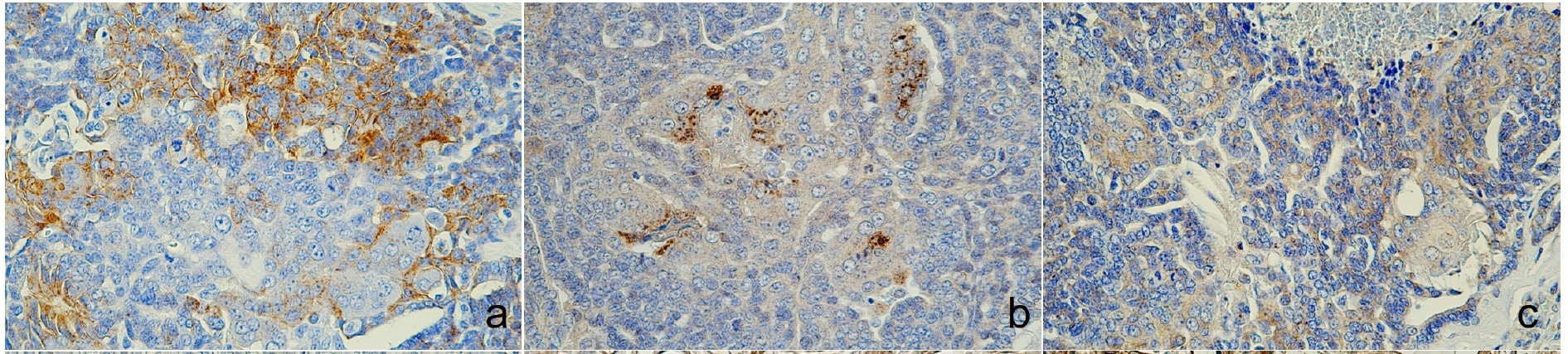
↑(a)膜和胞质区E-cadherin阳性,(b)胞质区突触素表达,(c)核区雌激素阴性。
04 预后
预后良好,至今未发现复发迹象。
 | 品种:马尔济斯犬 |
| 年龄:16岁 | |
| 性别:雌 | |
| 诊断:乳腺腺癌 | |
05 主诉及病史
右侧第二乳腺上有一个7×6 cm肿块,已持续5年。
06 治疗
对肿块进行了切除(下图),未发现转移病灶。
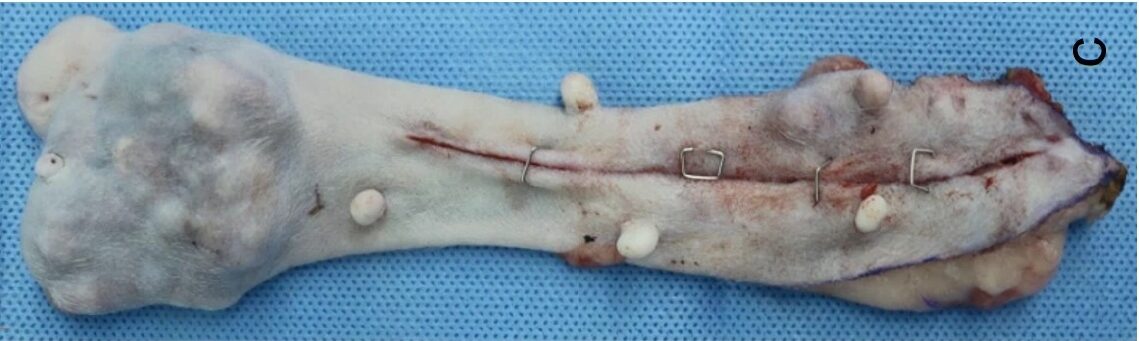
↑ 切除的右侧第2乳腺肿块(7×6 cm)。
肿瘤经组织学诊断为乳腺腺癌。显微镜下,肿瘤边缘不清(下图c),每10个高倍视野中有两个有丝分裂计数,未发现淋巴管侵犯(下图d)。
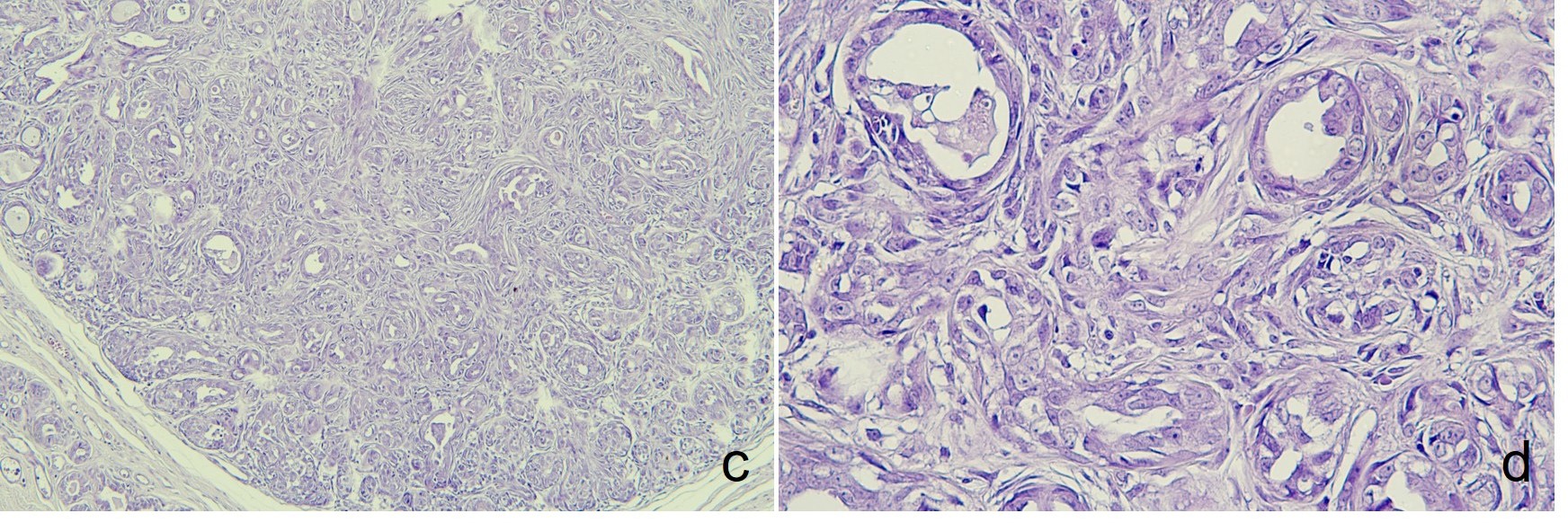
↑ (c)不规则增生的小腺体。(d)小管内衬为单层立方或柱状细胞增生,伴有不典型性。
免疫组化显示,CK5、E-cadherin以及肌上皮细胞中的p63和波形蛋白均呈阳性表达,而AE1/AE3+CK8/18、CK19和Sox9等标记物则呈阴性。雌激素和突触素免疫反应呈阳性(下图),支持乳腺腺癌的诊断。
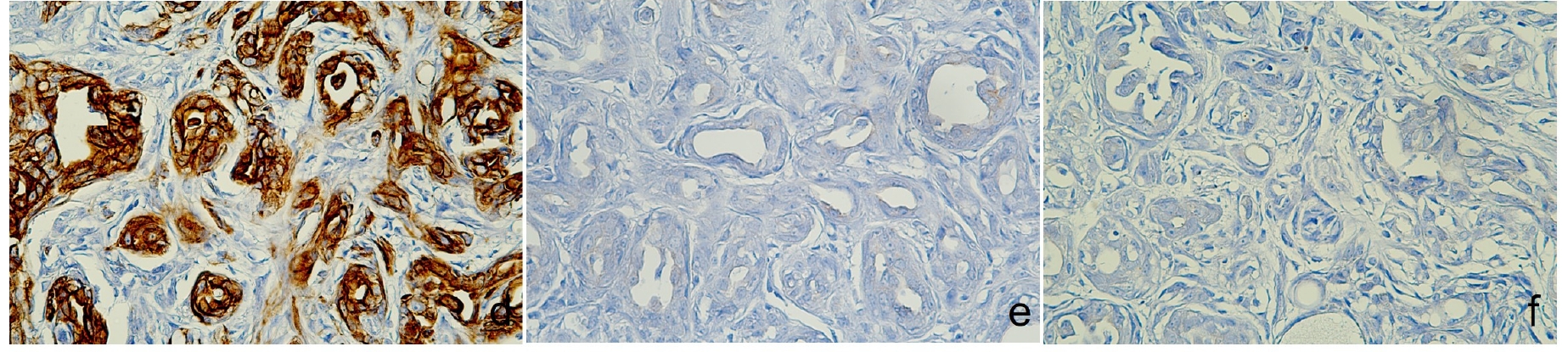
↑(d)CK5 阳性。(e)AE1/AE3+CK8/18和(f)CK19无免疫反应。
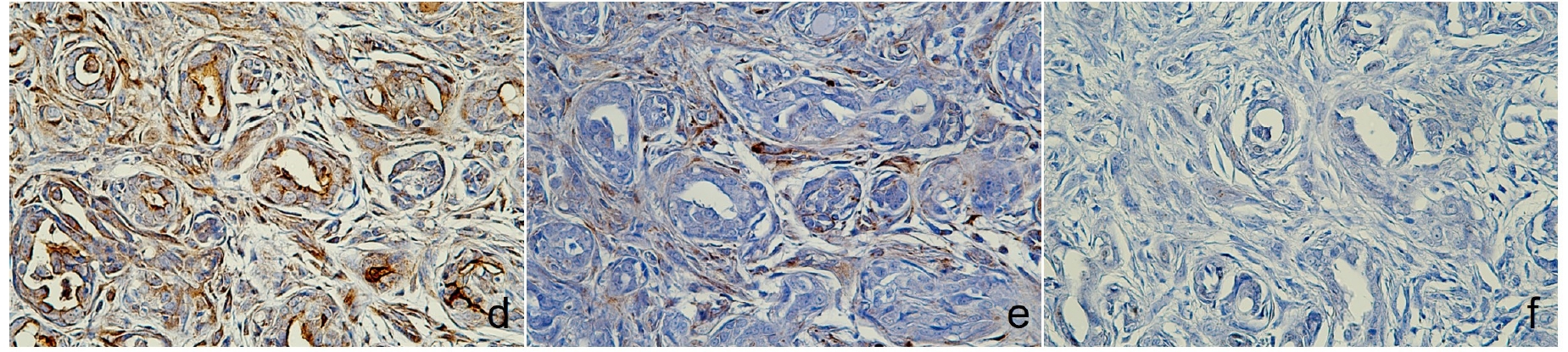
↑(d)p63和(e)波形蛋白在肌上皮细胞中呈阳性,(f)Sox9呈阴性表达。
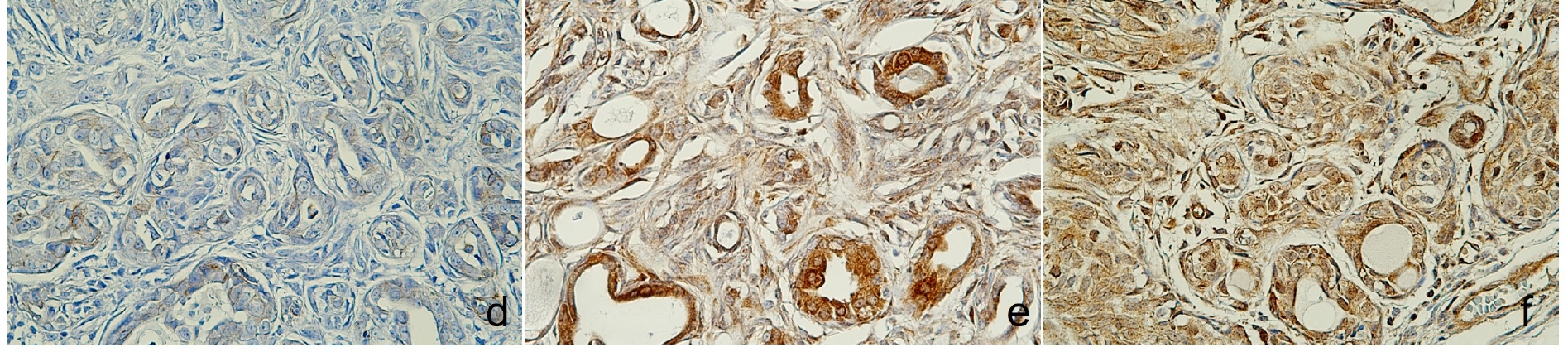
↑(d)E-cadherin呈弱表达,(e)突触素呈细胞质表达,(f)核细胞雌激素阳性。
07 讨论
乳腺和汗腺在胚胎发育过程中起源于外胚层[1],因此它们的结构和功能相似[2]。因此,由于这两种腺体在形态和临床上的相似性,区分它们所产生的肿瘤可能具有挑战性[2,3]。虽然乳腺腺癌和汗腺腺癌在组织学和免疫组化特征上有重叠之处[2,4],但它们的治疗方法和预后却大相径庭。因此,准确的鉴别对于正确的临床治疗至关重要。
WHO第四版《皮肤肿瘤分类》强调了免疫组化分析在鉴别汗腺肿瘤等皮肤附属器肿瘤方面的重要性[5]。各种细胞角蛋白标记物,包括CK5[4]、CK8[6]、CK18[6]、CK8/18[7]和CK19[6,8],通常用于诊断皮肤附属器肿瘤,尤其是汗腺肿瘤。此外,Sox9是一种参与包括皮肤附属器在内的多种组织发育的标记物,有助于区分汗腺和乳腺肿瘤[9-11]。
免疫组化标记物CK5、波形蛋白和p63是汗腺和乳腺肌上皮细胞的标记物[7,12],它们已被用于鉴别肿瘤特征[7]。E-cadherin的表达在乳腺癌[13]和汗腺癌[7]中都有研究,因为它是一种上皮标记物,有助于癌症的分化和预后[13]。
分泌内分泌粘蛋白的汗腺癌(Endocrine mucin-producing sweat gland carcinoma,EMPSGC)是一种具有神经内分泌分化特征的低级别皮肤附属器肿瘤[14-16]。这种最初在人类病例中描述的肿瘤非常罕见,动物病例的资料也很有限。
EMPSGC与其他神经内分泌肿瘤(如乳腺实性乳头状癌和乳腺导管原位癌)具有相同的组织学特征[15,16]。组织学上,EMPSGC表现为粘蛋白积聚、神经内分泌特征[15]和核分化不良。从免疫组化角度看,EMPSGC对突触素和嗜铬粒蛋白等内分泌标记物有免疫反应[17]。EMPSGC的诊断是人类病理学中的一项重大挑战,因为它非常罕见,而且在组织学上与其他附属器肿瘤,尤其是乳腺腺癌相似[14-17,21]。
本研究报告了首例记录在案的犬EMPSGC病例,强调了使用免疫组化标记物区分[22]这些肿瘤的重要性,并为兽医临床处理类似病例提供了启示。对于EMPSGC标记,我们将人类研究的数据与本病例进行了比较。这些标记物与犬病例的相关性是通过使用之前在该物种免疫组化中验证过的抗体来确认的,以尽量减少交叉反应。此外,本研究还包括阳性和阴性对照,以检测假阴性和假阳性结果,从而支持物种特异性检测的验证[23]。
从临床角度来看,病例1的肿瘤手术切除结果良好,随访期间没有复发迹象。这表明,完全手术切除可能是治疗犬EMPSGC的有效方法[22,31]。虽然有报道称人类EMPSGC病例复发[31],但这只犬的病例没有复发是令人鼓舞的,尽管长期随访对于充分了解肿瘤在动物体内的行为仍然至关重要。鉴于兽医学中关于EMPSGC的数据有限,未来的研究有必要调查类似病例的长期预后和转移或复发的可能性。
总之,本研究记录了狗中第一例EMPSGC,使用CK19、Sox9、CK5、p63和波形蛋白等免疫组化标记物成功地将其与乳腺腺癌区分开来。手术切除取得了良好的结果,没有观察到复发。虽然罕见,但EMPSGC需要进一步研究,以了解其长期行为和兽医学中的最佳治疗方法。
文献来源:Tangchang W, Jung GY, Song JY, Kumbukgahadeniya P, Kim DH, Kwon HJ, Son HY. Endocrine Mucin-Producing Sweat Gland Carcinoma (EMPSGC) in a Dog: Immunohistochemical Characterization. Animals (Basel). 2024 Dec 17;14(24):3637.
参考文献
1.Biggs L.C., Mikkola M.L. Early inductive events in ectodermal appendage morphogenesis. Semin. Cell Dev. Biol. 2014;25–26:11–21.
2.Mentrikoski M.J., Wick M.R. Immunohistochemical distinction of primary sweat gland carcinoma and metastatic breast carcinoma: Can it always be accomplished reliably? Am. J. Clin. Pathol. 2015;143:430–436.
3.Khan Y.S., Fakoya A.O., Sajjad H. Anatomy, Thorax, Mammary Gland. StatPearls Publishing; Treasure Island, FL, USA: 2023.
4.Rollins-Raval M., Chivukula M., Tseng G.C., Jukic D., Dabbs D.J. An immunohistochemical panel to differentiate metastatic breast carcinoma to skin from primary sweat gland carcinomas with a review of the literature. Arch. Pathol. Lab. Med. 2011;135:975–983.
5.Elder D., Massi D., Scolyer A., Willemze R. WHO Classification of Skin Tumours. IARC; Lyon, France: 2018. pp. 168–169.
6.Zhou X., Li G., Wang D., Sun X., Li X. Cytokeratin expression in epidermal stem cells in skin adnexal tumors. Oncol. Lett. 2019;17:927–932.
7.Lei Y.H., Xue L.I., Zhang J.Q., Zhao J.Y. Important immunohistochemical markers for identifying sweat glands. Chin. Med. J. 2013;126:1370–1377.
8.Goto K., Ishikawa M., Hamada K., Muramatsu K., Naka M., Honma K., Sugino T. Comparison of Immunohistochemical Expression of Cytokeratin 19, c-KIT, BerEP4, GATA3, and NUTM1 Between Porocarcinoma and Squamous Cell Carcinoma. Am. J. Dermatopathol. 2021;43:781–787.
9.Vidal V.P., Ortonne N., Schedl A. SOX9 expression is a general marker of basal cell carcinoma and adnexal-related neoplasms. J. Cutan. Pathol. 2008;35:373–379.
10.Shi G., Sohn K.C., Li Z., Choi D.K., Park Y.M., Kim J.H., Fan Y.-M., Nam Y.H., Kim S., Im M., et al. Expression and functional role of Sox9 in human epidermal keratinocytes. PLoS ONE. 2013;81:e54355.
11.Nishimura Y., Ryo E., Inoue S., Kawazu M., Ueno T., Namikawa K., Takahashi A., Ogata D., Yoshida A., Yamazaki N., et al. Strategic Approach to Heterogeneity Analysis of Cutaneous Adnexal Carcinomas Using Computational Pathology and Genomics. JID Innov. 2023;3:100229.
12.Gusterson B.A., Stein T. Human breast development. Semin. Cell Dev. Biol. 2012;23:567–573.
13.Chintamani, Rekhi B., Bansal A., Bhatnagar D., Saxena S. Expression of E-Cadherin in breast carcinomas and its association with other biological markers—A prospective study. Indian J. Surg. Oncol. 2010;1:40–46.
14.Agni M., Raven M.L., Bowen R.C., Laver N.V., Chevez-Barrios P., Milman T., Eberhart C.G., Couch S., Bennett D.D., Albert D.M., et al. An Update on Endocrine Mucin-producing Sweat Gland Carcinoma: Clinicopathologic Study of 63 Cases and Comparative Analysis. Am. J. Surg. Pathol. 2020;44:1005–1016.
15.Zembowicz A., Garcia C.F., Tannous Z.S., Mihm M.C., Koerner F., Pilch B.Z. Endocrine mucin-producing sweat gland carcinoma: Twelve new cases suggest that it is a precursor of some invasive mucinous carcinomas. Am. J. Surg. Pathol. 2005;29:1330–1339.
16.Flieder A., Koerner F.C., Pilch B.Z., Maluf H.M. Endocrine mucin-producing sweat gland carcinoma: A cutaneous neoplasm analogous to solid papillary carcinoma of breast. Am. J. Surg. Pathol. 1997;21:1501–1506.
17.Cazzato G., Bellitti E., Trilli I., Colagrande A., Sgarro N., Scarcella V.S., Lettini T., Ingravallo G., Piscitelli D., Resta L., et al. Endocrine Mucin-Producing Sweat Gland Carcinoma: Case Presentation with a Comprehensive Review of the Literature. Dermatopathology. 2023;10:266–280.
18.LeBlanc R. Endocrine Mucin Producing Sweat Gland Carcinoma. PathologyOutlines.com. [(accessed on 1 December 2024)].
19.Warmke L.M., Tinkham E.G., Ingram D.R., Lazar A.J., Panse G., Wang W.L. INSM1 Expression in Angiosarcoma. Am. J. Clin. Pathol. 2021;155:575–580.
20.Acs G., Lawton T.J., Rebbeck T.R., LiVolsi V.A., Zhang P.J. Differential expression of E-cadherin in lobular and ductal neoplasms of the breast and its biologic and diagnostic implications. Am. J. Clin. Pathol. 2001;115:85–98.
21.Adiputra P.A.T., Sudarsa I.W., Irawan H., Saputra H. Malignant adnexal tumor of the skin on breast: A case report of apocrine carcinoma. Case Rep. Pathol. 2023;108:108383.
22.Brett M.A., Salama S., Gohla G., Alowami S. Endocrine Mucin-Producing Sweat Gland Carcinoma, a Histological Challenge. Case Rep. Pathol. 2017;2017:6343709.
23.Caswell J.L., Bassel L.L., Rothenburger J.L., Gröne A., Sargeant J.M., Beck A.P., Ekman S., Gibson-Corley K.N., Kuiken T., LaDouceur E.E.B., et al. Observational Study Design in Veterinary Pathology, Part 2: Methodology. Vet. Pathol. 2018;55:774–785.
24.Ivan D., Hafeez Diwan A., Prieto V.G. Expression of p63 in primary cutaneous adnexal neoplasms and adenocarcinoma metastatic to the skin. J. Cutan. Pathol. 2005;32:94.
25.Brenn T. Do not break a sweat: Avoiding pitfalls in the diagnosis of sweat gland tumors. Mod. Pathol. 2020;33:25–41.
26.Gama A., Alves A., Gartner F., Schmitt F. p63: A novel myoepithelial cell marker in canine mammary tissues. Vet. J. 2003;40:412–420.
27.Yamashita N., Tokunaga E., Iimori M., Inoue Y., Tanaka K., Kitao H., Saeki H., Oki E., Maehara Y. Epithelial Paradox: Clinical Significance of Coexpression of E-cadherin and Vimentin with Regard to Invasion and Metastasis of Breast Cancer. Clin. Breast Cancer. 2018;18:e1003–e1009.
28.Myong N.H. Loss of E-cadherin and Acquisition of Vimentin in Epithelial-Mesenchymal Transition are Noble Indicators of Uterine Cervix Cancer Progression. Korean J. Pathol. 2012;46:341–348.
29.Charles N.C., Proia A., Lo C. Endocrine mucin-producing sweat gland carcinoma of the eyelid associated with mucinous adenocarcinoma. Ophthalmic Plast. Reconstr. Surg. 2018;34:e37–e38.
30.Murshed K.A., Ben-Gashir M. A Case of Endocrine Mucin-Producing Sweat Gland Carcinoma: Is it Still an Under-Recognized Entity? Case Rep. Dermatol. 2021;12:255–261.
31.Chang S., Shim S.H., Joo M., Kim H., Kim Y.K. A case of endocrine mucin-producing sweat gland carcinoma co-existing with mucinous carcinoma: A case report. J. Pathol. Transl. Med. 2010;44:97–100.