
| 品种:短毛猫 | |
| 年龄:15岁 | |
| 性别:雄 | |
| 诊断:肾上腺肿瘤 | |
01 主诉及病史
间歇性腹泻、虚弱、多尿和多饮。
02 检查
体重5千克。体格检查发现其腹部有肿块,血压升高(收缩压200 mmHg)。其他临床评估结果均无异常。
血液学检查结果正常。血生化和尿液分析的异常结果包括:低钾血症(3.3mmol/L [3.5-5.8])、高钠血症(163 mmol/L [144-160]),尿比重1.020。
超声心动图检查结果正常。腹部超声发现左肾上腺上有一个直径至少1.5 cm的结构,对其进行了细针穿刺。细胞学检查显示细胞群与皮质来源的肾上腺肿瘤相符。右侧肾上腺及其他结构均正常。
内分泌检查发现醛固酮升高(930.5 ng/mL [11.3-294.3]),但基线皮质醇浓度和促肾上腺皮质激素刺激后的浓度均正常。
CT造影在左肾上腺尾端发现了一个直径至少1.3 cm圆形结构。同侧肾静脉扩张并被血栓侵入(下图)。其他腹部器官看起来都正常,也没有肺转移迹象。
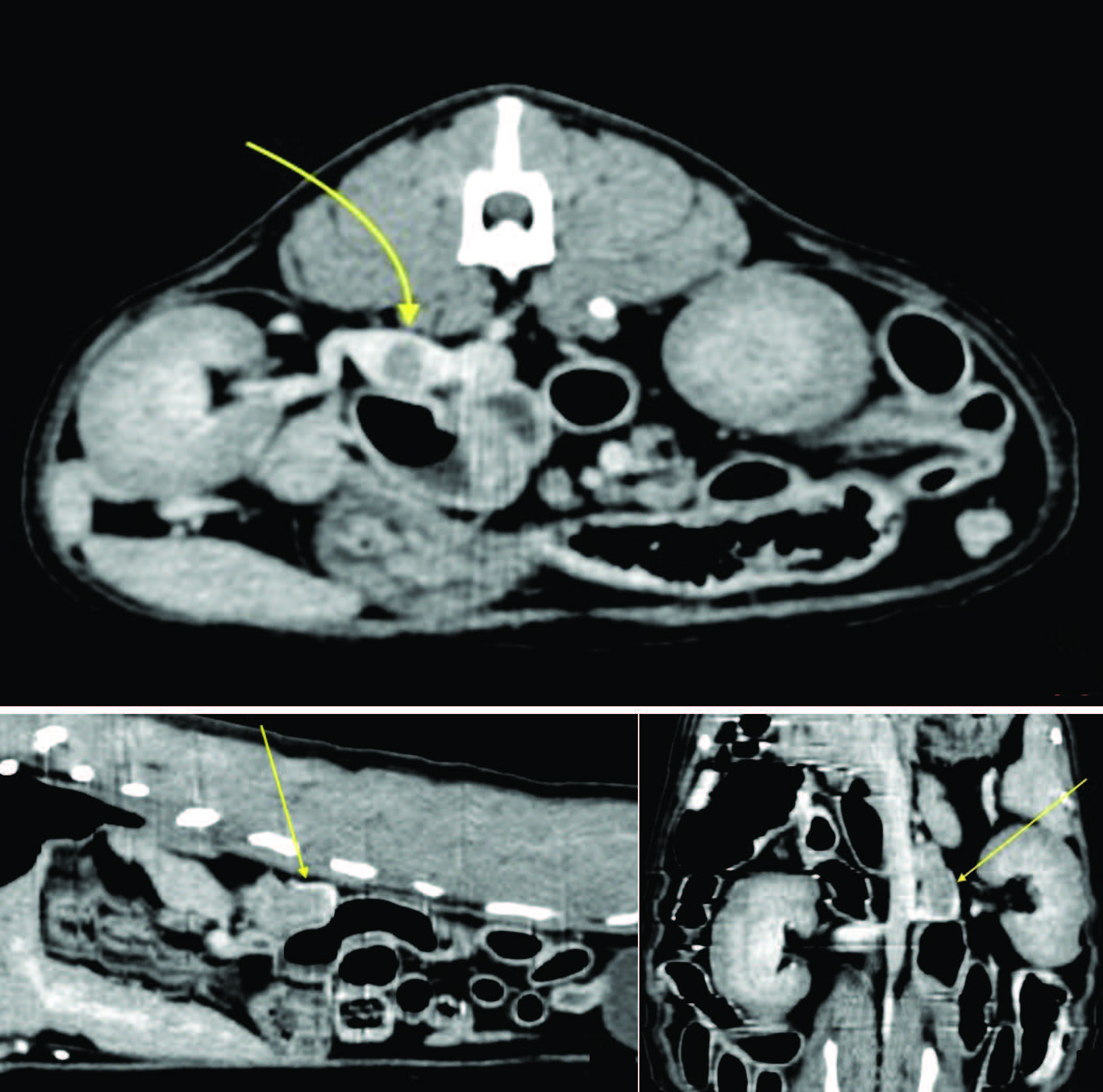
↑ 腹部CT,显示左肾上腺肿块。A-轴位面,B-矢状面,C-冠状面。
03 治疗
肾上腺切除术被认为是首选治疗方法。在与主人讨论后,根据他们的意愿,计划进行左肾上腺切除术,并尝试通过静脉切开取出血栓,以保住左肾。
进行了镇静(0.1 mg/kg氯胺酮/唑拉西泮,IV),使用丙泊酚(1 mL/kg,IV)诱导,插管,并使用七氟醚维持麻醉,术中持续监测。
置于背卧位,进行腹中线开腹手术。确定左肾上腺,将肿瘤与血管和大量粘连分离,注意避免损伤肠系膜动脉和后腔静脉。在肾静脉上放置Satinsky血管钳(下图A),以减少肾静脉流入血量并分离血栓。进行纵向静脉切开(约5 mm),用DeBakey夹夹住血栓,不断牵引取出。用7-0缝线简单连续缝合静脉切口(下图B),并移除血管钳。检查静脉切口是否有残留出血。用无菌温生理盐水灌洗腹腔后,常规缝合腹腔切口。
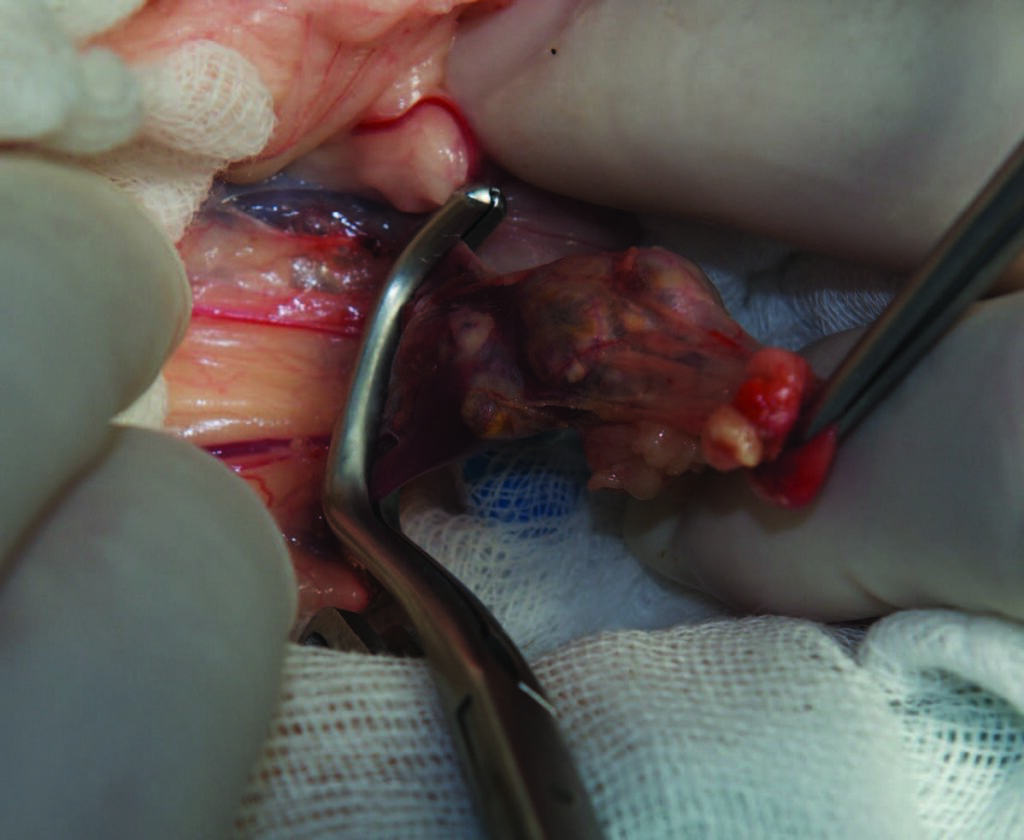
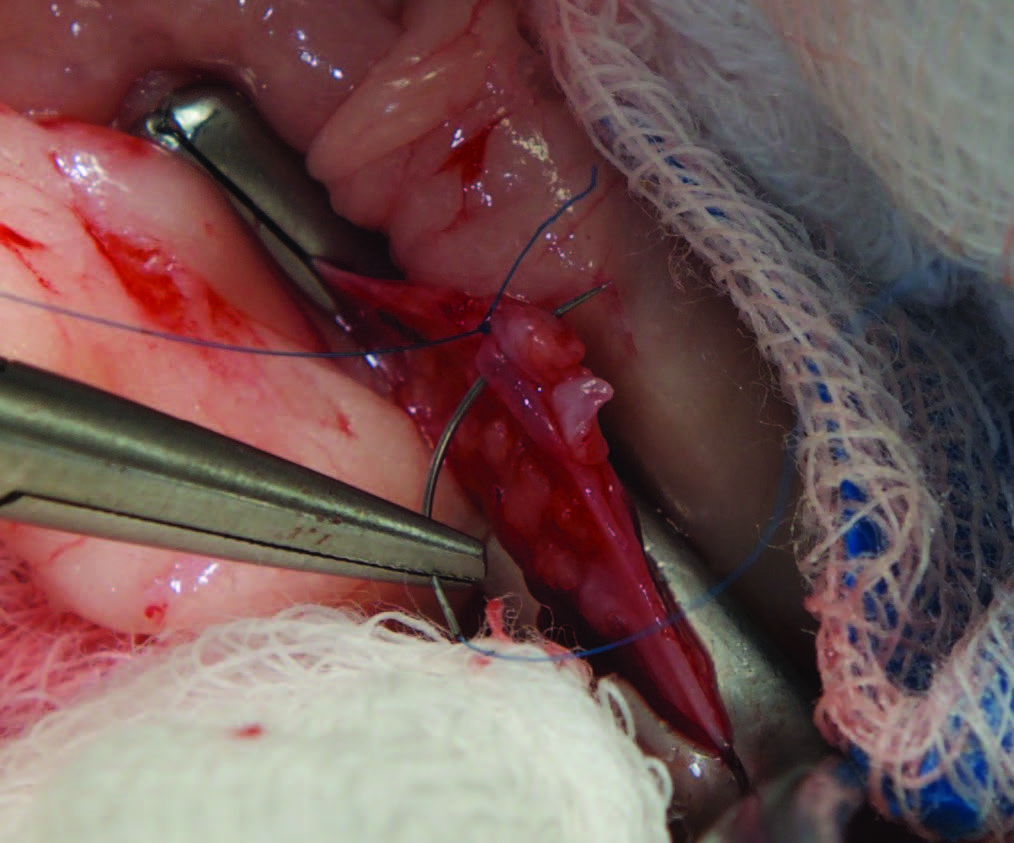
↑(A)使用Satinsky血管钳夹住肾静脉,分离血栓。(B)肾静脉缝合。
组织学分析证实了肾上腺皮质癌的诊断。病变呈多结节浸润性结构,由多角形细胞的巢和小梁组成,中间被细腻的纤维血管基质分隔。中度异形细胞增多和异形核增多,偶尔出现有丝分裂。
04 预后
麻醉后恢复顺利,2天后出院。住院期间接受了输液治疗(氯化钠10 mL/h,IV)和美洛昔康(0.05 mg/kg,PO,q24h)。
术后24小时、7天、10天和30天的随访中,临床表现良好,肾功能也在正常范围内。
术后20个月,体格检查、血液学、血生化、尿液分析和超声均正常。
术后30个月,血肌酐中度升高(2.7 mg/dL [0.8-2.4])。尿比重正常(1.028)。超声显示双肾正常,没有提示左肾静脉血栓形成的迹象。
05 讨论
肾上腺肿瘤在猫中并不常见,在猫所有肿瘤中约占0.2%,而在犬所有自发性肿瘤中仅占1-2%[1-4]。肾上腺肿瘤分为皮质肿瘤(腺瘤或腺癌)或髓质肿瘤(嗜铬细胞瘤)。皮质肿瘤可以是功能性的,产生过多的肾上腺皮质激素(皮质醇、醛固酮或性激素)并导致临床综合征,也可能是非功能性的。
原发性高醛固酮血症在猫中非常罕见。矿物质皮质激素分泌过多可由肾上腺皮质肾小球上皮双侧增生引起,或在极少数情况下由分泌醛固酮的肿瘤(即醛固酮瘤)引起[5-7]。这种肿瘤通常伴有扩张性病变,可能还伴有肿瘤血栓侵入后腔静脉、膈腹静脉或肾静脉(很少见)[4,8]。
患有肾上腺肿瘤的猫和狗可以接受药物治疗以减轻临床症状,但对于这种病变和相关的肿瘤血栓,手术治疗是首选。然而,关于血管侵犯是否会恶化短期预后的数据存在冲突[2,8-12]。
当小血栓侵入膈腹静脉时,可以与血管和肿瘤同时处理和切除,但切除进入后腔静脉的更大范围的血栓通常需要进行腔静脉切开术[1,11,13]。在极少数肿瘤血栓直接侵犯肾静脉的病例中,也会进行肾切除术。
在一些研究中,同时进行肾切除术和肾上腺切除术的预后较差,肾功能衰竭的风险增加,生存期缩短[1,11,13]。最近一项研究对5只肾上腺肿瘤伴有肾静脉瘤栓的狗进行了肾静脉切开术,避免了肾切除。这些手术治疗方法能够保留肾脏,并可能降低与手术相关的并发症[14]。
本病例明显患有高醛固酮血症。原发性醛固酮增多症在文献中并不罕见,必须将其作为患有低钾多肌病和/或全身性高血压的中老年猫的鉴别诊断[8]。一只患有肾上腺皮质癌的13岁猫被诊断为原发性高醛固酮血症。肾上腺切除术解决了低钾血症、高血压和其他电解质异常的问题。手术切除了后腔静脉的肿瘤血栓,但未造成腔静脉病理性狭窄[9]。
在本病例中,手术是首选方法。猫肾上腺肿瘤(无论肿瘤类型)的手术治疗与良好的长期存活率有关[4]。肿瘤坏死和破裂可导致肾上腺急性出血,并可引起原发性高醛固酮血症猫严重的低血容量和贫血[8,16,17]。与肾上腺肿瘤相关的腔隙血栓可通过肾上腺切除术和血栓切除术清除,而不会显著增加围术期的并发症和死亡率,前提是外科医生在技术方面经验丰富[11]。
总之,本病例在猫身上证实了在狗身上的报道。虽然猫的肾静脉较窄,但仍有可能在切除肾静脉血栓的同时进行肾上腺切除术,从而保留肾脏功能,避免在肾上腺切除术的同时进行肾切除术带来的不良后果。
文献来源:Nicoli S, Vitali A, Iannelli D, Biassoni L, Mangano C, Iannelli N. Kidney sparing during surgical treatment of an adrenocortical carcinoma with renal vein invasion in a cat. Can Vet J. 2024 Sep;65(9):894-899.
参考文献
1.Schwartz P, Kovak JR, Koporowski A, Ludwig LL, Monette S, Bergman PJ. Evaluation of prognostic factors in the surgical treatment of adrenal gland tumors in dogs: 41 cases. J Am Vet Med Assoc. 2008;232:77–84.
2.Lang JM, Schertel E, Kennedy S, et al. Elective and emergency surgical management of adrenal gland tumors: 60 cases (1999–2006) J Am Anim Hosp Assoc. 2011;47:428–435.
3.Lunn KF, Page RL. Tumor of the endocrine system. In: Withrow SJ, Vail DM, editors. Withrow and MacEwen’s Small Animal Clinical Oncology. 5th ed. St Louis, Missouri Saunders: Elsevier; 2013. pp. 504–531.
4.Daniel G, Mahony OW, Markivich JE, et al. Clinical findings, diagnosis and outcome in 33 cats with adrenal neoplasia (2002–2013) J Feline Med Surg. 2016;18:77–84.
5.Attipa C, Beck S, Lipscomb V, et al. Aldosterone-producing adrenocortical carcinoma with myxoid differentiation in a cat. Vet Clin Pathol. 2018;47:660–664.
6.Rijnberk A, Voorhout G, Kooistra HS, et al. Endocrinology: Hyperaldosteronism in a cat with metastasized adrenocortical tumor. Vet Q. 2001;23:38–43.
7.Del Magno S, Pisoni L, Magarotto J, et al. Due casi di sospetto iperaldosteronismo primario nel gatto [Two cases of suspected primary hyperaldosteronism in cats] [article in Italian] Veterinaria. 2012;26:41–50.
8.Lo AJ, Holt DE, Brown DC, et al. Treatment of aldosterone secreting adrenocortical tumors in cats by unilateral adrenalectomy: 10 cases (2002–2012) J Vet Intern Med. 2014;28:137–143.
9.Rose SA, Kyles AE, Labelle P, et al. Adrenalectomy and caval thrombectomy in a cat with primary hyperaldosteronism. J Am Anim Hosp Assoc. 2007;43:209–214.
10.Piegols HJ, Brittany EA, Lapsley JM, et al. Risk factors influencing death prior to discharge in 302 dogs undergoing unilateral adrenalectomy for treatment of primary adrenal gland tumors. Vet Comp Oncol. 2023;21:673–684.
11.Kyles AE, Feldman EC, De Cock HE, et al. Surgical management of adrenal gland tumors with and without associated tumor thrombi in dogs: 40 cases (1994–2001) J Am Vet Med Assoc. 2003;223:654–662.
12.Barrera JS, Bernard F, Ehrhart EJ, Withrow SJ, Monnet E. Evaluation of risk factors for outcome associated with adrenal gland tumors with or without invasion of the caudal vena cava and treated via adrenalectomy in dogs: 86 cases (1993–2009) J Am Vet Med Assoc. 2013;242:1715–1721.
13.Mayhew PD, Boston SE, Zwingenberger AL, et al. Perioperative morbidity and mortality in dogs with invasive adrenal neoplasms treated by adrenalectomy and cavotomy. Vet Surg. 2019;48:742–750.
14.Chiti LE, Mayhew PD, Massari F. Renal venotomy for thrombectomy and kidney preservation in dogs with adrenal tumors and renal vein invasion. Vet Surg. 2021;50:872–879.
15.Combes A, Pey P, Paepe D, et al. Ultrasonographic appearance of adrenal glands in healthy and sick cats. J Feline Med Surg. 2013;15:445–457.
16.Kirkwood N, Boland L, Brunel L, Wardman A, Barrs VR. Acute adrenal haemorrhage in two cats with aldosterone-secreting adenocarcinomas. JFMS Open Rep. 2019;5:2055116919840828.
17.Mitchell JW, Mayhew PD, Culp TNW, et al. Outcome of laparoscopic adrenalectomy for resection of unilateral noninvasive adrenocortical tumors in 11 cats. Vet Surg. 2017;46:714–721.