
| 品种:短毛猫 | |
| 年龄:14岁 | |
| 性别:雌 | |
| 诊断:肺癌 | |
01 主诉及病史
因胸腔积液转诊。
嗜睡、食欲下降已有3周,最近几天还出现了呼吸困难。胸片显示大量胸腔积液,通过胸腔穿刺术经皮引流。积液分析符合无菌浆液性渗出,并伴有明显的中性粒细胞炎症。
02 检查
体重3.5千克。全血细胞计数显示中性粒细胞增多(35×10^3/μL)。FeLV、FIV和心丝虫结果均无异常。
进行了胸部CT造影检查(下图)。发现左侧头肺叶肿块,大部分肺叶和胸腔内有多个结节,胸骨淋巴结肿大。尽管怀疑肺癌并伴有肺内和胸膜转移,且预后很差,但主人还是要求尽可能进行手术探查并切除肿块。
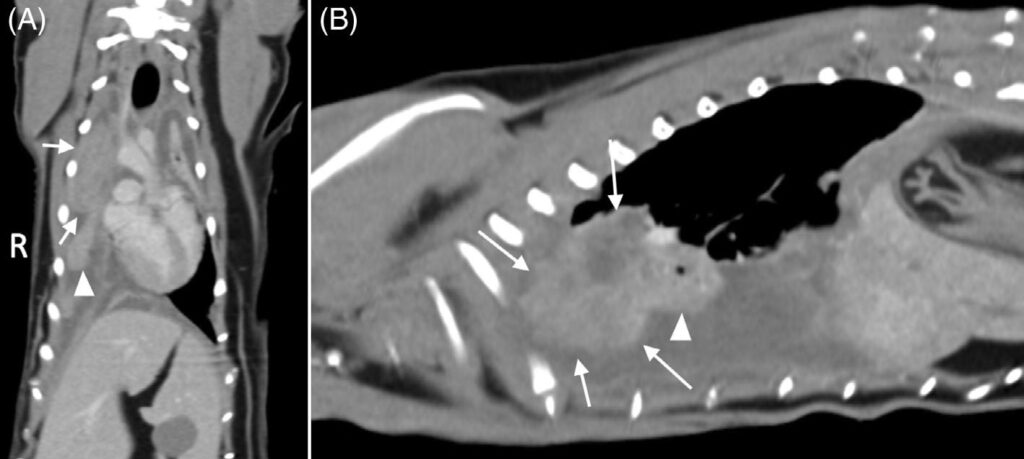
↑ 与无回声的尾部亚段(箭头)相比,左侧头肺叶密度低且异质(箭头)。
03 手术
用11号手术刀片在第10肋间隙中部切开一个5 mm皮肤切口。从深层组织钝性剥离皮下脂肪。使用双极电刀对出血血管进行止血。使用蚊式镊钝性剥离肋间肌,直到确认进入胸腔。镊子被3.9 mm螺纹内窥镜套管取代,套管内装有3.3 mm 30°内窥镜。
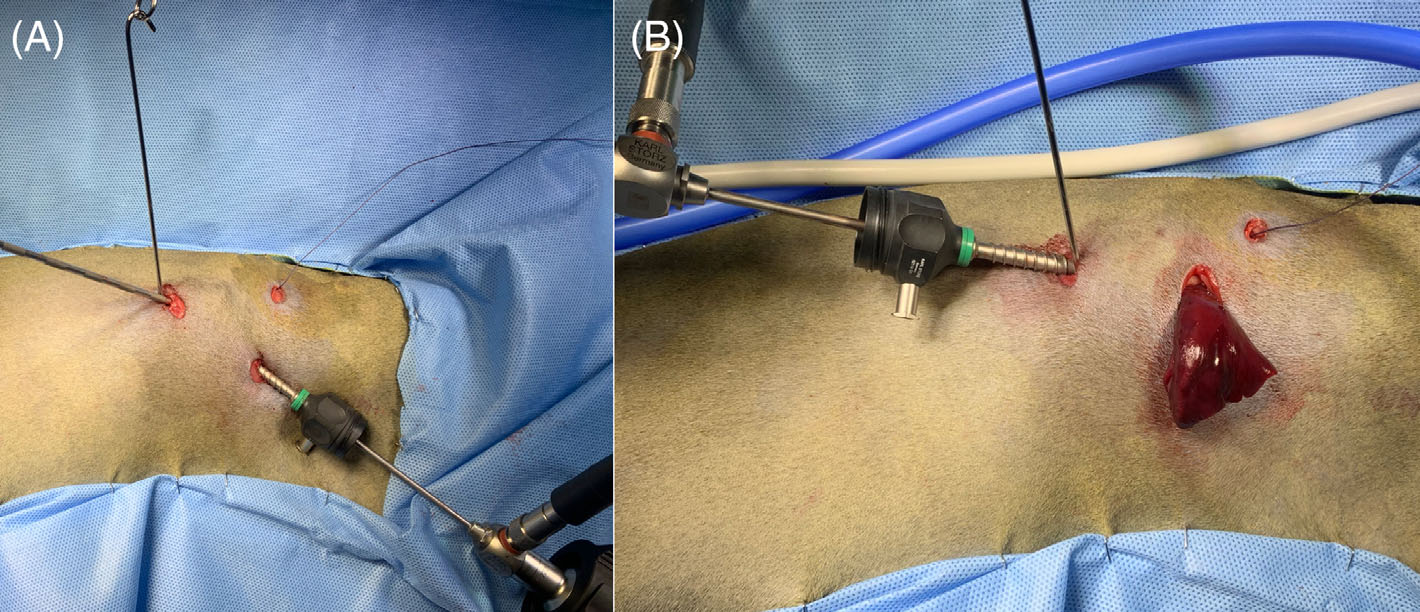
由于胸腔内空间狭小,对胸腔的探索受到限制。在第一个切口的头侧和腹侧,即第6肋间隙处做了一个10 mm切口,以插入一个定制的腹腔镜专用提升装置(下图)。一旦认为达到最大效果,就使用消毒过的2英寸自粘绷带将装置固定到天花板上。
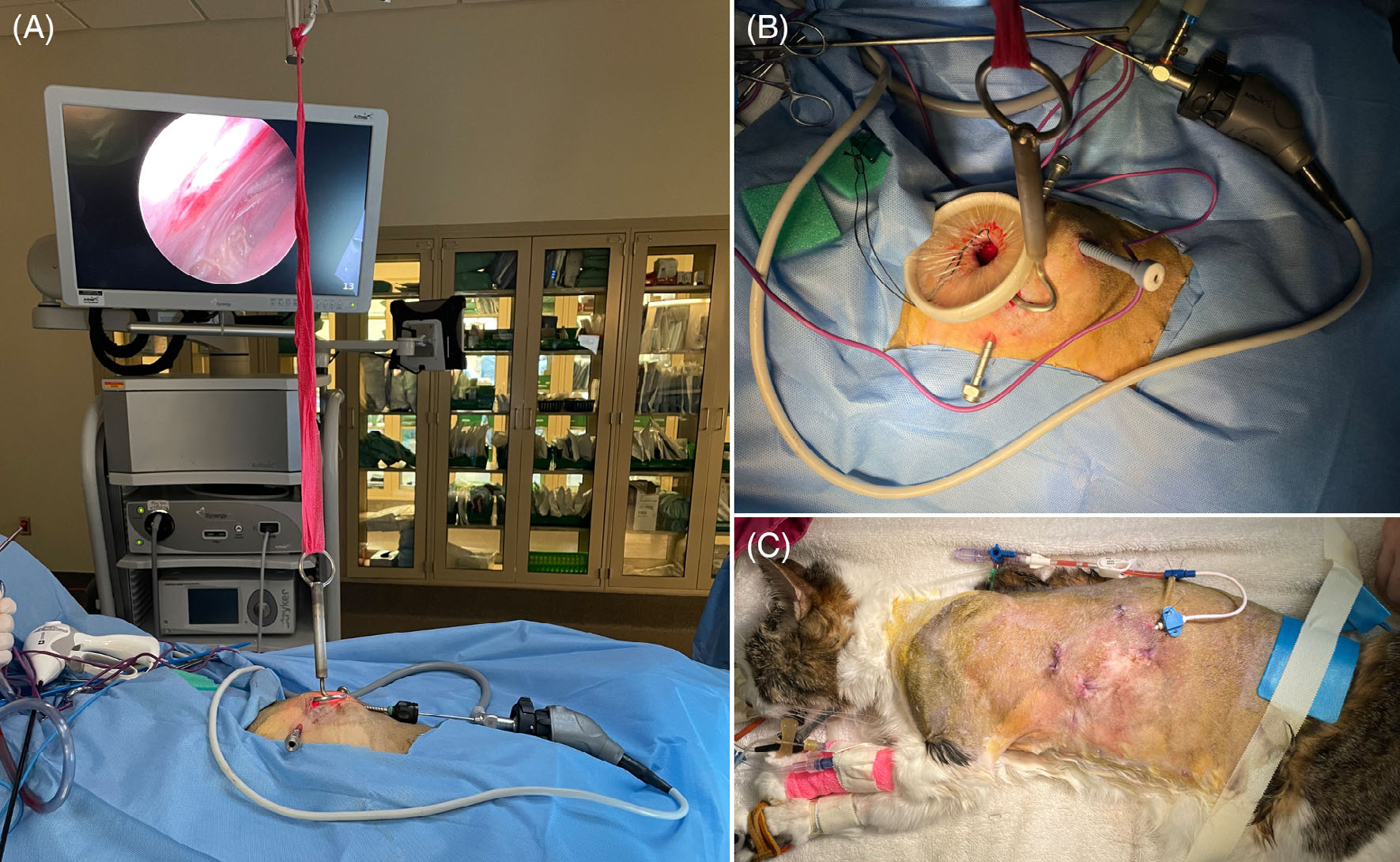
↑ (A)用于腹膜提升的提升装置已放置并悬挂在天花板上。(B) 伤口牵开器已放置。(C) 胸膜内引流和伤口闭合。
探查胸腔时,发现胸膜结节,第3和第5肋上的肺部肿块与胸壁之间有广泛粘连(下图)。在第5肋间和第9肋间分别从腹侧和背侧放置了两个5 mm器械孔。
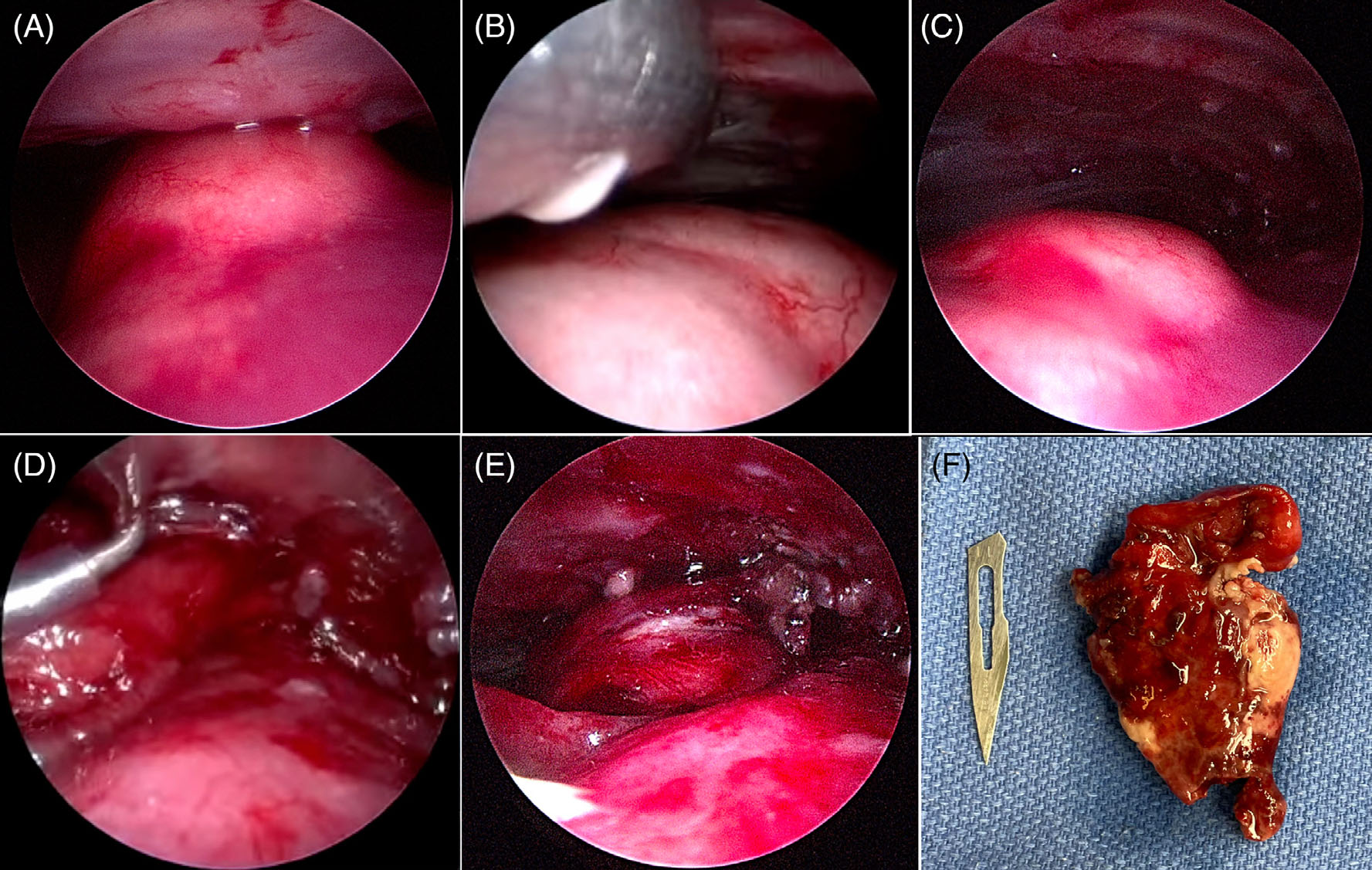
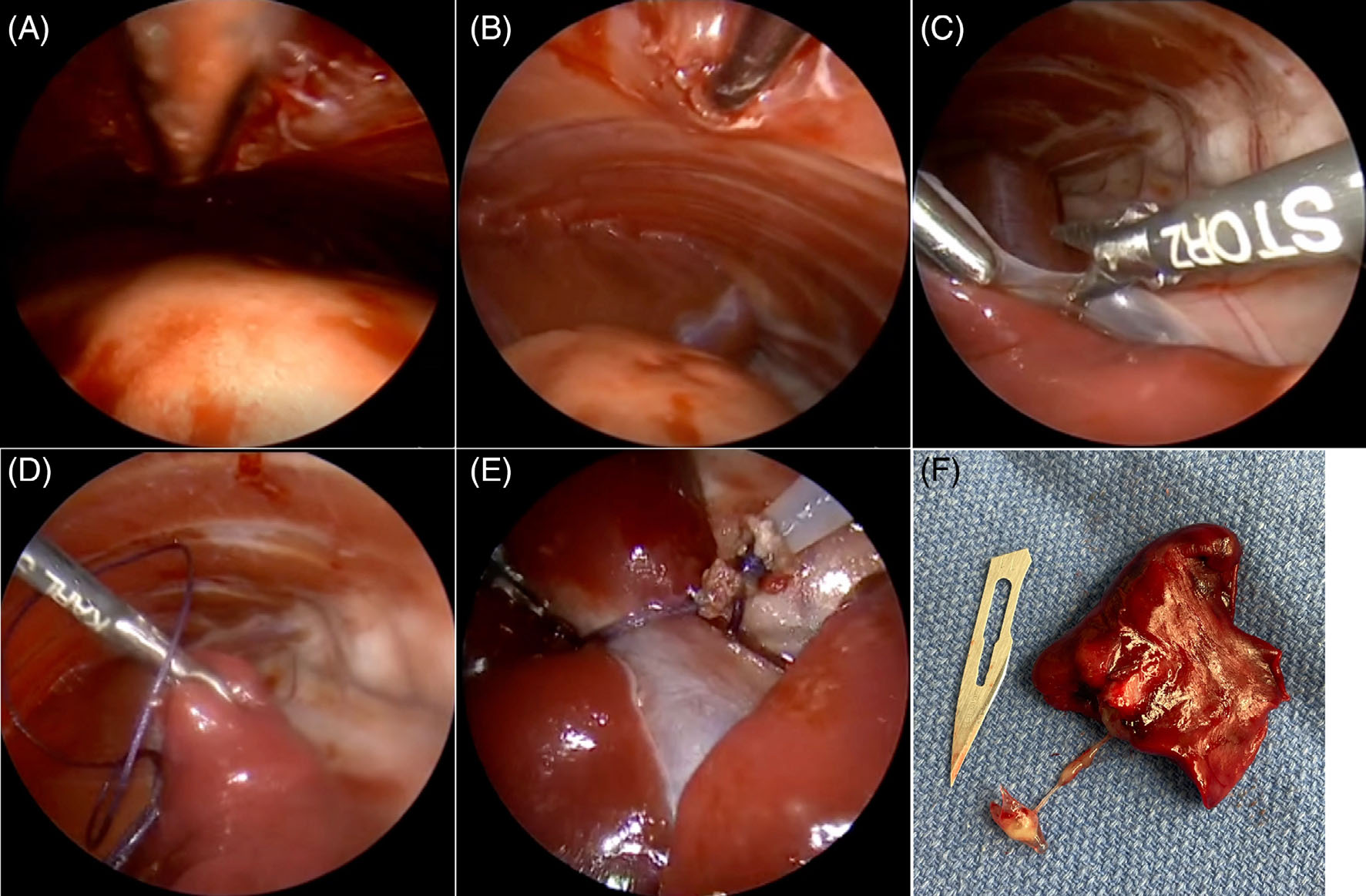
↑(A) 在提升之前进行有限的胸腔镜探查。(B)在胸腔镜引导下插入提升装置。(C)提升装置放置后,视野和工作空间增加。(D)使用单极L形钩分离肿瘤粘连。(E)肿瘤切除前。(F)肿瘤切除后。
使用5 mm血管密封装置、腹腔镜单极L形钩和5 mm钝性探针对粘连进行剥离。游离出肺叶肿块后,在第4肋间隙中部切开一个2.5 mm的切口。放置一个小型伤口牵开器,然后轻轻操作左肺叶,以便于放置预绑结扎环。
在内窥镜引导下,将结扎环放置在肺门水平。结扎肺叶后,用Metzenbaum剪刀从结扎远端5 mm处横切,取出并提交组织病理学检查。还用腹腔镜活检钳获取胸膜壁结节样本,并提交组织病理学检查。
由于存在粘连,胸骨淋巴结无法被充分观察到,因此没有采集样本。对胸腔进行了彻底清洗。在20 cmH2O下屏气5秒进行漏气测试,确认没有漏气。使用普尔抽吸套管通过牵引器抽出多余的液体。在左侧第9肋间隙位置插入14G胸管。使用3-0尼龙缝线将胸管缝合到位。然后将5.3 mg/kg布比卡因脂质体注射悬浮液渗透到肌肉组织和皮下组织。
移除胸腔镜和牵引器,使用3-0缝线缝合肌肉层。使用3-0缝线以埋入式简单连续缝合方式或十字形缝合方式缝合皮下组织。皮肤用皮肤胶缝合。从胸管排出空气和血清液,直至达到负压。手术时间为117分钟,估计失血量为3 mL。肿块的组织学检查结果符合肺癌,并伴有肺内和胸膜转移。
04 预后
麻醉后恢复顺利,拔管时体温过低,为32.9°C,需要面罩供氧才能维持正常饱和度,因此被留在加热氧气笼中过夜。一直接受静脉输液和加巴喷丁(10 mg/kg,每天口服三次)。考虑到术前存在厌食,预防性地服用了昂丹司琼(0.5 mg/kg,IV,每天两次)。术后继续使用抗生素(氨苄西林/舒巴坦,30 mg/kg,IV,每天三次)24小时。
术后1天,神志清醒,感觉舒适,进食顺畅。随后几天,出现了血清性胸腔积液,每天12-16 mL。
术后5天,胸管每天抽吸一次,呼吸状况没有受到影响。主人要求拔掉胸管,出院回家。出院后,根据需要服用加巴喷丁和米氮平(1.88 mg,每天口服一次)。
术后10天,突然出现嗜睡和呼吸困难,主人决定实施安乐死,并拒绝接受进一步的影像学检查。
 | 品种:短毛猫 |
| 年龄:7个月 | |
| 性别:雌 | |
| 诊断:气道异物 | |
05 主诉及病史
因咳嗽6天转诊。
06 检查
体重3.6千克。全血细胞计数在正常范围内。胸部X光检查发现右侧后部主干支气管内有异物(下图)。

↑ 箭头指向异物。
尝试在支气管镜下取出异物,但没有成功。可以看到一个玻璃异物,有适量的脓性分泌物,可以抓住,但由于异物固定得太牢固而无法取出,牵引导致异物边缘断裂了一小块。
07 手术
左侧卧位。触诊肋骨,用11号手术刀在第5肋间隙切开1 cm皮肤。从深层组织钝性剥离皮下脂肪。使用双极电刀对出血血管进行止血。将3.9 mm螺纹内窥镜套管插入切口,然后插入3.3 mm 30°内窥镜。对胸腔进行了探查,但可视范围非常有限。
在第一个切口的尾部和背侧第8肋间隙处又做了一个切口。通过这个切口插入一根弯曲的2 mm Steinmann针(下图),在第8肋上用作钩子,以抬起胸壁。用灭菌自粘绷带将针固定在支架上,同时监测是否达到最大效果。
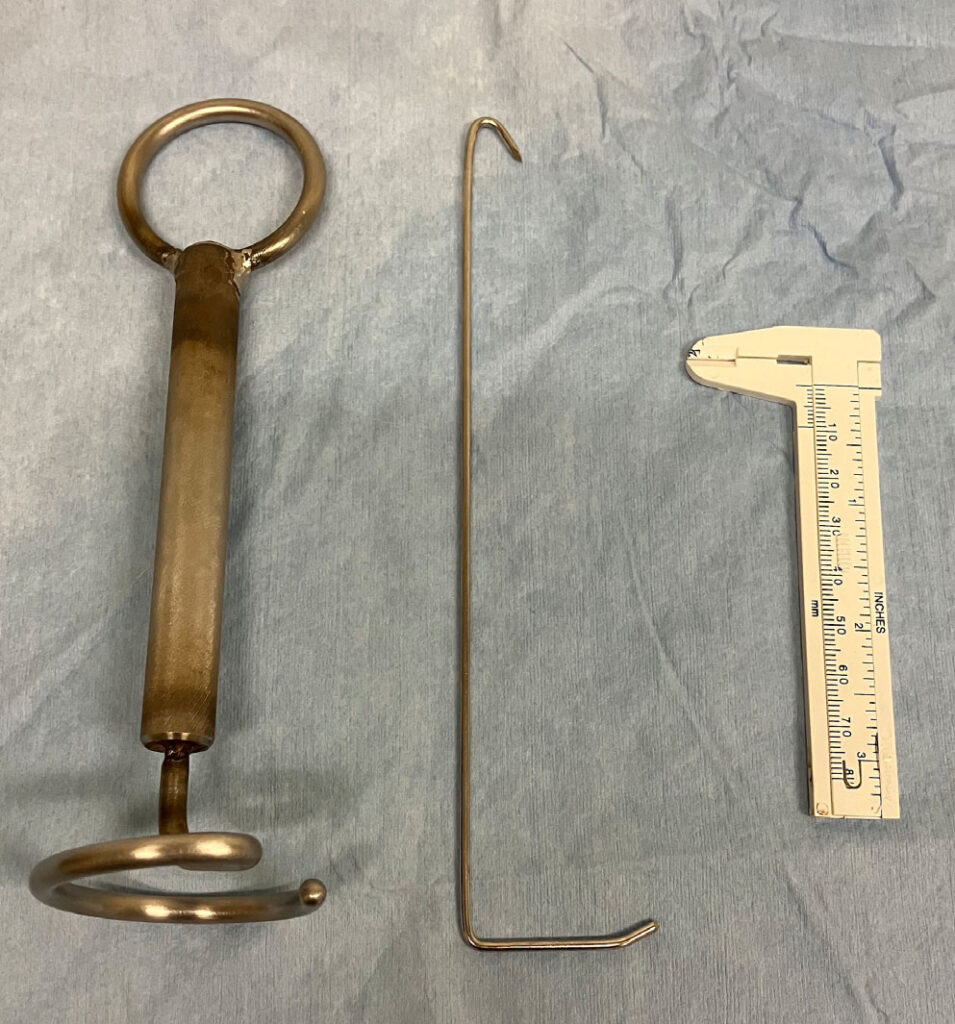
↑ 用于提升胸壁的装置。
在胸腔镜引导下,在第5肋间再做一个切口。用一个3 mm探针穿过最尾端的切口,向腹侧牵开右肺尾叶,以暴露右肺韧带。使用3 mm腹腔镜剪刀横切韧带。在胸腔镜引导下,将结扎环穿过右肺尾叶至肺门水平并收紧(下图)。
↑(A)提升之前的视野。(B)装置上施加张力后视野变大。(C)肺韧带切开至肺门。(D)自锁环缝线放置。(E)缝合线收紧。(F)切除的肺叶及异物。
将摄像机移至最尾端的切口,与提升装置并排,并稍微扩大摄像机端口的切口,轻轻地将肺叶拉过(下图)。在胸腔外用Metzenbaum剪刀在离结扎处5 mm处横切右侧尾肺叶。确认异物与肺叶一起被完全取出,并取样进行培养和药敏试验。
↑(A)使用弯曲的Steinmann针通过最尾部的切口提起胸壁。探头用于帮助将缝合线放置在肺门处。(B)在胸腔镜引导下,将肺叶取出。
用温生理盐水灌洗胸腔。在20 cmH2O条件下屏气5秒钟,进行了两次漏气测试,均未发现漏气。关闭切口和放置胸管的步骤与病例1相同,布比卡因脂质体注射悬浮液同样通过浸润阻滞给药。手术时间为141分钟,估计失血量为1 mL。
08 预后
术后恢复过程并不顺利,一直静脉注射0.9%氯化钠。氢吗啡酮每6小时静脉注射一次,每次0.05 mg/kg。继续口服加巴喷丁(14 mg/kg,一天三次)。
术后数小时,神志清醒,但没有食欲,体温升高至40.2°C,开始静脉注射抗生素(氨苄西林钠/舒巴坦,20 mg/kg)。
术后1天,神志清醒,感觉舒适,但持续高热和厌食。停用了阿片类药物,并开始口服罗贝考昔(1 mg/kg)。由于胸管在术后恢复过程中作用甚微,因此将其拔除。
术后2天,食欲良好,体温降至39.7°C,停止静脉输液后体温保持稳定。当天晚些时候出院,开始服用阿莫西林/克拉维酸(17.8 mg/kg,每天两次,PO)10天,加巴喷丁(10 mg/kg,每天两次,PO)10天,罗贝昔布(1 mg/kg,每天一次,PO)3天。
术后2周,伤口愈合良好,主人说在家里一直表现良好。
术后1年,主人表示猫在手术后的表现一直很好。
09 讨论
随着宠物主人对微创手术的热情日益高涨[1],通过较小切口实现标准胸腹手术的要求也越来越多。与标准方法相比,微创手术的优点包括可视性更好、术后疼痛减轻、住院时间缩短、恢复正常活动更快以及伤口并发症减少[2,3]。
猫等体型较小的患者因工作空间狭窄、孔间距离不足而造成不利条件[4]。不过,简单和先进的腹腔镜手术已在猫和较小的哺乳动物身上成功实施[5,6]。腹壁的顺应性允许二氧化碳充气(CDI)增加工作空间。相比之下,较硬的肋骨和胸骨明显限制了胸壁的扩张,胸腔内CDI通过压迫器官来增加工作空间,从而导致心肺功能严重受损[7]。
单肺通气是通过限制一侧胸腔的肺实质和呼吸运动来增加胸部视野和工作空间的最常用技术[8]。一项在猫身上进行的实验研究对同时使用CDI和单肺通气进行了评估,但发现这两种方法都很耗时,而且近一半的尝试都不成功[9]。猫的单位肺容积胸壁顺应性分别是人和狗的23倍和16倍以上[10]。因此,猫的胸壁更有弹性,加上猫的体重较小,压缩或扩张胸部所需的力量明显更小。
上世纪70年代,人类文献首次提出抬起胸骨,以便在迷走神经切断术中更好地进入前腹部[11,12],十多年后,经颈部胸腺切除术中再次使用了这一方法[13]。牵开器被固定在刚性杆上,同时尽可能用力地抬起胸骨[11,12]。
20世纪90年代首次报道在胸腔镜手术中抬起胸壁,以改善纵隔入路的工作空间[14]。从那时起,胸腔内窥镜手术中就出现了多种提升胸骨、肋弓或肋骨的方法[15]。每种设备都旨在提高可操作性,同时保持微创和用户友好[15],但对于小型动物患者较小的胸腔来说,这些设备仍然过于庞大。
有报道称,提升腹腔镜已成功地在家养猫身上进行了无充气手术[16],但兽医文献中还没有关于使用胸壁提升器的报道。本报告在2只猫身上成功使用了胸壁提升装置进行胸腔镜手术。这是兽医学领域首次报道使用这种技术。该技术避免了对第一只猫进行开胸肋间切开术,并使第二只猫成功进行了三孔视频辅助胸腔镜手术肺叶切除术。虽然人类也有特定的设备,但使用简单的弯曲Steinmann针通过胸腔镜入口的同一切口插入,被认为是相对简单的操作,并显著增加了工作空间,而不会增加发病率。
总之,这是兽医学领域首次报道胸壁提升术。在两只猫患者中,胸壁上提是一种可行的选择,可在胸腔镜手术中提供更好的视野和工作空间。
文献来源:Aertsens A, Tsoi H, Esala M, Wheeler EP. Chest wall lift for thoracoscopic lung lobectomy: Technique and results in two cats. Vet Surg. 2025 Jan 10.
参考文献
1. Hsueh C, Giuffrida M, Mayhew PD, et al. Evaluation of pet owner preferences for operative sterilization techniques in female dogs within the veterinary community. Vet Surg. 2018; 47(S1): O15-O25.
2. Freeman LJ, Rahmani EY, Al-Haddad M, et al. Comparison of pain and postoperative stress in dogs undergoing natural orifice transluminal endoscopic surgery, laparoscopic, and open oophorectomy. Gastrointest Endosc. 2010; 72: 373-380.
3. Schmiedt C. Small animal exploratory thoracoscopy. Vet Clin North Am Small Anim Pract. 2009; 39: 953-964.
4. Radlinsky M. Thoracoscopy in the cat: an up-and-coming diagnostic and therapeutic procedure. J Feline Med Surg. 2014; 16: 27-33.
5. McCready J, Beaufrere H, Singh A, Oblak M, Sanchez A. Laparoscopic ovariectomy in Guinea pigs: a pilot study. Vet Surg. 2020; 49(S1): O131-O137.
6. Case JB, Adin C, Chiquitha C, Gilor C. Laparoscopic partial pancreatectomy of the left limb using a harmonic scalpel in nine cats. Vet Surg. 2024; 53: 350-356.
7. Daly CM, Swalec-Tobias K, Tobias AH, Ehrhart N. Cardiopulmonary effects of intrathoracic insufflation in dogs. J Am Anim Hosp Assoc. 2002; 38: 515-520.
8. Pascoe PJ MP. Anesthesia for thoracoscopy. In: B Fransson (ed), P Mayhew(ed). Small Animal Laparoscopy and Thoracoscopy ( Second edition). Wiley Blackwell, 311–327, 2021.
9. Mayhew PD, Pascoe PJ, Shilo-Benjamini Y, Kass PH, Johnson LR. Effect of one-lung ventilation with or without low-pressure carbon dioxide insufflation on cardiorespiratory variables in cats undergoing thoracoscopy. Vet Surg. 2015; 44(S1): 15-22.
10. Crosfill ML, Widdicombe JG. Physical characteristics of the chest and lungs and the work of breathing in different mammalian species. J Physiol. 1961; 158: 1-14.
11. Goligher JC. A technique for highly slective (parietal cell or proximal gastric) vagotomy for duodenal ulcer. Br J Surg. 1974; 61: 337-345.
12. Berrisford RG. A simple sternum-lifting retractor for vagotomy. Trop Doct. 1991; 21: 87.
13. Cooper JD, Al-Jilaihawa AN, Pearson FG, Humphrey JG, Humphrey HE. An improved technique to facilitate transcervical thymectomy for myasthenia gravis. Ann Thorac Surg. 1988; 45: 242-247.
14. Novellino L, Longoni M, Spinelli L. “Extended” thymectomy, without sternotomy, performed by cervicotomy and thoracoscopic technique in the treatment of myasthenia gravis. Int Surg. 1994; 79: 378-381.
15. Shiono H. Anterior chest wall lifting methods for mediastinal approach-literature review. Mediastinum. 2022; 6: 24.
16. Fransson BA, Ragle CA. Lift laparoscopy in dogs and cats: 12 cases (2008–2009). J Am Vet Med Assoc. 2011; 239: 1574-1579.