| 品种:短毛猫 | |
| 年龄:13岁 | |
| 性别:雄 | |
| 诊断:尿路上皮癌 | |
01 主诉及病史
因跛行、食欲不振、便秘以及在过去2个月中体重逐渐下降就诊。
就诊时,肾脏指标显示为国际肾脏病协会(IRIS)2期。
02 检查
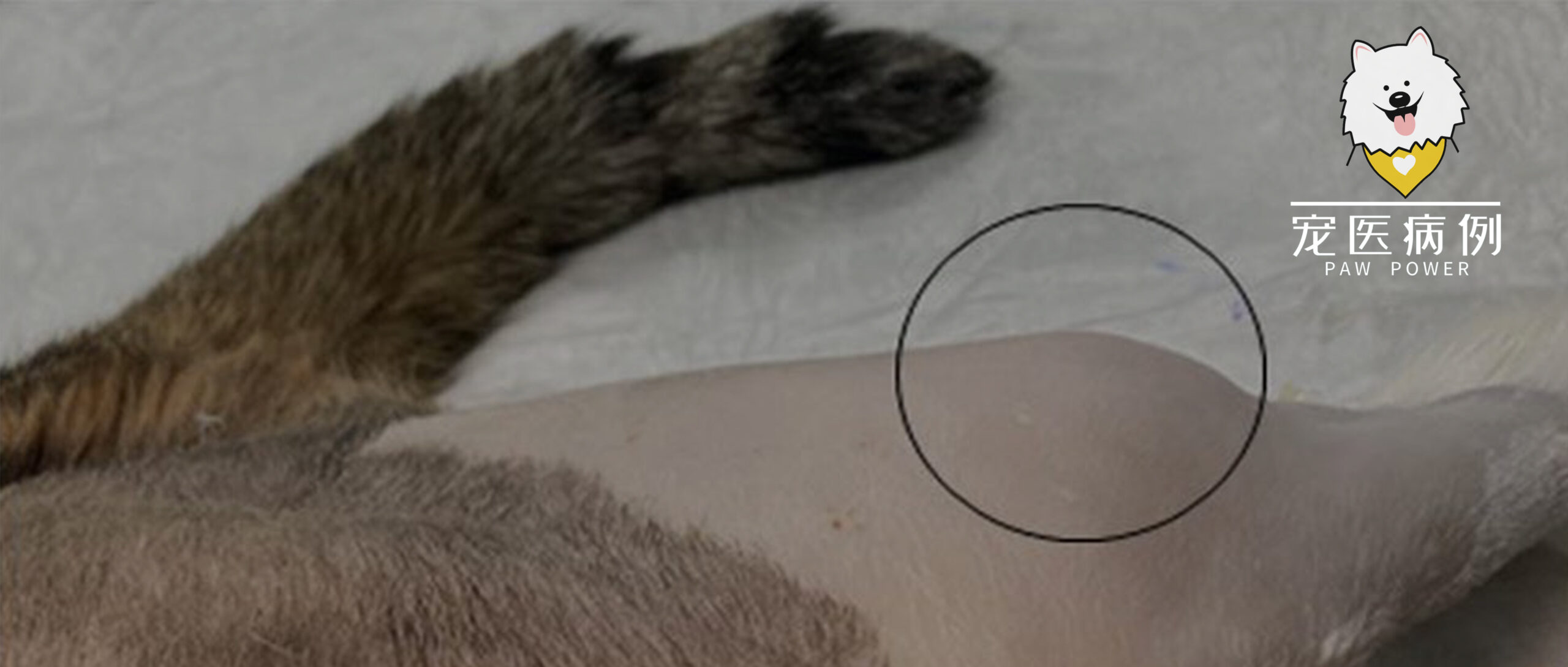
体重8千克。触诊发现左前肢和双后肢的肌肉上有几个肿块(下图)。
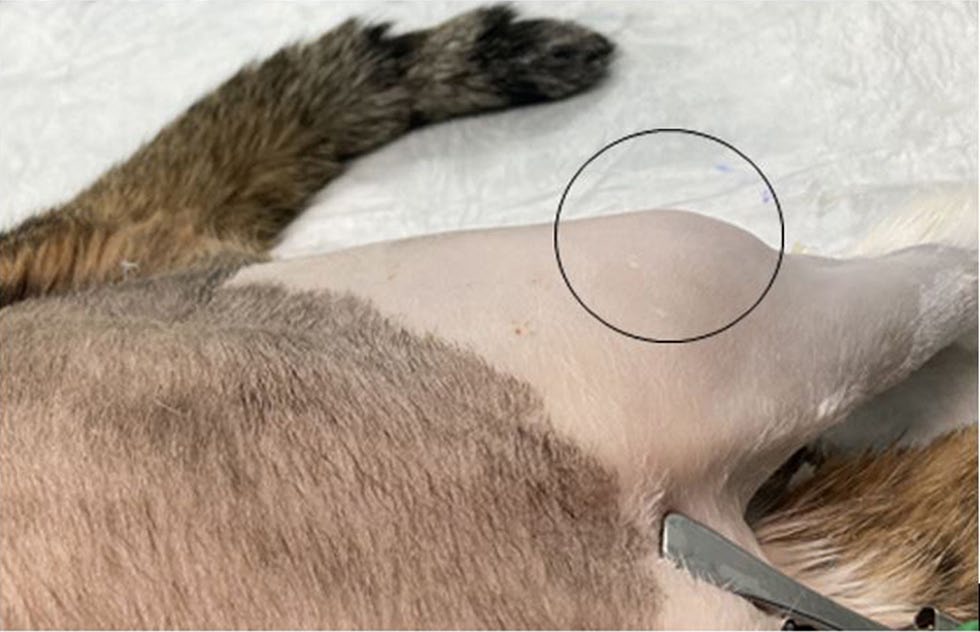
↑ 肿块导致腓肠肌外侧头畸形(圆圈)。
患肢和胸部进行的放射学检查显示,左股骨干骺端头侧和内侧近三分之一处出现了活跃的骨膜反应,右腓骨近端形状发生了变化,大腿尾部和与跗骨有关的尾骨肌肉的放射性增高(下图)。胸部X光片显示肺部有弥漫性慢性间质性病变。
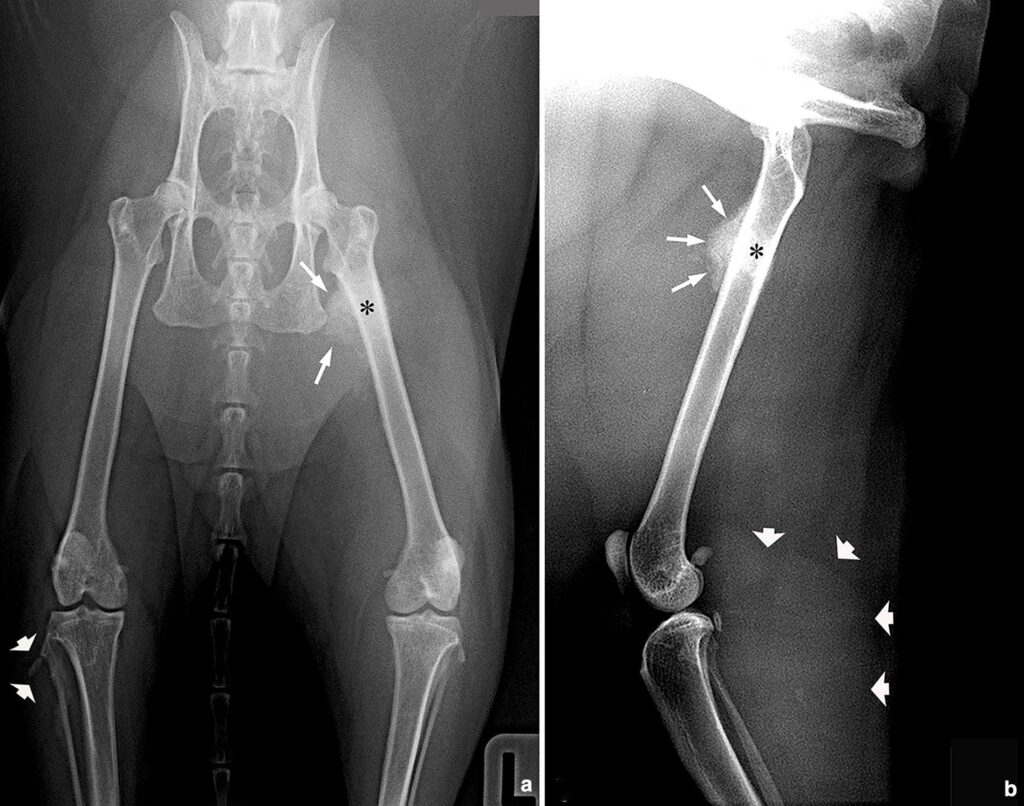
↑ (a)髋关节伸展的腹背X线投影,包括双跗关节的头尾X线投影;(b)左髋关节和跗关节的内外侧投影。股骨的头侧和内侧有骨膜反应,不透明程度低于骨质(白色箭头),干骺端相应区域有硬化(星号)。内部皮质或骨膜完好无损。(a)右侧腓骨近端也有重塑(短箭头),超声还在腓骨长肌中发现了一个结节。(b)左跗骨尾部的软组织放射性增高(短箭头)。
肾脏超声显示,双侧肾皮质高回声,边缘不规则。左肾体积(3.51×2.93 cm)小于右肾(4.63×2.49 cm),均呈高回声楔形病变,基底位于肾囊,顶点位于肾皮质髓质交界处,符合慢性肾梗死。下尿路和腹部超声未见其他明显变化(下图)。
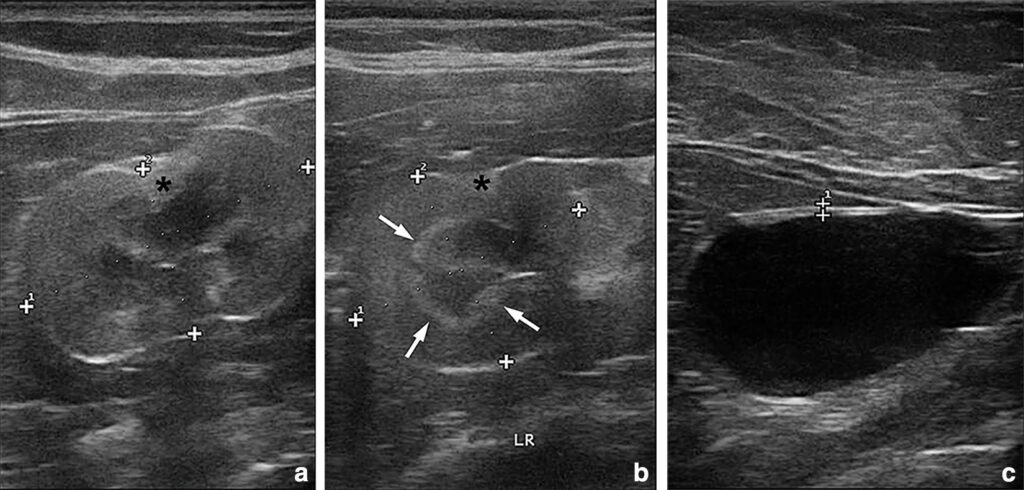
↑ (a)右肾大小正常,皮质高回声,边缘不规则。肾皮质可见高回声楔形切面(星号),符合慢性肾梗死。(b)左肾比正常略小,同样表现为边缘不规则、皮质高回声和慢性肾梗死区(星号);此外,尾极结构紊乱,可观察到髓质带征(箭头)。(c)膀胱超声正常。
肢体超声显示出圆形或椭圆形病变,病变中心为无回声区,包含或多或少的明显回声带,类似于小梁结构,周围是厚厚的高回声带(下图a)。所有病变周围都有肌肉纤维,但病变的大小和涉及的肌肉在受影响的肢体中各不相同。对部分病变进行的彩色多普勒检查显示,这些病变的血管生成较差(1级)(下图b)。
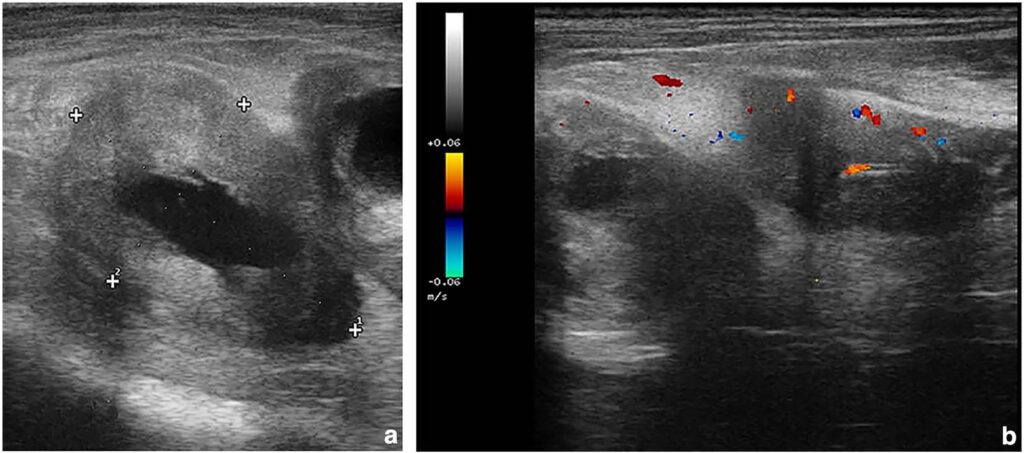
↑ (a)位于左侧半膜肌内的囊性肿块的超声图像。中央区域有一个低回声的组织带。(b)左侧腓肠肌外侧头的彩色多普勒显像。肿块的血管很少,主要位于外周,偶尔位于中央。
在三个不同的肢体中,共有6块肌肉出现病变,只有腓肠肌外侧头受到双侧影响(下表)。
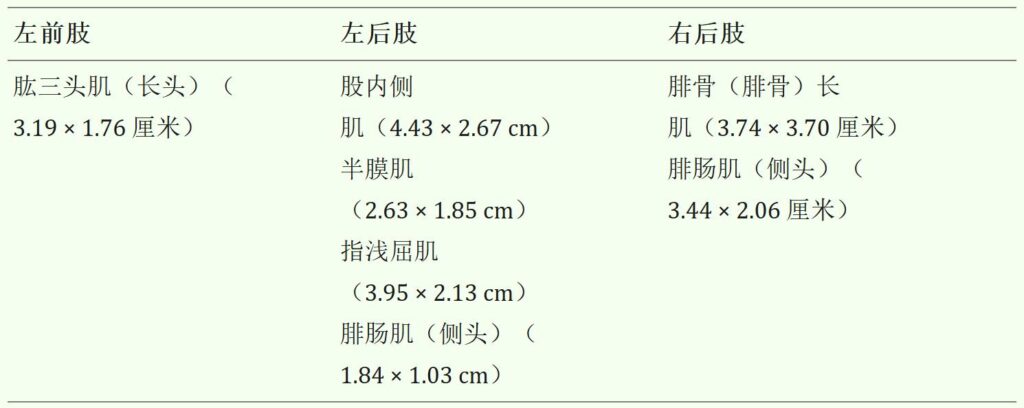
↑ 第一次超声检查时尿路上皮癌转移在四肢肌肉中的分布和大小。右前肢未受累。
最初的治疗是对症治疗,包括服用罗贝考昔(12 mg q24h,连续6天)。
由于临床症状恶化,包括疼痛和站立困难,以至于无法站着进食,2周后再次进行了超声检查。病灶的大小有所增加,显示出几个无回声中心,外周显示出带声影的高回声区(下图c-f)。
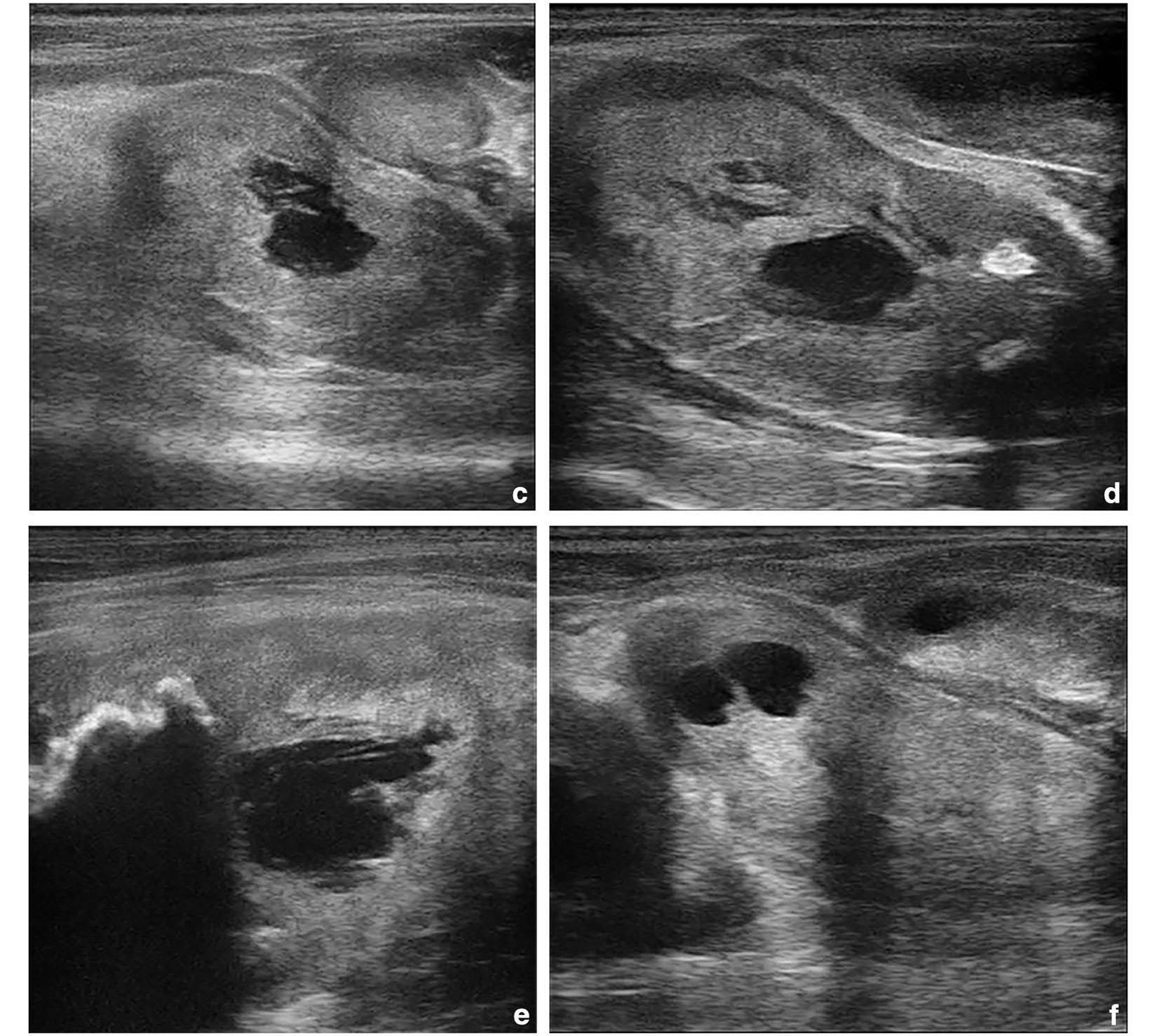
↑ (c)位于左后肢浅层屈肌的肿块,随着病变的发展,高回声带更宽且更不均匀,中央无回声区更小,有时呈小梁结构。(d)表浅屈肌,周围反应性组织显示更多的高回声病灶,声影不一,提示更高程度的区域内纤维化。(e)大腿内侧肌,邻近的左股骨近端干骺端有骨膜反应。(f)股浅屈肌,较晚期病变的中央区域和周围结缔组织带均出现无回声病灶。最小的结节位于左侧腓肠肌外侧头,首次就诊时的大小为1.84×1.03 cm,2周后的最大肿块则位于左浅层屈肌,大小从3.95×2.13 cm增至5.36×2.63 cm。
在超声引导下,对右侧腓肠肌外侧头的一个结节进行了细针穿刺,结果发现了一个高度细胞化的样本,其中有大量大的多形性肿瘤细胞,这些细胞孤立或聚集成团,与细胞碎片混杂在一起(下图a)。肿瘤细胞表现出明显的异形核和异形细胞、中央或偏心的大圆核、突出的核仁和中等至丰富的嗜碱性细胞质。偶尔还能观察到与印戒细胞一致的淡色胞质内包涵体或空泡(下图b)。这些发现符合恶性上皮肿瘤,建议进行切除活检以明确诊断。

↑ (a)细针穿刺细胞学检查显示一大团肿瘤细胞。(b)在大量细胞碎片之间有大的、孤立的、多形性的肿瘤细胞,偶尔有胞质内空泡(印戒细胞)(箭头)。
03 治疗
在全麻下,位于左侧腓肠肌外侧头的病灶被完全切除。
在手术切片上,结节的壁厚而坚硬,呈白色,有一个狭窄的中心腔,腔内充满坏死细胞碎片(下图a)。显微镜下,囊性结节的壁由小管-乳头状结构形成,其上覆盖着肿瘤性移行上皮(尿路上皮),并有中度到大量纤维基质支撑(下图bc)。上皮外层显示出尿路上皮特有的圆形细胞(伞状细胞)。细胞质丰富,有常见的嗜酸性和大的嗜酸性空泡。还经常观察到由于肿瘤细胞上皮内变性而形成的假性囊肿(下图c)。有丝分裂计数很高(在2.37平方毫米的面积上有10个以上有丝分裂)。总体而言,组织病理学特征与呈现囊性生长模式的转移性尿路上皮癌一致。
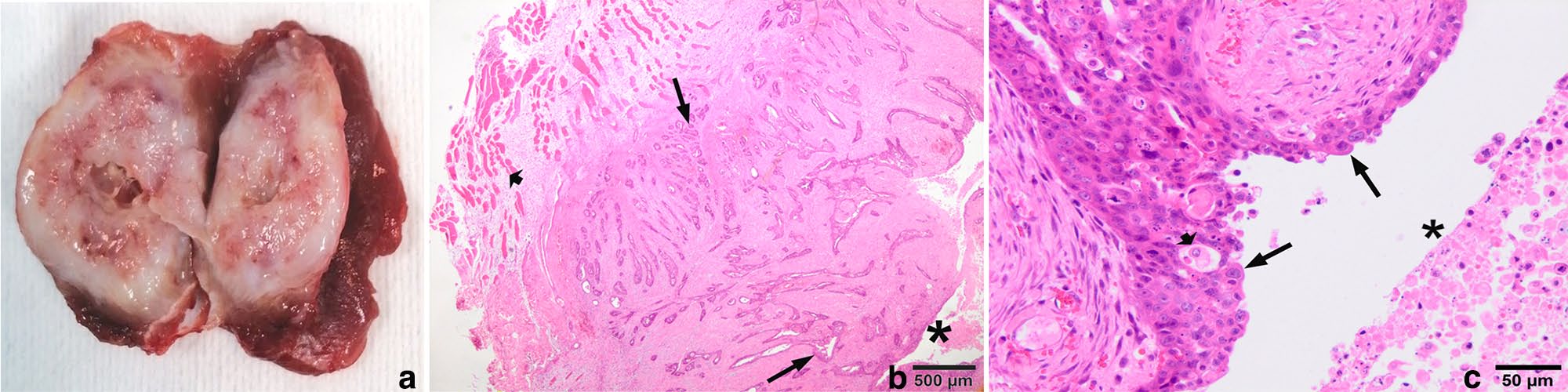
↑ (a)一个界限清晰的囊性结节的矢状切面,显示出厚厚的白色瘤壁和狭窄的瘤腔。(b)在低倍镜下,肿瘤壁上有许多浸润性条索状、巢状和乳头状的肿瘤性尿路上皮(黑色箭头)结构,形成一个中央管腔(见[b]和[c]中的星号)。病变外侧出现肌纤维移位(短箭头)。(c)尿路上皮细胞的细节,显示表面的伞状细胞(黑色箭头)、中间层的胞浆内空泡和囊性变性的肿瘤细胞(短箭头)。
肿瘤上皮细胞的AE1/AE3在各层均显示出强烈而弥漫的胞浆免疫标记(下图a)。波形蛋白抗体与肿瘤基质反应强烈,很少与肿瘤细胞反应(下图b)。UPIII表达呈弱-中-强,随机分布于整个肿瘤性尿路上皮细胞;个别浅表肿瘤细胞、伞状细胞强表达UPIII(下图c)。CK7抗体与许多表层细胞强烈反应,但在中层和基底层的肿瘤细胞中也有不规则表达(下图d)。CK20抗体在肿瘤尿路上皮细胞各层均显示微弱且不规则的免疫标记(下图e)。Ki67抗体在肿瘤细胞的大量细胞核中强表达(下图f)。Ki67指数为70%。总体而言,这些结果证实了肿瘤细胞的尿路上皮性质以及强转移性。
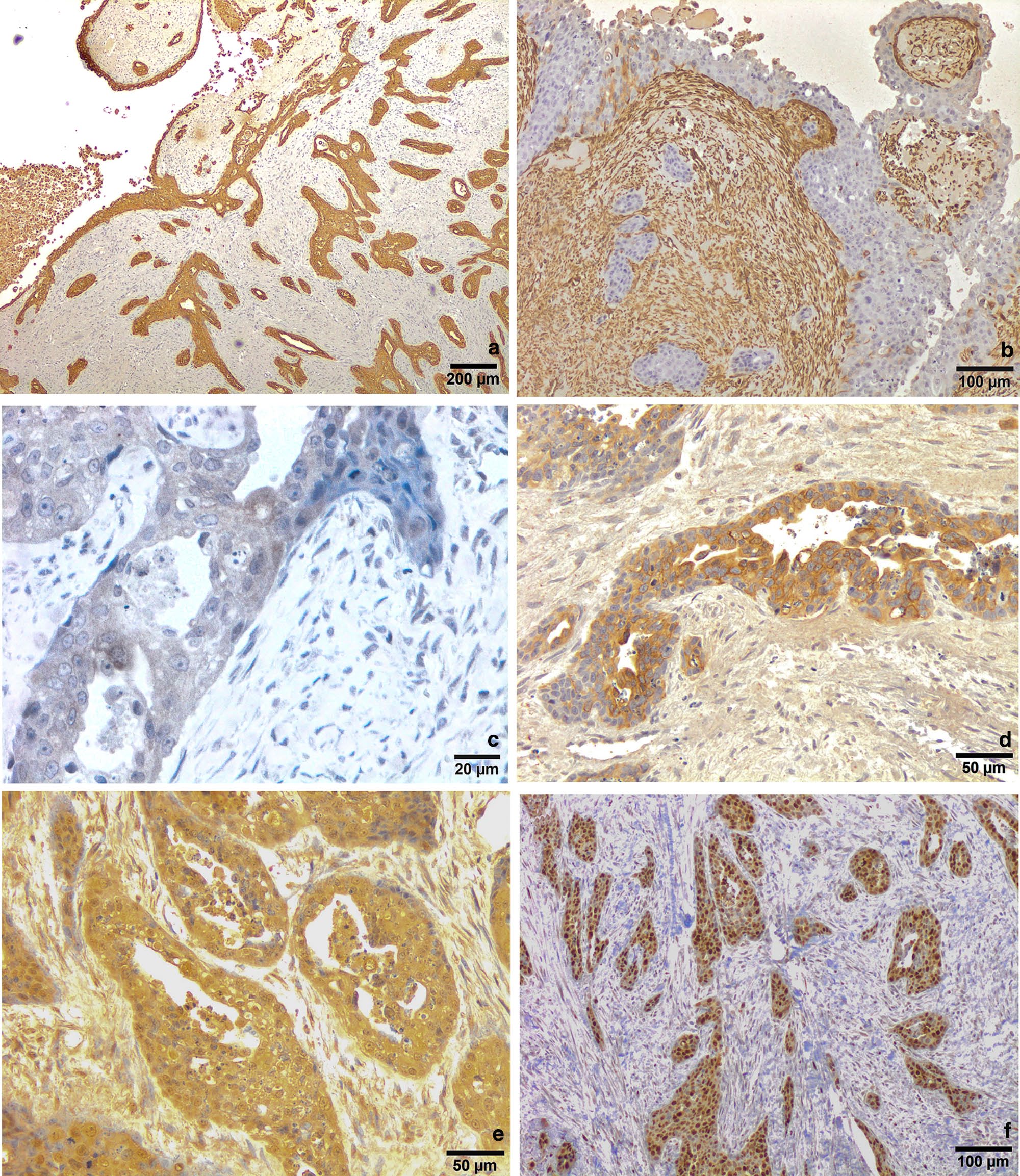
↑ (a)AE1/AE3抗体显示肿瘤尿路上皮各层均有弥漫性强标记。(b)对波形蛋白的免疫标记仅限于结节的基质。肿瘤性尿路上皮细胞呈阴性。(c)整个肿瘤性尿路上皮细胞中没有UPIII表达或呈弱阳性,而许多表层肿瘤细胞与抗体反应强烈。(d)大量表层伞状细胞观察到CK7的表达,中层的离体细胞也有随机反应。(e)CK20在所有细胞层都有中度表达。(f)Ki67在大多数肿瘤细胞的细胞核中强表达。
04 预后
在组织病理学诊断为转移性尿路上皮癌后,主人拒绝进行进一步的影像学检查,并实施了安乐死。主人拒绝进行尸检。
05 讨论
尿路上皮癌(Urothelial carcinoma,UC)又称移行细胞癌,在所有物种中都是一种侵袭性很强的肿瘤,但在猫中却很罕见[1,2]。在猫中,膀胱是UC最常见的发病部位,肾盂、输尿管和尿道则较少见。
UC确诊时的转移率很高,占猫UC病例的12.7-20%[1,3]。转移到肺部和淋巴结是最常见的,但也有罕见病例报告转移到其他器官,如大肠、眼睛和腹壁[1,3-5]。腹壁转移大多与膀胱穿刺活检时的针道有关[6,7]。在对一只眼睛和心肌都有UC转移瘤的猫进行尸检时,偶然发现了一条腿上有肌肉转移[5]。
猫UC最常见的发病部位是膀胱,但许多猫并没有出现与下尿路相关的临床症状[2,3]。在本病例中,膀胱的超声检查正常,也没有下尿路疾病的临床症状,如果输尿管或尿道是肿瘤的原发部位,则可能会出现下尿路疾病的临床症状,这表明肿瘤最有可能起源于肾脏。
肾脏超声结果表明患者患有后天性慢性疾病,但对原发肿瘤的存在并无定论。此前曾有报道称,UC病例的超声检查缺乏敏感性[4,5]。在两只出现慢性肾脏疾病超声变化的猫中,肾脏UC在死后被确诊[4]。因此,鉴于没有下尿道体征和超声结果,原发肿瘤很可能很小,而且位于肾脏,尽管由于没有进行尸检,无法发现原发肿瘤和其他潜在的转移病灶,这也是本病例报告的局限性。
一般来说,原发性和转移性肌肉肿瘤在猫中都很罕见。在一项包括193只猫的回顾性研究中,报告的发病率为3.1%(即6只猫)。不同组织学来源的癌可能会导致猫的肌肉骨骼转移,但在一项尸检研究中,UC的发病率仅为0.068% [10],而且以前也没有报告描述过与之相关的临床症状和超声特征。在患有肌肉肿瘤的猫中,较常见的临床症状从高到低依次为厌食、不愿活动、抑郁、呼吸困难和跛行[15],这种临床表现与本报告病例中出现的大多数临床症状相符。
总之,这是首例关于UC猫肌肉多发转移瘤的报道。虽然无法找到原发肿瘤,但通过对转移瘤进行组织病理学和免疫组化分析,确诊了该病。这种不寻常的临床表现应在猫肌肉多发性结节或囊性病变的鉴别诊断中加以考虑。
文献来源:Hernández EM, Ginel PJ, Blanco B, Millán Y, Jiménez MT, Mozos E. Metastatic urothelial carcinoma in multiple appendicular muscles of a cat. JFMS Open Rep. 2025 Jan 6;11(1):20551169241303217.
参考文献
1. Wilson HM, Chun R, Larson VS, et al. Clinical signs, treatments, and outcome in cats with transitional cell carcinoma of the urinary bladder: 20 cases (1990–2004). J Am Vet Med Assoc 2007; 231: 101–106.
2. Weyden L, O’Donnell M, Plog S. Histological characterization of feline bladder urothelial carcinoma. J Comp Pathol 2021; 182: 9–14.
3. Griffin MA, Culp WT, Giuffrida MA, et al. Lower urinary transitional cell carcinoma in cats: clinical findings, treatments, and outcomes in 118 cases. J Vet Intern Med 2020; 34: 274–282.
4. Hanzlicek A, Ganta C, Myers C, et al. Renal transitional-cell carcinoma in two cats with chronic kidney disease. J Feline Med Surg 2012; 14: 280–284.
5. Grader I, Southard TL, Neaderland MH. Renal transitional cell carcinoma with bilateral ocular metastasis. JFMS Open Rep 2016; 2.
6. Nyland TG, Wallace ST, Wisner ER. Needle-tract implantation following us-guided fine-needle aspiration biopsy of transitional cell carcinoma of the bladder, urethra, and prostate. Vet Radiol Ultrasound 2002; 43: 50–53.
7. Higuchi T, Burcham GN, Childress MO, et al. Characterization and treatment of transitional cell carcinoma of the abdominal wall in dogs: 24 cases (1985-2010). J Am Vet Med Assoc 2013; 242: 499–506.
8. Öhberg L, Lorentzon R, Alfredson H. Neovascularisation in Achilles tendons with painful tendinosis but not in normal tendons: an ultrasonographic investigation. Knee Surg Sports Traumatol Arthrosc 2001; 9: 233–238.
9. Yeh C, Chen J, Li M, et al. In vivo imaging of blood flow in the mouse Achilles tendon using high-frequency ultrasound. Ultrasonics 2009; 49: 226–230.
10. Wimberly CK, Lewis RM. Transitional cell carcinoma in the domestic cat. Vet Pathol 1979; 16: 223–228.
11. Ramos-Vara JA, Miller MA, Boucher M, et al. Immunohistochemical detection of uroplakin III, cytokeratin 7, and cytokeratin 20 in canine urothelial tumors. Vet Pathol 2003; 40: 55–62.
12. Rasteiro AM, Lemos S, Oliveira PA, et al. Molecular markers in urinary bladder cancer: applications for diagnosis, prognosis and therapy. Vet Sci 2022; 9: 107.
13. Matsumoto K, Satoh T, Irie A, et al. Loss expression of uroplakin III is associated with clinicopathologic features of aggressive bladder cancer. Urology 2008; 72: 444–449.
14. Espinosa de los Monteros A, Fernández A, Millán MY, et al. Coordinate expression of cytokeratins 7 and 20 in feline and canine carcinomas. Vet Pathol 1999; 36: 179–190.
15. Vignoli M, Terragni R, Rossi F, et al. Whole body computed tomographic characteristics of skeletal and cardiac muscular metastatic neoplasia in dogs and cats. Vet Radiol Ultrasound 2013; 54: 223–230.