
| 品种:短毛猫 | |
| 年龄:9岁 | |
| 性别:雄 | |
| 诊断:分枝杆菌感染 | |
01 主诉及病史
长达12个月的皮下结节病史。
当地兽医首次对其进行评估时发现,腹股沟区域有多个半坚实的皮下结节,大小为1-2 cm。接受了头孢霉素治疗(8 mg/kg,皮下注射一次),结节没有变化。
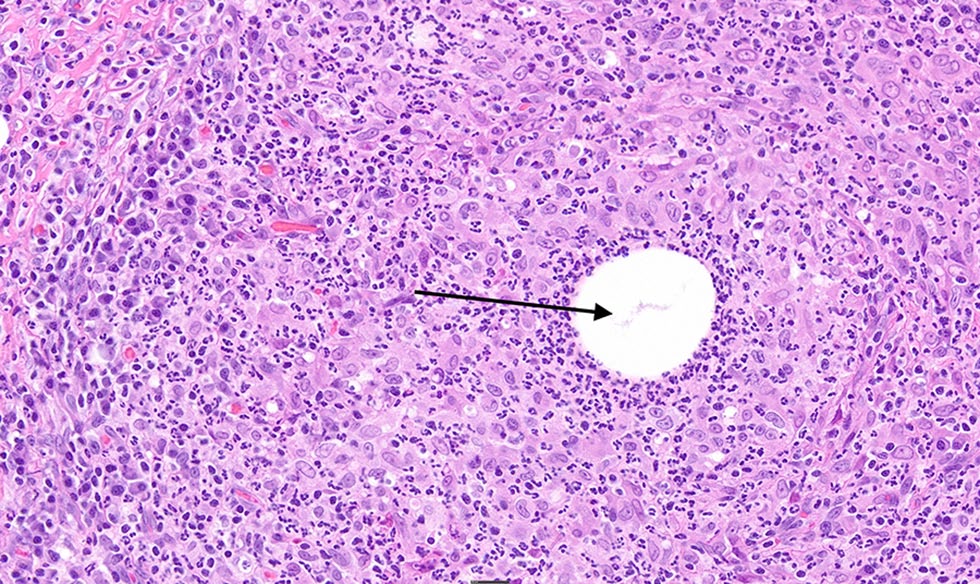
5个月后,皮肤活检组织病理学检查发现了严重的慢性、多灶性至凝聚性化脓性皮炎和泛发性皮炎,并伴有溃疡和中心坏死(下图),未检出微生物。
3个月后,腹股沟区皮下结节的皮肤需氧细菌培养在羊血琼脂培养基上经过8天培养后发现了分枝杆菌。随后患者被转诊。
02 检查
神志清楚、反应灵敏,生命指标正常,体况评分为9/9。腹部和腹股沟区域发现5处皮损,每处皮损直径1-3 cm。其中3个为皮下病变,质地坚硬,可移动,纹理不规则;2个为扁平、可自由移动的斑块状病变,伴有多灶性结痂(下图)。
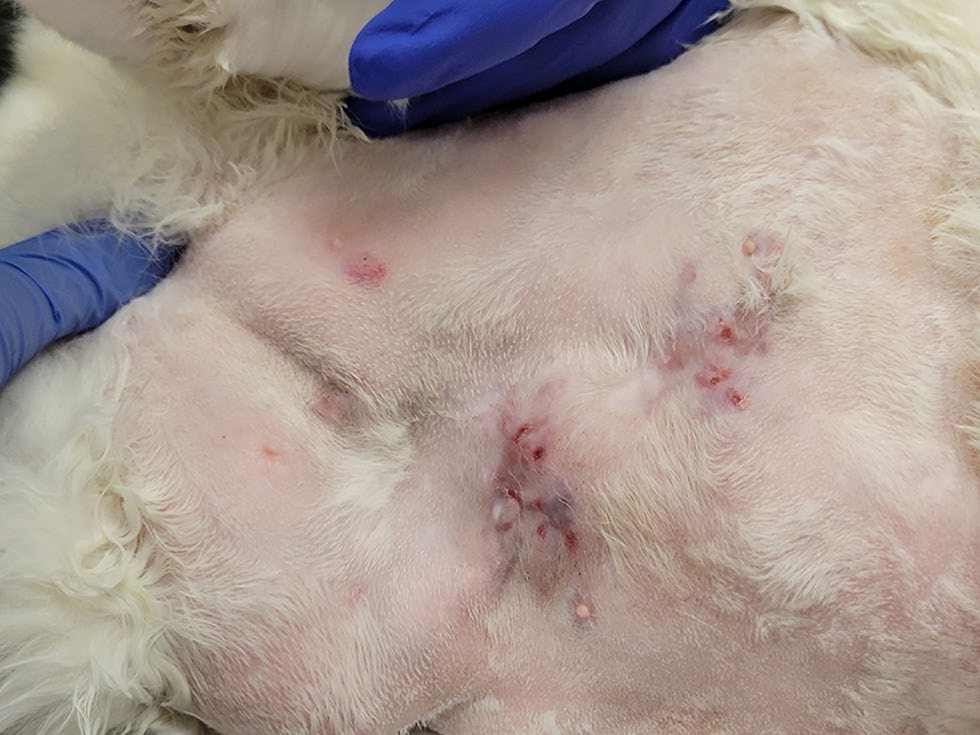
↑ 腹股沟出现多灶性溃疡性皮肤病变。
白细胞轻度增多(14,090个/μL [4500-14,000]),中性粒细胞增多(10,750个/μL [2000-9000])。存在高球蛋白血症(5.8 g/dl [2.8-5.4])。尿比重为1.048,沉淀物不活跃。腹部超声和胸片均无异常。
患处皮肤和皮下组织的穿刺活检样本被送往分枝杆菌实验室进行培养,并使用肉汤微稀释法进行药敏试验。在进行培养和药敏试验之前,开始使用多西环素(6.6 mg/kg PO q12h)和马波沙星(2.6 mg/kg PO q24h)进行抗菌治疗。
在培养的第6周,通过对rpoB基因进行PCR测序,检测出了分枝杆菌M. porcinum。
03 治疗
根据临床反应,继续使用多西环素和马波沙星。
04 预后
9个月后,皮损消退(下图)。随后停用多西环素,继续使用马波沙星2个月。治疗期间,中性粒细胞增多和高球蛋白血症已得到缓解。
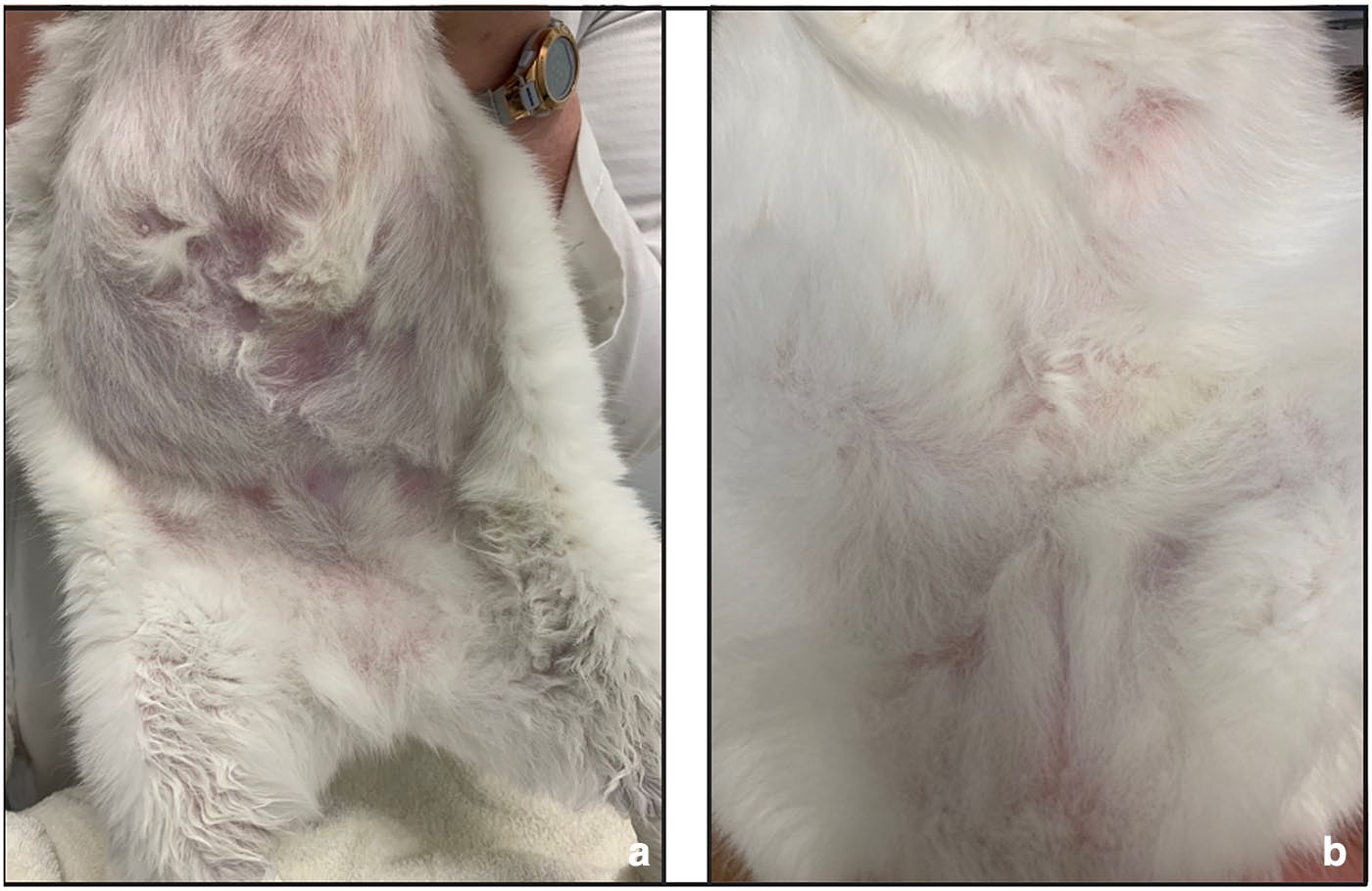
↑ (a)抗菌治疗6周后的腹部和腹股沟区域。(b)抗菌治疗16周后的腹部腹侧和腹股沟区域。
14个月后,腹部出现了新的皮损,而之前的皮损也出现在这里。病灶部位有0.5 cm轻度红斑和表皮增厚。没有进行皮肤活检和培养。重新开始使用马波沙星(2.5 mg/kg PO q24h)。4周后皮损消退,马波沙星又继续使用了4周。
32个月后,没有发现新的病变,此后该猫失去了随访。
05 讨论
分枝杆菌是一种需氧、耐酸的细菌,细胞壁富含复合分枝杆菌酸脂质[1,2]。分枝杆菌大致可分为两类:结核分枝杆菌复合体以及非结核分枝杆菌。非结核分枝杆菌又包括生长缓慢(包括鸟-胞内分枝杆菌复合群)、生长较快(RGM)和快速生长分枝杆菌(如麻风分枝杆菌群)[1,3]。RGM之所以生长较快,是因为在培养过程中一般7天内就能检测到其生长[4]。
RGM是大多数猫皮肤分枝杆菌病的罪魁祸首。传播途径被认为是通过皮肤接触,如在打架受伤后感染,对脂肪组织有趋向性[1,5]。对猫有临床意义的RGM菌种包括M. fortuitum复合群和M. smegmatis复合群,它们普遍存在于土壤或水中[6,7]。在2021年美国加利福尼亚北部的一项研究中,这些是最常见的分离株[8]。
分枝杆菌最常感染的部位是腹股沟皮肤和皮下组织。病变包括皮下脓肿和带有瘘道的不愈合溃疡,统称为分枝杆菌性泛发性炎[5,7]。治疗需要长时间的抗菌治疗[9]。
分枝杆菌M. porcinum是一种最初从猪身上分离出来的RGM[10]。仅有两份报告描述了猫感染M. porcinum后的成功治疗:一份来自加拿大不列颠哥伦比亚省,一份来自美国俄亥俄州[11,12]。另外两份感染报告分别来自澳大利亚东南部和美国马萨诸塞州[13,14]。
在人类中,M. porcinum感染与伤口感染、医疗保健相关感染、导管相关菌血症和骨髓炎有关[4,10,15-17]。虽然美国多个州都有人类感染的病例报告,但美国西部还没有报告。本病例报告描述了美国加利福尼亚州北部一只患有M. porcinum泛发性炎的猫的临床特征、诊断和成功治疗。
户外活动可能是猫感染分枝杆菌的一个危险因素。在英国,339只患有分枝杆菌病的猫中只有2%只在室内生活[18]。本报告中的猫既可出入室内,也可出入室外。虽然没有直接观察到打斗或穿透性损伤,但怀疑传播方式是皮肤接触。肥胖可能会增加感染风险,因为分枝杆菌对脂肪组织很敏感[5,7]。
总之,本报告将M. porcinum的已知空间分布范围扩大到了美国西部,并加强了其与猫的泛发性炎之间的联系。它证明了使用培养法诊断某些RGM感染需要长时间的潜伏期。由于分枝杆菌感染是散发性的,因此类似的病例报告有助于我们逐步了解风险因素、诊断方法、疾病表现和抗菌药敏感性因分枝杆菌种类而异。这些知识有助于临床医生采用最佳方法诊断、治疗和预防猫的分枝杆菌感染。
文献来源:Lee MA, Woerde DJ, Reagan KL, Wolf TG, Sykes JE. Mycobacterium porcinum panniculitis in a cat from northern California. JFMS Open Rep. 2025 Jan 19;11(1):20551169241298058.
参考文献
1. O’Brien CR, O’Halloran C, Gunn-Moore DA, et al. Mycobacterial infections. In: Sykes JE. (ed). Greene’s infectious diseases of the dog and cat. St Louis, MO: Elsevier, 2022, pp 723–749.
2. Pawełczyk J, Kremer L. The molecular genetics of mycolic acid biosynthesis. Microbiol Spectr 2014; 2.
3. O’Halloran C, Gunn-Moore D. Mycobacteria in cats: an update. In Pract 2017; 39: 399–406.
4. Han XY, Dé I, Jacobson KL. Rapidly growing mycobacteria: clinical and microbiologic studies of 115 cases. Am J Clin Pathol 2007; 128: 612–621.
5. Gross T, Ihrke P, Walder E, et al. Opportunistic mycobacterial infection caused by rapidly growing mycobacteria. In: Skin diseases of the dog and cat. Oxford: Blackwell Science, 2005, pp 283–236.
6. Lotti T, Hautmann G. Atypical mycobacterial infections: a difficult and emerging group of infectious dermatoses. Int J Dermatol 1993; 32: 499–501.
7. Malik R, Wigney DI, Dawson D, et al. Infection of the subcutis and skin of cats with rapidly growing mycobacteria: a review of microbiological and clinical findings. J Feline Med Surg 2000; 2: 35–48.
8. Munro MJ, Byrne BA, Sykes JE. Feline mycobacterial disease in northern California: epidemiology, clinical features, and antimicrobial susceptibility. J Vet Intern Med 2021; 35: 273–283.
9. Lloret A, Hartmann K, Pennisi MG, et al. Mycobacterioses in cats: ABCD guidelines on prevention and management. J Feline Med Surg 2013; 15: 591–597.
10. Tsukamura M, Nemoto H, Yugi H. Mycobacterium porcinum sp. nov., a porcine pathogen. Int J Syst Evol Microbiol 1983; 33: 162–165.
11. Cox A, Udenberg TJ. Mycobacterium porcinum causing panniculitis in the cat. Can Vet J 2020; 61: 39–43.
12. Brown R. Mycobacterial infection in a cat. https://todaysveterinarynurse.com/dermatology/mycobacterial-infection-in-a-cat/ (2023, accessed 3 April 2024).
13. Govendir M, Norris JM, Hansen T, et al. Susceptibility of rapidly growing mycobacteria and Nocardia isolates from cats and dogs to pradofloxacin. Vet Microbiol 2011; 153: 240–245.
14. Mannion A, McCollester T, Sheh A, et al. Draft genome sequence of a Mycobacterium porcinum strain isolated from a pet cat with atypical mycobacterial panniculitis. Microbiol Resour Announc 2020; 9.
15. Wallace RJ, Jr, Brown-Elliott BA, Wilson RW, et al. Clinical and laboratory features of Mycobacterium porcinum. J Clin Microbiol 2004; 42: 5689–5697.
16. Blau EF, Flinchum A, Gaub KL, et al. Mycobacterium porcinum skin and soft tissue infections after vaccinations – Indiana, Kentucky, and Ohio, September 2018–February 2019. MMWR Morb Mortal Wkly Rep 2021; 70: 1472–1477.
17. Oda G, Winters MA, Pacheco SM, et al. Clusters of nontuberculous mycobacteria linked to water sources at three Veterans Affairs medical centers. Infect Control Hosp Epidemiol 2020; 41: 320–330.
18. Gunn-Moore DA, McFarland SE, Schock A, et al. Mycobacterial disease in a population of 339 cats in Great Britain: II. Histopathology of 225 cases, and treatment and outcome of 184 cases. J Feline Med Surg 2011; 13: 945–952.