
 | 品种:混种犬 |
| 年龄:16岁 | |
| 性别:雄 | |
| 诊断:良性前列腺增生 | |
 | 品种:混种犬 |
| 年龄:12岁 | |
| 性别:雄 | |
| 诊断:良性前列腺增生 | |
01 主诉及病史
间歇性的里急后重及扁平粪便。
没有疾病史,也没有接受过药物治疗。
02 检查
两只狗体况评分均为4/9,体重分别为12公斤(病例1)和33公斤(病例2)。常规体检未见异常。直肠检查发现前列腺增大、对称、光滑且无痛。
都进行了全血细胞计数、血生化、尿检和前列腺B超检查。计算了前列腺体积,病例1在第0天的前列腺体积为81 cm3,病例2为79 cm3。两个前列腺的边界稍不规则,实质不均匀,有多个小囊性结构,提示良性前列腺增生(下图)。
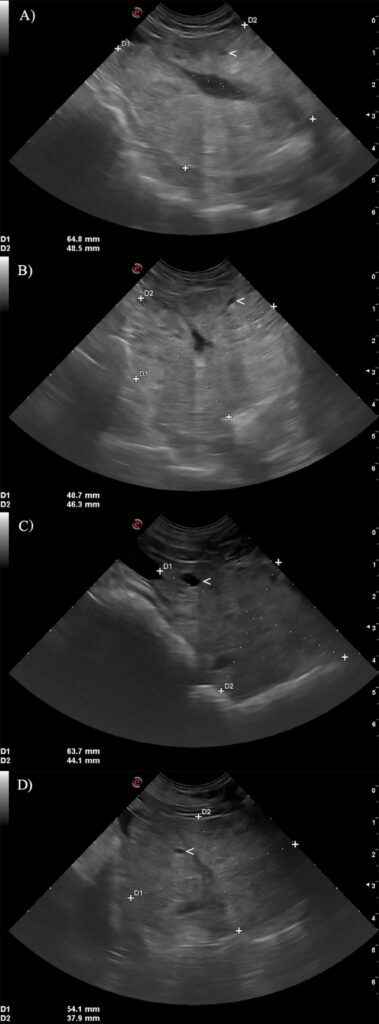
↑ 第0天,病例1的前列腺纵向(A)和横向(B)超声图像以及病例2的前列腺纵向(C)和横向(D)超声图像。在两个前列腺中,都有不规则的边缘,形状不变,实质中有多个非常小的囊性结构(白色箭头)。
通过前列腺细针穿刺细胞学检查结合超声成像证实了良性前列腺增生的诊断。细胞学报告表明,细胞呈片状和簇状排列,呈蜂窝状。表现出均匀的形态,其特征是圆形核和轻度异核。核质比适中,细胞质呈颗粒状和嗜碱性。在检查的涂片中没有观察到明显的非典型特征。
03 治疗
建议进行绝育手术,但被两位主人拒绝。包括非那雄胺在内的标准药物治疗也被拒绝。于是进行草药提取物治疗。治疗开始时,每只狗每天口服300 mg小花柳叶菜(EP)提取物,持续2个月。鉴于缺乏狗使用EP的公开信息,剂量是根据啮齿动物和人类研究中报告的剂量的确定的。

↑ 小花柳叶菜
04 预后
在开始治疗后的第7、15、30和60天进行了B超随访。两名患者对EP耐受良好,未报告任何不良反应。在60天的口服给药期间,未发现血液学或血生化异常。最初较低的血小板计数、尿比重(病例1)和白细胞计数(病例2)在治疗结束后已恢复正常水平。
在两只狗中,前列腺体积在前30天内减少了约40%,然后保持稳定,直到治疗结束。在病例1中,前列腺体积从第0天的81 cm3减少到第60天的50 cm3(减少了38%);病例2中,从第0天的79 cm3减少到第60天的44 cm3(减少了44%)。
第60天,两只狗的血清睾酮浓度都降低了,病例1从749降至512 ng/dL(降低了约30%),病例2从220降至188 ng/dL(降低了约20%)。粪便中粘液、里急后重和大便扁平的临床症状在第一次检查(第7天)时频率降低,在第三次检查(第30天)时消失,直到第60天一直保持正常状态。
05 讨论
良性前列腺增生症(Benign prostatic hyperplasia,BPH)是未绝育犬最常见的前列腺疾病[1,2]。B超是评估前列腺最广泛使用的诊断工具[3]。在狗中,BPH与激素的变化有关,如睾酮、双氢睾酮或雌二醇[4]。
由于绝育手术会在第一周内使睾酮急剧下降,因此它是治疗前列腺增生症最有效的方法[2]。除手术绝育外的另一种选择是进行药物治疗,如非那雄胺、奥塞特罗酮或德尔马地农等[5,6]。然而,在狗和人类中,都有副作用的报道,如食欲增加、行为改变、呕吐、腹泻、乏力、多尿多饮、肾上腺皮质功能减退、性欲减退、骨质疏松、低血压、精液量和质量下降、头晕和心动过速[5,7-9]。
在大鼠和人类中,使用植物提取物作为前列腺疾病的替代疗法提供了有希望的结果[10-12]。柳叶菜(Epilobium)提取物已在体外被证明对5-α还原酶和芳香化酶的活性有影响,这两种酶负责睾酮的生物合成,也是BPH发病的关键因素[13]。
月见草素B是一种环状二聚鞣花单宁,是柳叶菜产生这些作用的主要活性成分[11]。人类的一项随机、双盲、安慰剂对照的II期试验的结果证明了基于小花柳叶菜(Epilobium parviflorum,EP)和其他植物的草药产品在改善BPH症状和降低夜间尿频方面的有效性和安全性[10]。同样,另一项研究通过评估前列腺增生上皮细胞培养的存活率及其在大鼠体内对丙酸睾酮诱导的前列腺增生的治疗作用,报告了柳叶菜的抗前列腺增生作用[12]。因此推测给予柳叶菜提取物可以作为治疗犬前列腺增生症的替代疗法。
本报告中的狗经过2个月的治疗后,与接受奥沙特罗、德尔马地农[5]和非那雄胺[6]的狗相似,接受EP治疗后前列腺体积也出现了类似的减少。然而,在用非那雄胺治疗的狗中,EP观察到的前列腺体积减少大于既往报告的20%[14]。这一发现表明,EP可能是治疗犬BPH的可行替代方案,与标准药物治疗相比,其效果相当或更优。
但在第60天观察到的前列腺体积减少(40%)明显低于绝育手术后60天的报告。既往研究表明,在手术绝育后的第7天,通过B超声测量的前列腺体积减少了40%,到第60天减少了80% [2]。
临床症状的减少或消失与非那雄胺和药物治疗的报告相似,治疗后30天完全没有症状[6,14]。这一发现对于EP在犬BPH中的应用也很有希望,并与用柳叶菜治疗的人类的报告相一致。一项单中心、随机、双盲、安慰剂对照的临床试验评估了每日服用含有与本病例相似浓度的月见草素B胶囊的影响,在为期6个月的研究结束时,观察到IPSS评估的夜间和日间泌尿系统症状有所减轻[15]。
总之,本研究描述了在2个月内对两只患有BPH的狗进行的一种可能的替代治疗,表明其有效的证据包括前列腺体积和血清睾酮浓度降低,且没有临床、血液学或生化改变。
文献来源:Cazzuli G, Damián JP, Minini L, Ferreira F, Suárez G, Pessina P. Use of Epilobium parviflorum in the Treatment of Benign Prostatic Hyperplasia in Canines. Vet Med Sci. 2025 Mar;11(2):e70205.
参考文献
[1] Polisca, A. , Troisi A., Fontaine E., Menchetti L., and Fontbonne A.. 2016. “A Retrospective Study of Canine Prostatic Diseases From 2002 to 2009 at the Alfort Veterinary College in France.” Theriogenology 85, no. 5: 835–840.
[2] Cazzuli, G. , Damián J. P., Molina E., and Pessina P.. 2022. “Post‐Castration Prostatic Involution: A Morphometric and Endocrine Study of Healthy Canines and Those With Benign Prostatic Hyperplasia.” Reproduction in Domestic Animals 57, no. 2: 157–164.
[3] Russo, M. , Vignoli M., and England G. C. W.. 2012. “B‐Mode and Contrast‐Enhanced Ultrasonographic Findings in Canine Prostatic Disorders.” Reproduction in Domestic Animals 47, no. S6: 238–242.
[4] Nicholson, T. M. , and Ricke W. A.. 2011. “Androgens and Estrogens in Benign Prostatic Hyperplasia: Past, Present and Future.” Differentiation 82, no. 4–5: 184–199.
[5] Albouy, M. , Sanquer A., Maynard L., and Eun H. M.. 2008. “Efficacies of Osaterone and Delmadinone in the Treatment of Benign Prostatic Hyperplasia in Dogs.” Veterinary Record 163, no. 6: 179–183.
[6] Angrimani, D. S. , Francischini M. C. P., Brito M. M., and Vannucchi C. I.. 2020. “Prostatic Hyperplasia: Vascularization, Hemodynamic and Hormonal Analysis of Dogs Treated With Finasteride or Orchiectomy.” PLoS ONE 15, no. 6: e0234714.
[7] Smith, J. 2008. “Canine Prostatic Disease: A Review of Anatomy, Pathology, Diagnosis, and Treatment.” Theriogenology 70: 375–383.
[8] Lin, W. L. , Hsieh Y. W., Lin C. L., Sung F. C., Wu C. H., and Kao C. H.. 2015. “A Population‐Based Nested Case–Control Study: The Use of 5‐Alpha‐Reductase Inhibitors and the Increased Risk of Osteoporosis Diagnosis in Patients With Benign Prostate Hyperplasia.” Clinical Endocrinology 82, no. 4: 503–508.
[9] Hirshburg, J. M. , Kelsey P. A., Therrien C. A., Gavino A. C., and Reichenberg J. S.. 2016. “Adverse Effects and Safety of 5‐Alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review.” Journal of Clinical and Aesthetic Dermatology 9, no. 7: 56–62.
[10] Coulson, S. , Rao A., Beck S. L., Steels E., Gramotnev H., and Vitetta L.. 2013. “A Phase II Randomised Double‐Blind Placebo‐Controlled Clinical Trial Investigating the Efficacy and Safety of ProstateEZE Max: A Herbal Medicine Preparation for the Management of Symptoms of Benign Prostatic Hypertrophy.” Complementary Therapies in Medicine 21, no. 3: 172–179.
[11] Piwowarski, J. P. , Bobrowska‐Korczak B., Stanisławska I., etal. 2017. “Evaluation of the Effect of Epilobium angustifolium Aqueous Extract on LNCaP Cell Proliferation in In Vitro and In Vivo Models.” Planta Medica 83, no. 14/15: 1159–1168.
[12] Deng, L. , Zong W., Tao X., etal. 2019. “Evaluation of the Therapeutic Effect Against Benign Prostatic Hyperplasia and the Active Constituents From Epilobium angustifolium L.” Journal of Ethnopharmacology 232: 1–10.
[13] Lesuisse, D. , Berjonneau J., Ciot C., etal. 1996. “Determination of Oenothein B as the Active 5‐α‐Reductase‐Inhibiting Principle of the Folk Medicine Epilobium parviflorum .” Journal of Natural Products 59, no. 5: 490–492.
[14] Lima, C. B. , Angrimani D., Flores R. B., and Vannucchi C. I.. 2021. “Endocrine, Prostatic Vascular, and Pro‐Apoptotic Changes in Dogs With Benign Prostatic Hyperplasia Treated Medically or Surgically.” Domestic Animal Endocrinology 75: 106601.
[15] Esposito, C. , Santarcangelo C., Masselli R., et al. 2021. “ Epilobium angustifolium L. Extract With High Content in Oenothein B on Benign Prostatic Hyperplasia: A Monocentric, Randomized, Double‐Blind, Placebo‐Controlled Clinical Trial.” Biomedicine & Pharmacotherapy 138: 111414.