
| 品种:短毛猫 | |
| 年龄:8岁 | |
| 性别:雌 | |
| 诊断:双侧中耳炎 | |
01 主诉及病史
1年的呕吐史。
最初大约每周呕吐3-4次,后来几乎每天都吐。没有腹泻史,粪便检查也未发现寄生虫。既往超声检查发现十二指肠降壁有一个3×0.6厘米的严重增厚区域,幽门可能受累,肠系膜有三个肿大、低回声的淋巴结(下图)。过去1年中接受了三个疗程的泼尼松龙治疗(剂量不详),但症状未改善。几次为期3个月的饮食试验最初降低了呕吐频率,但每次试验后呕吐症状会再次出现。
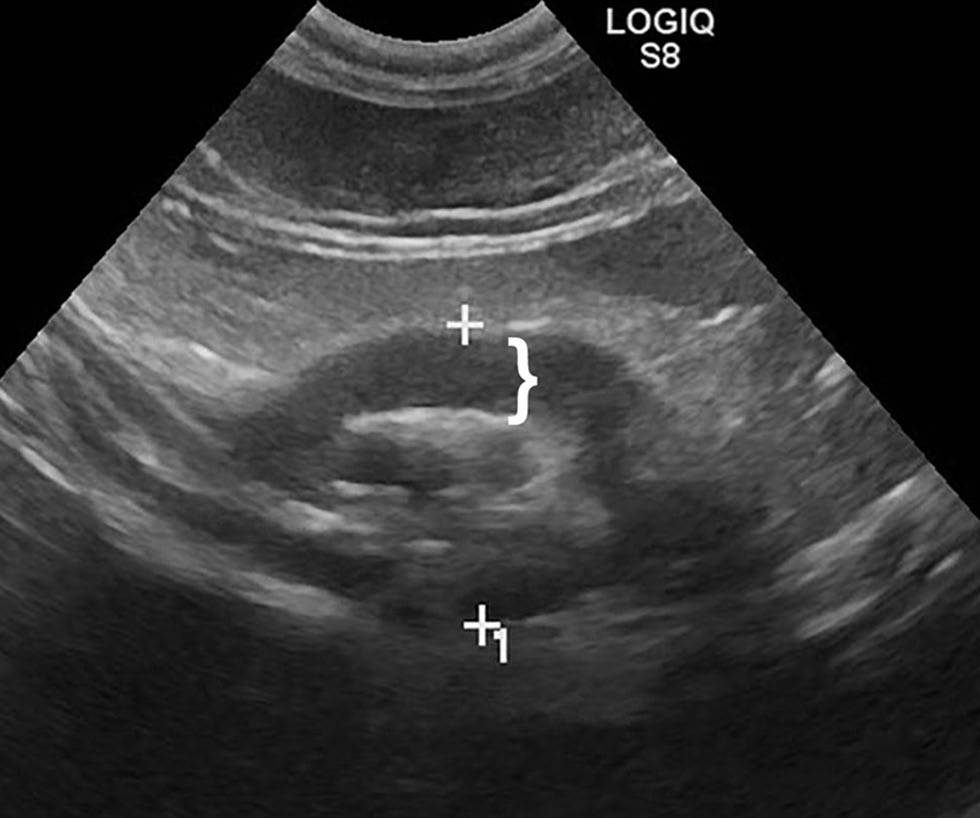
↑ 十二指肠近端和幽门十二指肠交界处不对称肿块状壁层增厚(白色 } 符号)。
02 检查
身体状况正常。全血细胞计数显示嗜酸性粒细胞增多(2.145×10^3/ml [0.000-1.5000])。血生化没有异常。没有黄疸,血清胆红素正常。猫白血病病毒/猫免疫缺陷病毒阴性。X光片显示十二指肠壁增厚和小肠气体膨胀。
03 治疗
3周后进行了剖腹探查术。围术期静脉注射头孢西丁(30 mg/kg)。进行腹侧中线剖腹手术并探查腹部。
从幽门十二指肠交界处开始,在十二指肠近端可见一个直径为2.5 cm的环形肿块,该肿块包围了主要和次要的十二指肠乳头区域(下图)。胆囊轻度膨胀,肝脏和其他器官正常。表明该肿块并未阻塞胆总管。进行了胃空肠造口术,以使胃的消化物能够进入小肠。
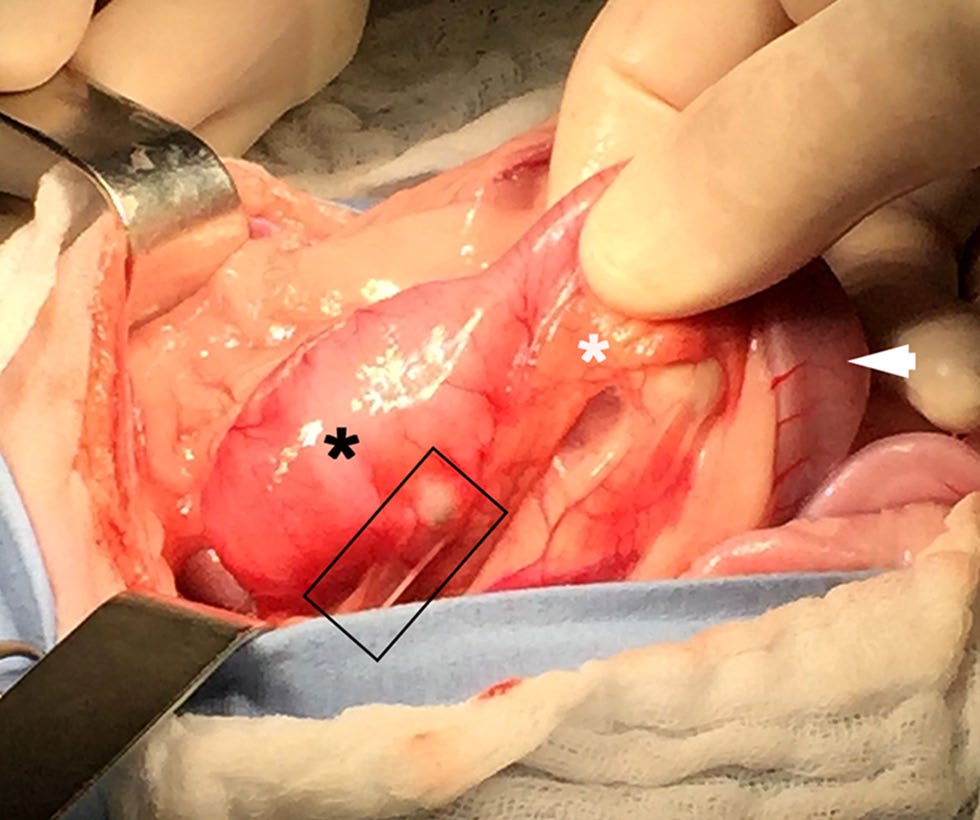
↑ 一个周长和直径约3.5厘米和2.5厘米的圆形物体(黑色星号),分别位于十二指肠近端(白色箭头)和胰腺附近(白色星号),从幽门十二指肠交界处开始,包括主要和次要的十二指肠乳头。此图显示了包含十二指肠乳头和胆总管入口处的肿块(黑色矩形)。
在幽门窦和胃底放置两条缝合线。在升十二指肠和近端空肠处再放置两条缝合线。使用4-0缝线在浆膜和肌层中以简单连续模式直接缝合胃大曲背侧和近端空肠。在胃大曲和空肠平行于胃切口做了两个3.5厘米切口。使用4-0缝线对胃和空肠切口的背部进行对位,注意包括粘膜下层。胃和空肠的腹侧粘膜和粘膜下层以相同的方式闭合。闭合切口腹侧的浆膜和肌层,在胃空肠造口部位周围形成360°、两层闭合(下图)。对十二指肠病变进行全层楔形活检。将网膜放置在两个手术部位,用温盐水冲洗腹膜腔,常规闭合腹部切口。
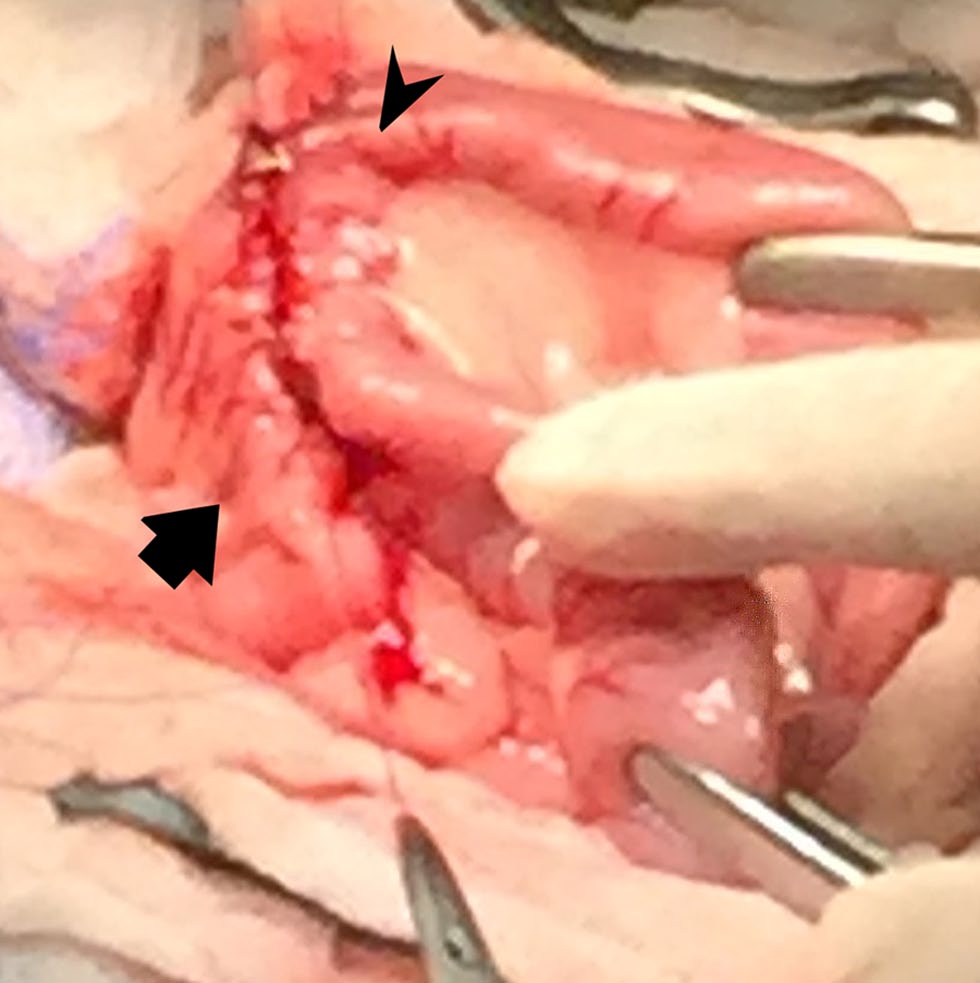
↑ 胃空肠造口部位,胃大曲3.5厘米(黑色箭头)和3.5厘米空肠(黑色箭头)对齐。
该肿块被诊断为猫嗜酸性硬化性纤维增生。粘膜局部被致密的胶原小梁所取代,小梁被肥大的成纤维细胞、嗜酸性粒细胞、肥大细胞和较少的淋巴细胞、浆细胞和中性粒细胞带所分割(下图)。局部溃疡,矿化结石周围有大量中性粒细胞。剩余的粘膜上皮被密集的嗜酸性粒细胞和淋巴浆细胞炎症包围,并延伸到下层。炎症没有延伸到肌层,尽管肌层血管内可见嗜酸性粒细胞数量增加。细菌和真菌染色均为阴性。在甲苯胺蓝染色中发现的肥大细胞异染颗粒没有表现出提示肿瘤形成的异型性迹象,因此被解释为炎症。
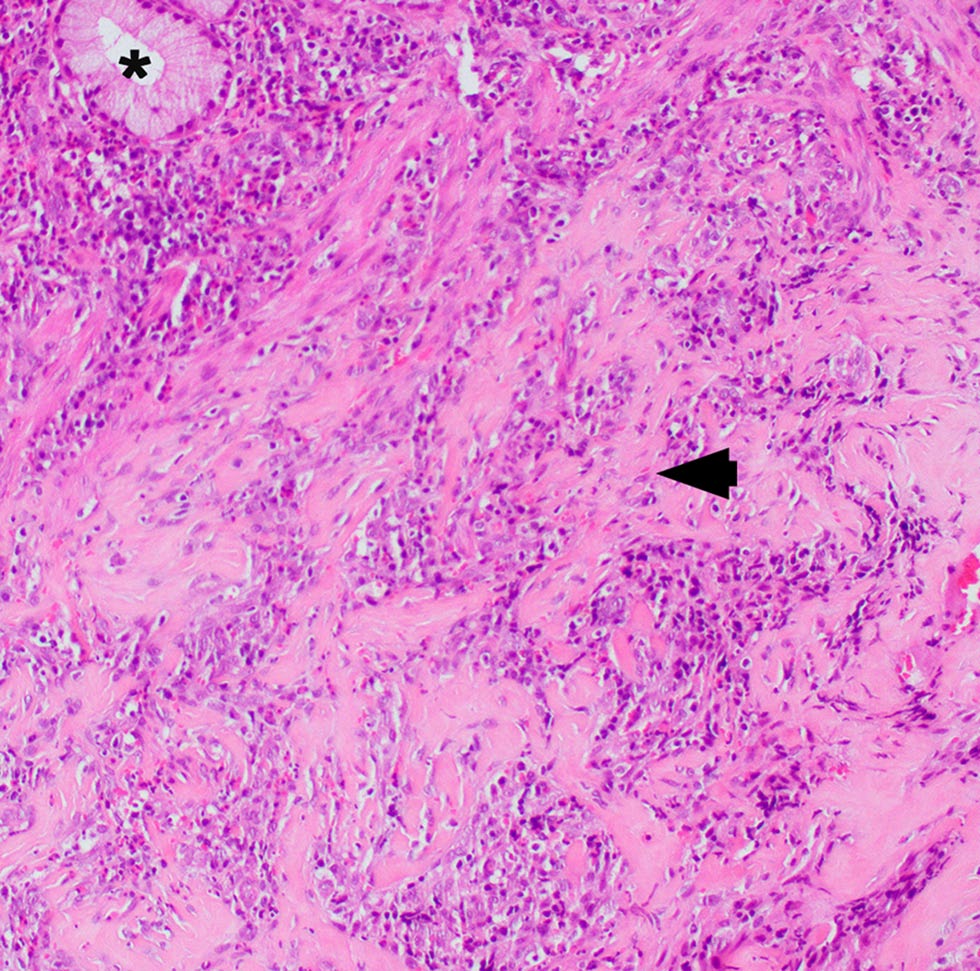
↑ 幽门十二指肠交界处活检,活检样本中粘膜扩张并延伸穿过粘膜下层(Brunner腺的一部分用星号突出显示)的是硬化胶原的小梁带,周围有嗜酸性粒细胞、分散的淋巴细胞、肥大细胞和较少的浆细胞和中性粒细胞(箭头)。
04 预后
使用2.86 ml/kg/h乳酸林格氏溶液,并接受丁丙诺啡(0.01-0.02 mg/kg,q6-8h IV)、泮托拉唑(1 mg/kg,q24h IV)和马罗吡坦(1 mg/kg,q24h IV)。术后第二天出院,口服奥美拉唑1 mg/kg/天。
2周后,偶尔会腹泻和呕吐。开始口服泼尼松龙(初始剂量0.7 mg/kg/天,15天后降至0.35 mg/kg/隔天一次)。
4个月后,因急性呕吐和腹泻就诊。根据超声发现的小肠和大肠黏膜下层和肌层增厚,怀疑患有慢性肠病。外周嗜酸性粒细胞增多症已经消退。超声显示胃空肠造口术部位不明显。泼尼松龙剂量有所增加,但其体重也显著增加(初始剂量0.4 mg/kg/天,6天后降至0.2 mg/kg/隔天一次)。
术后2年多,因呼吸困难入院。1个月前一直口服泼尼松龙。胸部CT提示支气管肺炎。由于需要机械通气,主人放弃治疗,患者被安乐死,没有进行尸检。
05 讨论
猫嗜酸性粒细胞硬化性纤维增生症(feline eosinophilic sclerosing fibroplasia,FESF)又称猫胃肠道嗜酸性粒细胞硬化性纤维增生症,是一种特发性嗜酸性粒细胞炎症,通常会影响胃肠道和相关淋巴结[1]。
这种病变最常发生在胃、小肠和腹腔淋巴结,但最近的报告也描述了肠系膜、腹膜后和咽后淋巴结的组织病理学类似病变[1-5]。病变的组织学特征是胶原小梁分支,伴有反应性成纤维细胞和嗜酸性粒细胞、肥大细胞及其他白细胞浸润[1,3]。
硬化性肥大细胞瘤和FESF可具有相似的组织病理学模式,这在历史上一直存在争议,一些FESF病例可能被误认为是硬化性肥大细胞瘤[6-8]。
目前FESF的发病机制尚不清楚,但可能是对各种诱发病原体的异常炎症反应[1,2]。56%-69%的病例发现了细胞内细菌,一项研究发现所有回结肠交界处和结肠病变以及一些幽门病变中都有细菌[1,2,5]。线虫被认为与美洲狮的组织学上类似的病变有关,在一份病例报告中,植物真菌与FESF有关[9,10]。已报道的大多数病例都是通过手术切除、抗生素、皮质类固醇和其他免疫调节剂治疗的[1,2]。
FESF的预后差异很大,很大程度上取决于病变的程度和位置。在一组4只猫的研究中,患有不可切除近端十二指肠肿块的猫存活时间最短[13]。本病例的病变累及十二指肠近端,包括十二指肠大乳头和小乳头区域。猫的胆总管和胰管排空进入十二指肠乳头,只有20%的猫有一条通向十二指肠小乳头的副胰管[14]。胃空肠造口术被提出作为一种新的治疗方法,用于治疗包括幽门和/或十二指肠降部在内的不可切除的FESF病变。
本病例表明,在胆管和胰管没有阻塞的情况下,胃空肠造口术可能是绕过幽门或近端十二指肠梗阻的可行选择。
总之,本病例报告描述了一种胃空肠造口术,用于绕过幽门十二指肠交界处FESF肿块病变引起的部分机械性梗阻。建议对没有胰腺或胆管梗阻证据的幽门和十二指肠近端不可切除病变的患者使用胃空肠造口术。
文献来源:Blew JE, Bradley CW, Holt DE. Feline eosinophilic sclerosing fibroplasia of the duodenum treated with gastrojejunostomy in a domestic shorthair cat. JFMS Open Rep. 2025 Feb 24;11(1):20551169241310965.
参考文献
1. Craig LE, Hardam EE, Hertzke DM, et al. Feline gastrointestinal eosinophilic sclerosing fibroplasia. Vet Pathol 2009; 46: 63–70.
2. Linton M, Nimmo JS, Norris JM, et al. Feline gastrointestinal eosinophilic sclerosing fibroplasia: 13 cases and review of an emerging clinical entity. J Feline Med Surg 2015; 17: 392–404.
3. Kambe N, Okabe R, Osada H, et al. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia limited to the mesentery. J Small Anim Pract 2020; 61: 64–67.
4. Thieme ME, Olsen AM, Woolcock AD, et al. Diagnosis and management of a case of retroperitoneal eosinophilic sclerosing fibroplasia in a cat. JFMS Open Rep 2019; 5.
5. Zampieri B, Church ME, Walsh K, et al. Feline eosinophilic sclerosing fibroplasia – a characteristic inflammatory response in sites beyond the gastrointestinal tract: case report and proposed nomenclature. JFMS Open Rep 2022; 8.
6. Halsey CHC, Powers BE, Kamstock DA. Feline intestinal sclerosing mast cell tumour: 50 cases (1997–2008). Vet Comp Oncol 2010; 8: 72–79.
7. Gamble DA. Letters to the editor and rebuttal regarding the paper recently published in Veterinary and Comparative Oncology, ‘Feline intestinal sclerosing mast cell tumour: 50 cases (1997–2008) 2010; 8: 72–79’ by C. H. C. Halsey, B. E. Powers and D. A. Kamstock. Letter to the editor #2. Vet Comp Oncol 2010; 8: 235–236.
8. Schulman FY, Lipscomb TP. Letters to the editor and rebuttal regarding the paper recently published in Veterinary and Comparative Oncology, ‘Feline intestinal sclerosing mast cell tumour: 50 cases (1997–2008) 2010; 8: 72–79’ by C. H. C. Halsey, B. E. Powers and D. A. Kamstock. Letter to the editor #1. Vet Comp Oncol 2010; 8: 234–235.
9. Eckstrand CD, Barr BC, Woods LW, et al. Nematode-associated intramural alimentary nodules in pumas are histologically similar to gastrointestinal eosinophilic sclerosing fibroplasia of domestic cats. J Comp Pathol 2013; 148: 405–409.
10. Grau-Roma L, Galindo-Cardiel I, Isidoro-Ayza M, et al. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with phycomycetes. J Comp Pathol 2014; 151: 318–321.
11. Davidson GA, Taylor SS, Dobromylskyj MJ, et al. A case of an intramural, cavitated feline gastrointestinal eosinophilic sclerosing fibroplasia of the cranial abdomen in a domestic longhair cat. JFMS Open Rep 2021; 7.
12. Agulla B, Díaz-Regañón D, García-Sancho M, et al. Remission of feline gastrointestinal eosinophilic sclerosing fibroplasia in a cat treated with corticotherapy. Pak Vet J 2021; 41: 309–312.
13. Weissman A, Penninck D, Webster C, et al. Ultrasonographic and clinicopathological features of feline gastrointestinal eosinophilic sclerosing fibroplasia in four cats. J Feline Med Surg 2013;
15: 148–154.14. Barnes JA. Digestive system. In: Hudson LC, Hamilton WP. (eds). Atlas of feline anatomy for veterinarians. 2nd ed. Jackson, WY: Teton NewMedia, 2010, pp 153–170.