
| 品种:史宾格犬 | |
| 年龄:3岁 | |
| 性别:雌 | |
| 诊断:后纵膈肉芽肿 | |
01 主诉及病史
嗜睡、厌食、发热和轻微咳嗽等症状持续3天。
当地医院胸部X光检查显示,尾背侧肺野有软组织不透明。接受了阿莫西林克拉维酸和非甾体抗炎药治疗3天,没有任何反应。一年前曾接受过腰部肌肉草籽切除手术。
02 检查
体重13.3千克。心率108次/分,窦性心律,无心脏杂音。呼吸频率28次/分,直肠温度38.8℃。粘膜呈粉红色,湿润,毛细血管再充盈时间小于2秒。血氧饱和度98%,血压155/92 mm Hg。血细胞比容47% [35-55],总固形物7.9 g/dL [5.5-7.5]。血气分析正常,血涂片显示白细胞增高且左移,血小板数量充足。
CT检查发现了一个圆形肿块,大小约7×5厘米,位于膈肌前方,与左侧食管相邻。肿块呈弥漫性异质对比增强。肿块沿食管的边缘分辨不清。肿块内有一小块界限清楚的矿化物(下图A)。前胸骨、脾脏和空肠淋巴结中度肿大,最大可达1厘米。气管支气管和纵隔淋巴结呈圆形且明显,最大可达0.7厘米。病变伴有肿块效应,邻近肺实质受压和肺不张。所有肺叶都有斑片状的高信号区,尽管由于肺容积普遍缩小,这些区域被怀疑是轻度的肺不张,但仍无法明确排除化脓性病灶。每个胸膜间隙的腹侧都有少量积液。腹侧胸膜轻度增厚,可能是胸膜炎。
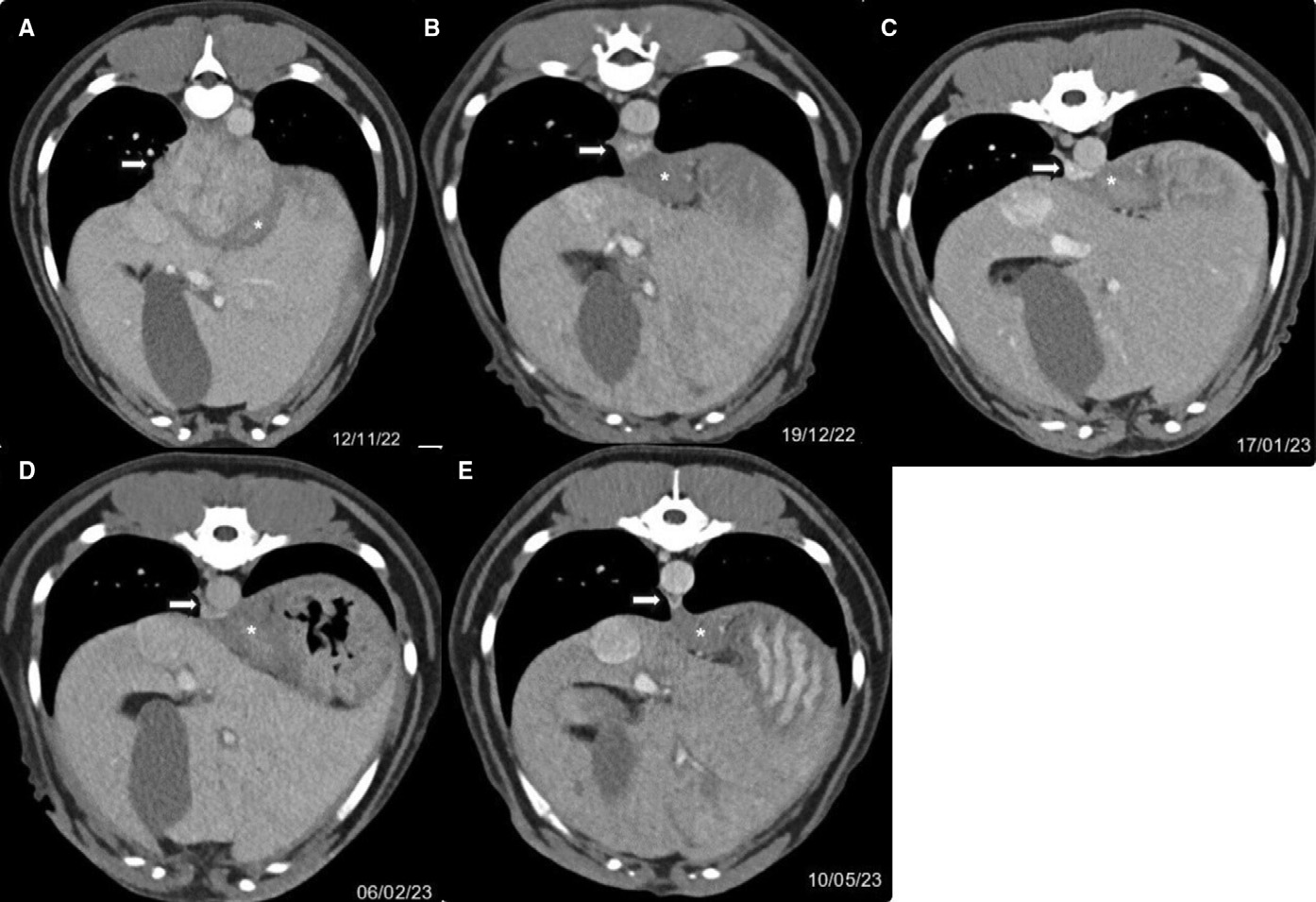
↑ (A–E)食管旁病灶(白色箭头)的对比后软组织窗CT图像,显示病灶从2022年11月到2023年5月逐渐缩小。食管(白色*)与脓肿清晰可辨。
03 治疗
通过胸骨正中切开术对胸腔进行了手术探查。在食管背侧发现了高尔夫球大小的肿块。肿块非常坚硬,边界清晰,腹侧与后腔静脉和左尾肺叶粘连。肿块与膈肌粘连。
由于肿块的范围和粘连的严重程度,肿块被认为无法切除。对肿块进行了活检取样。胸骨正中切口常规关闭,患者从麻醉中顺利恢复。
组织病理学分析表明,患者出现了中度、弥漫性、慢性活动性炎症和纤维化/纤维增生,但没有肿瘤迹象。培养和药敏试验发现了对阿莫西林和克拉维酸敏感的大肠埃希菌。
04 预后
在重症监护室住院5天,第6天出院,出院时口服对乙酰氨基酚/可待因(10 mg/kg,每天两次,共7天)、阿莫西林/克拉维酸(20 mg/kg,每天三次,共4周)和美洛昔康(0.1 mg/kg,每天一次,共4周)。
在4周的随访中,没有出现任何症状,临床检查也未发现异常。复查CT显示食管旁肿块的体积大幅缩小(上图B)。肿块内的矿化灶没有变化。肿块对邻近结构的影响减弱,表现为食管腹侧偏移减小,主动脉左外侧移位消失。之前发现的斑片状肺高信号区和少量胸腔积液已经消退,胸膜腔内没有出现肺不张或积液迹象。之前肿大的淋巴结全部缩小至正常大小。停用了美洛昔康,抗生素疗程又延长了4周。
在8周的随访中,临床表现健康,CT显示肿块大小不变(上图C)。抗生素已停用。
在12周的随访中,CT显示食管旁病灶进一步缩小(0.45×0.9厘米)(上图D)。病灶呈圆形,呈弥漫性异质对比度增强,与之前的病灶相似。
三个月后,CT显示肿块明显缩小,几乎完全消退(0.1厘米)(上图E)。在最后一次CT扫描1年后,与主人的随访电话中报告患者没有任何不适症状。
05 讨论
小型动物的后纵隔肿块很少见。尾纵隔肿块的可能鉴别诊断包括食管裂孔疝、食管异物、食管旁脓肿/水肿以及肿瘤,如间皮瘤、脂肪瘤和寄生虫或细菌引起的肉芽肿[1-7]。
关于后纵隔肉芽肿(caudal mediastinal granulomas,CMG)手术治疗的报道有限。例如,Franklin等人通过手术清创和网膜化成功处理了一个由细菌引起的后纵隔肉芽肿[8]。Sivacolundhu等人记录了3例由诺卡氏菌和放线菌引起的后纵隔肉芽肿的治疗过程,其中两只狗在手术和抗生素治疗后存活了下来,而一只狗则因术中失血过多而心肺骤停[7]。Gremillion等人描述了一例由假单胞菌引起的食管旁肉芽肿,但未提供该病例的结果[9]。
纵隔浆膜腔是位于后纵隔、食管右侧、心底和膈肌之间的潜在空间,起源于大网膜[10]。CMG的确切发病机制仍不完全清楚。在人类医学中,CMG多与结核病或组织胞浆菌病有关。在犬中,推测可能是由于吸入异物导致尾肺叶支气管肺炎,随后引起局部感染扩展到纵隔浆膜腔或异物穿孔食道所致[10]。
在本患者中,由于肉芽肿与食管紧密粘连,推测其病因可能是穿透性食管异物。也不能排除植物种子或其他吸入异物移位导致支气管肺炎,进而扩展到后纵隔浆膜腔的可能性。值得注意的是,胸腔食管尾部的食管肉芽肿也可能是由寄生虫狼尾旋线虫(Spirocerca lupi)引起的[6]。不过,鉴于这种疾病在英国并不流行,因此虽然没有进行粪便浮选试验,但也认为这种情况不太可能发生。
后纵隔病变的首选诊断方式是CT。它还能为手术规划和并发胸腔内病变提供信息。在人类医学中,CT被用于纵隔炎保守治疗病例的连续随访监测,以及追踪早期复发[11]。在人类医学中,纵隔肉芽肿的治疗取决于临床症状的严重程度。无症状的患者可接受保守治疗,包括连续CT监测,因为已有病例观察到肉芽肿自发消退。
对于有症状和严重的病例,建议尽早采取积极的干预措施,包括手术和通过胸腔造口管持续引流[12]。在犬中,手术切除和抗生素治疗是治疗后纵隔脓肿/肉芽肿的首选方法。在一个有限的病例系列中,有7只狗患有食管旁脓肿,通过胸廓切开术或胸骨切开术进行手术清创,同时进行或不进行网膜切除术,再加上胸腔引流和抗生素治疗,结果所有狗都完全康复了[2]。
在CMG病例中,另一个小型病例系列详细描述了3只狗因放线菌和诺卡氏菌引起的CMG。一只狗在完全切除肉芽肿并接受抗生素治疗后完全康复,另一只狗在部分切除肉芽肿并接受抗生素治疗后康复。第三只狗在试图切除肉芽肿时因急性出血而在术中死亡[7]。
另一份病例报告记录了通过手术清创、网膜切除和抗生素治疗成功治愈一只狗的CMG。然而,网膜切除术仍存在争议,因为肉芽肿与潜在的肿瘤存在相关风险,并有可能将癌细胞播散入腹腔[8]。
这些病例报告表明,手术治疗有可能取得成功。然而,并不总能进行完全切除。非手术治疗后纵隔肉芽肿的方法在一只狗和两只猫身上都有记录。一只患有食道旁脓肿的狗接受了超声引导下的反复引流和抗菌治疗。出院后14天的CT显示脓肿缩小,抗生素又持续使用了2周。8个月后再次评估时,临床症状没有复发[13]。
文献中有两篇报告描述了对患有食道旁脓肿的猫的药物治疗。一只猫在接受抗生素治疗的同时通过双侧胸腔造口术管进行了胸腔引流,出院6周后的CT显示脓肿完全消退[14]。第二只猫只接受了抗生素治疗,出院21天后临床症状没有复发,但当时没有重复进行CT或拍片检查[15]。
本病例报告是首例成功以非手术方式治疗犬食道旁肉芽肿的病例。在本病例中,由于没有出现空腔脓肿,因此不需要引流,而且由于肉芽肿边缘侵犯横膈膜和食道,因此无法进行手术切除或清创。
文献来源:Dorlis C, Goody N, Blacklock K. Nonsurgical Management of a Caudal Mediastinal Granuloma. J Am Anim Hosp Assoc. 2025 Mar 1;61(2):46-49.
参考文献
1. Aertsens A, Hernandez J, Ragetly GR, et al. Surgical extraction of canine esophageal foreign bodies through a gastrotomy approach: 12 cases. J Small Anim Pract 2016;57:354–9.
2. Brissot HN, Burton CA, Doyle RS, et al. Caudal mediastinal paraesophageal abscesses in 7 dogs. Vet Surg 2012;41:286–91.
3. Del Magno S, Zanardi S, Foglia A, et al. Congenital lobar emphysema in a kitten with concomitant hiatal hernia and nutritional secondary hyperparathyroidism. J Am Anim Hosp Assoc 2022;58:141–5.
4. McDonough SP, Scrivani PV, Gendron K, et al. Mediastinal serous cavity mesothelioma in two dogs. J Am Anim Hosp Assoc 2022;58:194–202.
5. Nickel J, Mison M. Intrathoracic lipoma in a cat. J Am Anim Hosp Assoc 2011;47:e127–30.
6. Okanishi H, Matsumoto J, Aoki H, et al. Successful resolution of esophageal granulomas in a dog infected with Spirocerca lupi. J Vet Med Sci 2013;75:1629–32.
7. Sivacolundhu RK, O’Hara AJ, Read RA. Thoracic actinomycosis (arcanobacteriosis) or nocardiosis causing thoracic pyogranuloma formation in three dogs. Aust Vet J 2001;79:398–402.
8. Franklin AD, Fearnside SM, Brain PH. Omentalisation of a caudal mediastinal abscess in a dog. Aust Vet J 2011;89:217–20.
9. Gremillion C, Voges A, Griffin J. Caudal mediastinal cystic lesion in a dog. J Small Anim Pract 2017;58:57.
10. Gendron K, McDonough SP, Flanders JA, et al. The pathogenesis of paraesophageal empyema in dogs and constancy of radiographic and computed tomography signs are linked to involvement of the mediastinal serous cavity. Vet Radiol Ultrasound 2018;59:169–79.
11. Pastene B, Cassir N, Tankel J, et al. Mediastinitis in the intensive care unit patient: a narrative review. Clin Microbiol Infect 2020;26:26–34.
12. Lin J, Jimenez CA. Acute mediastinitis, mediastinal granuloma, and chronic fibrosing mediastinitis: A review. Semin Diagn Pathol 2022;39:113–9.
13. Breheny CR, Thomas EK, Hall JL, et al. Successful percutaneous drainage of a refractory caudal mediastinal paraesophageal abscess in a dog. J Vet Emerg Crit Care (San Antonio) 2021;31:537–40.
14. Gruget E, Cabon Q, Gory G. Description of the CT evolution of pyothorax and caudal mediastinal para-esophageal empyema in a cat. Vet Rec Case Rep 2021;10.
15. Jung J, Choi M. Nonsurgical resolution of caudal mediastinal paraesophageal abscess in a cat. J VetMed Sci 2015;77:499–502.