
| 品种:金毛寻回犬 | |
| 年龄:7岁 | |
| 性别:雌 | |
| 诊断:恶性神经鞘瘤 | |
01 主诉及病史
5个月的渐进性右前肢跛行。
最初发现了轻微跛行(1/5级),未发现其他异常。全血细胞计数和血生化正常。右肘X线片显示滑车切迹轻度硬化。使用Ω脂肪酸补充剂未能改善跛行。
6周后重新评估时,跛行情况恶化。犬大肠杆菌血清学呈阳性,犬心丝虫、伯氏疏螺旋体和嗜吞噬细胞无形体的血清学均为阴性。犬大肠杆菌的后续PCR检测结果为阴性。使用美洛昔康(0.1 mg/kg,q24h,7天)和多西环素(10 mg/kg,q24h,14天)治疗未能改善跛行。
2个月后,右肘的X线结果没有变化。还进行了肩部和腕关节的X光片,除轻度前臂腕关节骨关节炎外,其余均正常。
4个月后,对右前肢进行了CT扫描。除滑车切迹硬化外,未报告其他异常。将甲基泼尼松龙醋酸盐(每次20毫克)注射到肱二头肌肌腱的腱鞘和冈上肌插入肌腱的区域。尽管进行了甲基泼尼松龙治疗,但跛行现象依然存在。
5个月后,跛行情况继续恶化,遂转诊。
02 检查
体重35公斤。观察到右前肢跛行3/5级(下方视频)。触诊肘部近端肱骨内侧会引起疼痛。右前肢肌肉组织也有中度萎缩。其余骨科检查均正常。神经检查均正常。
↑ 就诊时的视觉步态分析显示,右前肢跛行3/5级。
由于之前的影像结果未能揭示跛行的原因,因此对颈椎、右肩和肘部进行了MRI扫描。在右前肢紧邻肱动脉和静脉的远端肱骨内侧发现了一个1.5×5.0 cm的卵圆形皮下肿块。STIR图像显示肿块呈均匀高信号(下图)。右前肢肌肉组织萎缩。颈椎和右肩正常。鉴于肿瘤的解剖位置,怀疑正中神经受累。肌肉萎缩被认为是继发于废用。
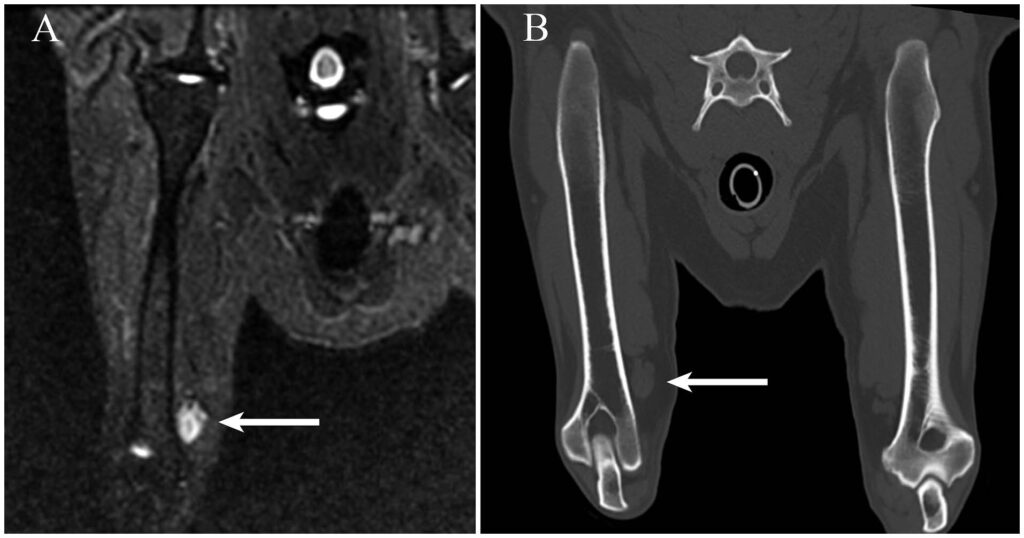
↑(A)在右肱骨远端内侧附近很容易识别出卵圆形高信号肿块(箭头)。(B)在图A中观察到的肿块(箭头)在多平面重建CT图像上可见。
在MRI上发现肿块后,获得了之前在不同机构进行的CT结果以供对比。在MRI上观察到的同一位置,在CT中可见一个轮廓分明的软组织衰减卵圆形肿块(下图)。
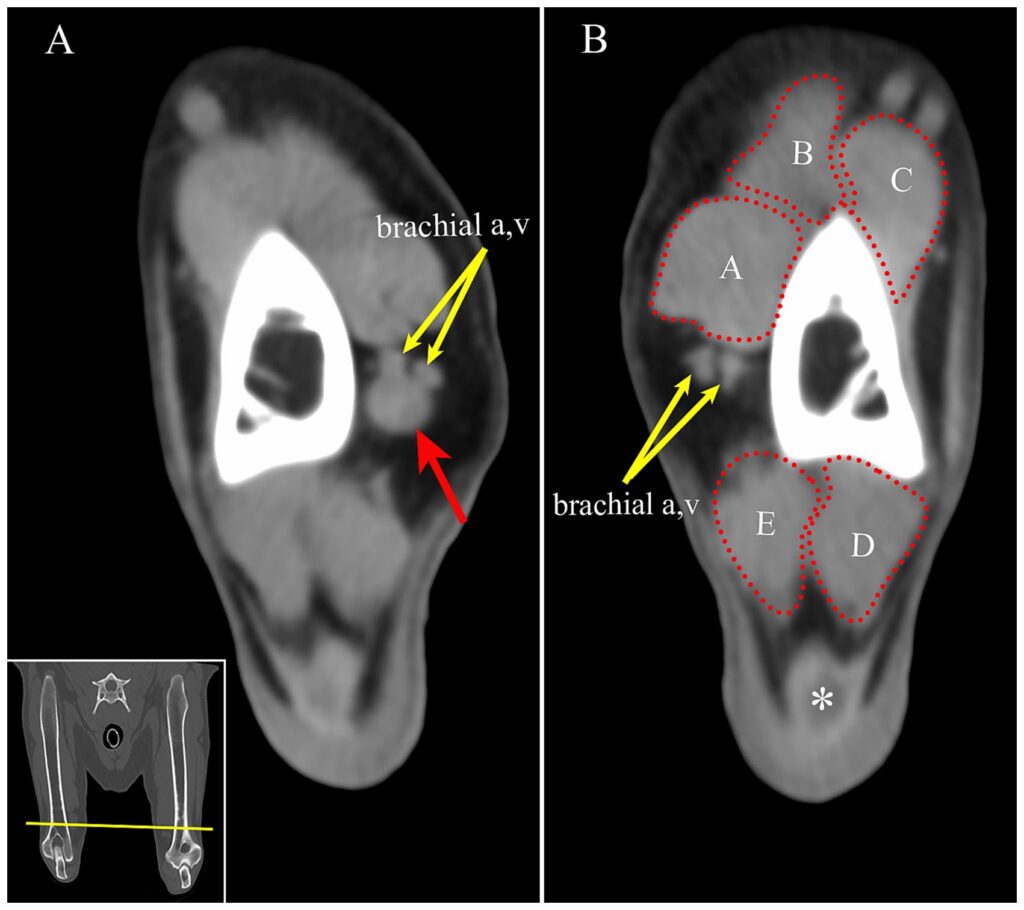
↑(A)在CT上,肿块被确定为右肱骨远端(黄色箭头)内侧肱动脉和静脉附近的圆形软组织衰减肿块(红色箭头)。(B)为了进行比较,左肱动脉和静脉在左前肢的大致相同位置可见(黄色箭头)。A:肱二头肌;B:锁骨上膊肌;C:肱肌;D:肘肌;E:肱三头肌内侧头;*:肱三头肌插入肌腱。
03 治疗
进行了手术探查,目的是对肿块进行完整切除并保留肢体。全麻后剃掉覆盖远端肱部和肘部内侧的毛发,并对皮肤进行无菌准备。在肘部近端的远端腕骨内侧切一个10 cm切口。在皮下脂肪和深筋膜深处,发现了一个涉及正中神经的局灶性肿块。
分离尺侧动脉并在其穿过正中神经的位置处结扎。识别并切断肌皮神经的交通支。实现了肿块的完整切除,其中正中神经在肿块近端和远端被切断约5 cm。筋膜和皮肤常规闭合(下方视频)。
↑ 使用DeBakey血管钳分离正中神经并将其从手术区域中抽出。使用Brown Adson镊子尖端闭合从近端(视频左侧)向远端追踪神经,进入涉及正中神经的肿块。进入肿块的较小神经是肌皮神经的交通支。在视频的第二段中,使用弯曲的蚊式止血钳抓住正中神经的近端横断端,以帮助向远端解剖肿块(肘部朝向视频左上角)。
切除的肿块和正中神经被提交进行组织病理学检查。显微镜下,神经被模糊的梭形细胞肿瘤群扩张和截断。在某些区域,肿瘤细胞形成螺旋和束状。肿瘤细胞有不同数量的嗜酸性细胞质和细长的椭圆形核。细胞核含有斑点状染色质和单个核仁。偶尔观察到核异型性。还存在坏死和通过神经束膜侵入的区域。在整个肿块中,有髓鞘蛋白零的阳性免疫反应区域,证实了神经的参与。在神经的近端和远端切断处,肿瘤细胞与正常神经细胞混合。最终诊断为累及正中神经的恶性神经鞘瘤。
建议进行后续放疗,但被主人拒绝。
04 预后
术后,右前肢跛行2/5级。出院后服用卡洛芬(2.1 mg/kg,PO,q12h)和加巴喷丁(8.5 mg/kg,PO,q12h)14天。
术后1周,主人报告说跛行有所改善。
术后3个月和8个月,步态正常(下方视频)。
↑ 正中神经恶性神经鞘瘤切除术3个月后,狗的步态正常。
术后12个月,继续正常行走。
05 讨论
狗跛行的原因大致分为骨科和神经系统病因。在骨科疾病中,跛行是由肢体运动的机械性中断、疼痛或两者兼有引起的。在神经系统疾病中,跛行是由轻瘫、疼痛或两者兼有引起的。无论原因如何,在视觉步态分析中,由此产生的跛行可能看起来相似。
在大多数情况下,确定潜在的病因需要体检和诊断成像,然而,如果在体检中不容易发现明显的疼痛、机械功能障碍或轻瘫部位,这可能是一个挑战。
本报告详细介绍了一只慢性前肢跛行狗的诊断和治疗。仅凭检查无法确定跛行的骨科或神经学病因。临床病理检查和诊断影像学检查发现了一累及正中神经的恶性神经鞘瘤(malignant nerve sheath neoplasm,MNSN)。通过肿瘤的切除,实现了跛行的长期解决和肿瘤的控制。
作者认为,本病例中的狗的跛行反映了与正中神经受累相关的神经性疼痛。考虑到正中神经和相关神经支配提供的功能神经解剖学,保留肢体的肿瘤切除术是可行的。
目前存在许多分类方法来对疼痛进行分类,包括基于持续时间(急性或慢性)、位置、潜在疾病(癌症性疼痛)和相关机制的分类方案[2]。疼痛可分为伤害性或神经性[3]。伤害性疼痛是由作用于正常体感神经系统的伤害性刺激引起的[3]。体感系统,也称为全身传入系统,与有害刺激的感知以及触觉和温度的感知有关[4]。在伤害性疼痛中,伤害感受器会对伤害性刺激做出反应。
相比之下,神经性疼痛是由直接影响体感系统的外周或中枢神经系统组件的疾病或损伤引起的[3]。在狗中,椎间盘突出症通常与神经性疼痛有关[2,5]。椎间盘突出症手术治疗后,持续的神经性疼痛可能会影响多达15%的狗[6]。此外,患有椎间盘突出症狗的神经性疼痛可能表现为神经根特征,受影响的狗在站立位置不负重,可能同时出现跛行[7]。在继发于尾侧颈脊神经根受累的犬中,很难辨别并发跛行是否是神经性疼痛、导致轻瘫的全身躯体传出功能障碍或两者兼而有之的结果。
本病例报告有几个局限性。首先,从一个案例中推断出广泛的结论是具有挑战性的。虽然本病例的随访是通过直接检查和电话沟通收集的,但没有进行成像来评估手术部位复发的可能性。同样,也没有进行胸部X光片来评估转移。
总之,患有恶性神经鞘瘤的狗经常因单独轻瘫或伴有神经性疼痛而出现跛行。了解神经支配的功能神经解剖学有助于指导临床医生选择治疗方案。尽管MNSN的常规治疗包括切除和截肢,但在涉及对负重和行走能力影响有限的神经支配的病例中,如涉及正中神经的病例,可以考虑保留肢体的肿瘤切除。即使在涉及桡神经支配的情况下,预计会出现残余缺陷,肿瘤切除也可以通过缓解神经性疼痛来改善跛行[10]。
文献来源:Smith J, Kent M, Glass E, Davis G. Case report: Resolution of lameness via compartmental resection of a malignant nerve sheath neoplasm of the median nerve in a dog. Front Vet Sci. 2025 Feb 13;12:1551567.
参考文献
1.Duerr F. Canine Lameness. Newark, NJ: John Wiley & Sons, (2020);3–13.
2.Moore SA. Managing neuropathic pain in dogs. Front Vet Sci. (2016) 3:12.
3.Merskey H, Bogduk N. Part III: pain terms: a current list with definitions and notes on usage In: Merskey H, Bogduk N, editors. Classification of chronic pain. Seattle: IASP Press; (1994).
4.de Lahunta A, Glass E, Kent M. General sensory systems: general proprioception and general somatic afferent, (Eds): Lahunta Alexander, Glass Eric, Kent Marc, de Lahunta’s veterinary neuroanatomy and clinical neurology. Philadelphia, PA: Elsevier, (2020);246–266.
5.Fenn J, Olby NJ. Classification of intervertebral disc disease. Front Vet Sci. (2020) 7:579025.
6.Zidan N, Medland J, Olby N. Long-term postoperative pain evaluation in dogs with thoracolumbar intervertebral disk herniation after hemilaminectomy. J Vet Intern Med. (2020) 34:1547–55.
7.Schachar J, Bocage A, Nelson NC, Early PJ, Mariani CL, Olby NJ, et al. Clinical and imaging findings in dogs with nerve root signature associated with cervical intervertebral disc herniation. J Vet Intern Med. (2024) 38:1111–9.
8.Hermanson JW, DeLahunta A, Evans HE, et al. Miller and Evans’ anatomy of the dog. St. Louis, MO: Elsevier, (2020);704–756.
9.Worthman RP. Demonstration of specific nerve paralyses in the dog. J Am Vet Med Assoc. (1957) 131:174–8.
10.van Stee L, Boston S, Teske E, Meij B. Compartmental resection of peripheral nerve tumours with limb preservation in 16 dogs (1995-2011). Vet J. (2017) 226:40–5.