| 品种:缅因猫 | |
| 年龄:4个月 | |
| 性别:未知 | |
| 诊断:漏斗胸 | |
01 主诉及病史
因渐进性运动不耐受和急性呼吸窘迫而被转诊。
尽管有这些临床症状,但这只幼猫的体重与同一家庭中的同窝幼猫相当。
02 检查
体重1.85千克。表现出混合性呼吸困难,呼吸费力,张口呼吸。听诊时发现有轻微的弥漫性呼吸困难,右侧胸腔心音低沉。触诊发现胸骨尾部沿纵轴向背侧凹陷。
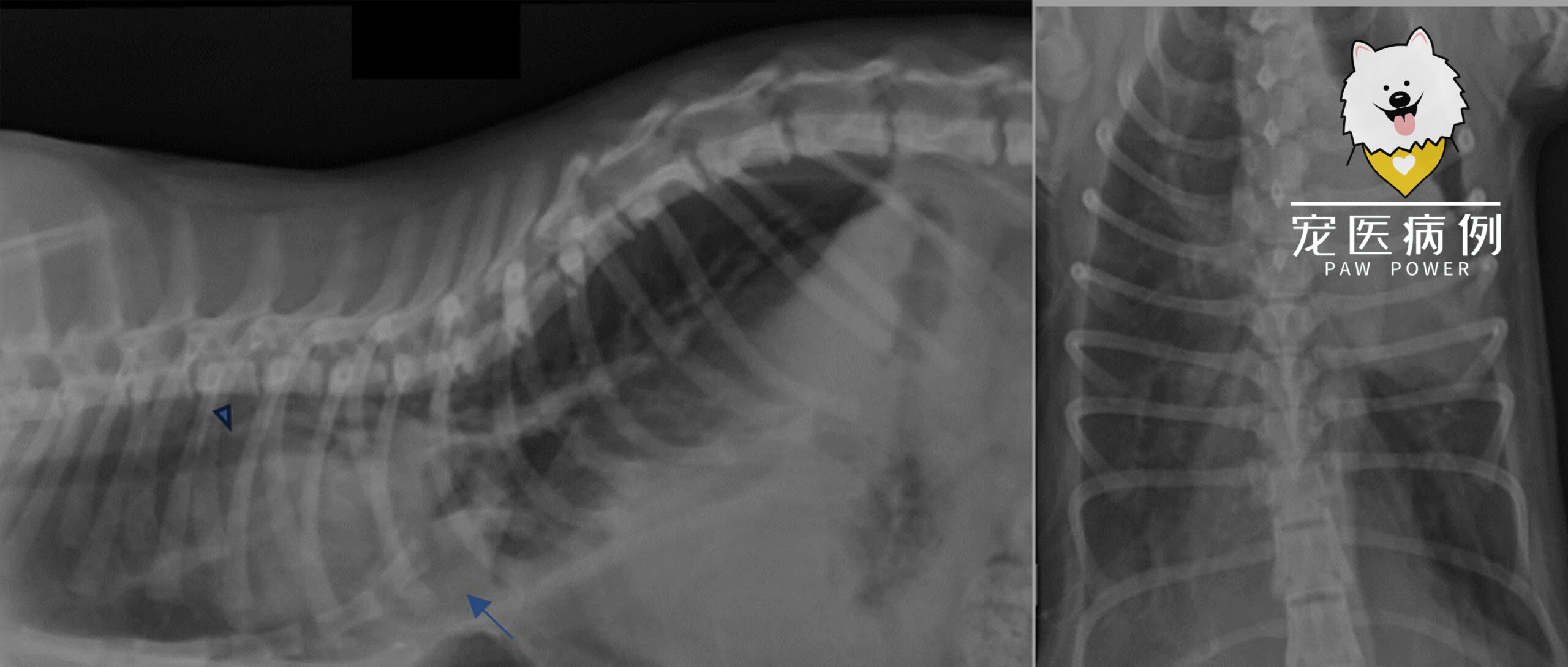
为了确认胸壁畸形,拍摄了标准的侧位和腹背位胸片(下图)。X光片证实胸骨尾端偏移,显示出典型的漏斗胸,胸廓凹陷较短。在腹背切面上,心脏轮廓完全向左侧移位。用前矢状面指数(FSI)和椎体指数(VI)评估了漏斗胸的程度。VI为9.1 [12.6-18.8],FSI为2.1 [0.7-1.3],表明漏斗胸程度为中度。
↑ (a)右侧位和(b)胸部背侧位术前X光片,显示胸骨后背侧偏离(箭头)和胸段气管背侧移位(箭头)。
为进一步评估畸形,进行了CT扫描。得出的VI值为8.7,与放射学检查结果一致。校正指数(CI)估计为13.8,漏斗胸不对称。在右肺叶中部和右颅叶腹侧发现了肺间质病灶。
03 治疗
手术矫正安排在确诊后24小时进行。术前用药包括地西泮(0.2 mg/kg,IV)和吗啡(0.1 mg/kg,IV),然后使用丙泊酚(2 mg/kg,IV)进行诱导。在辅助通气下使用异氟醚维持麻醉。围手术期接受了美洛昔康(0.05 mg/kg,IV)和阿莫西林-克拉维酸(20 mg/kg,IV)。
在左侧第五肋间隙的肋间插入一个3.5毫米带开放阀门的插管(下图),使气流进入胸腔,在大气压下诱发气胸。无需注射二氧化碳,而是让空气从外部进入,使胸膜腔塌陷,从而获得满意的胸腔视野。
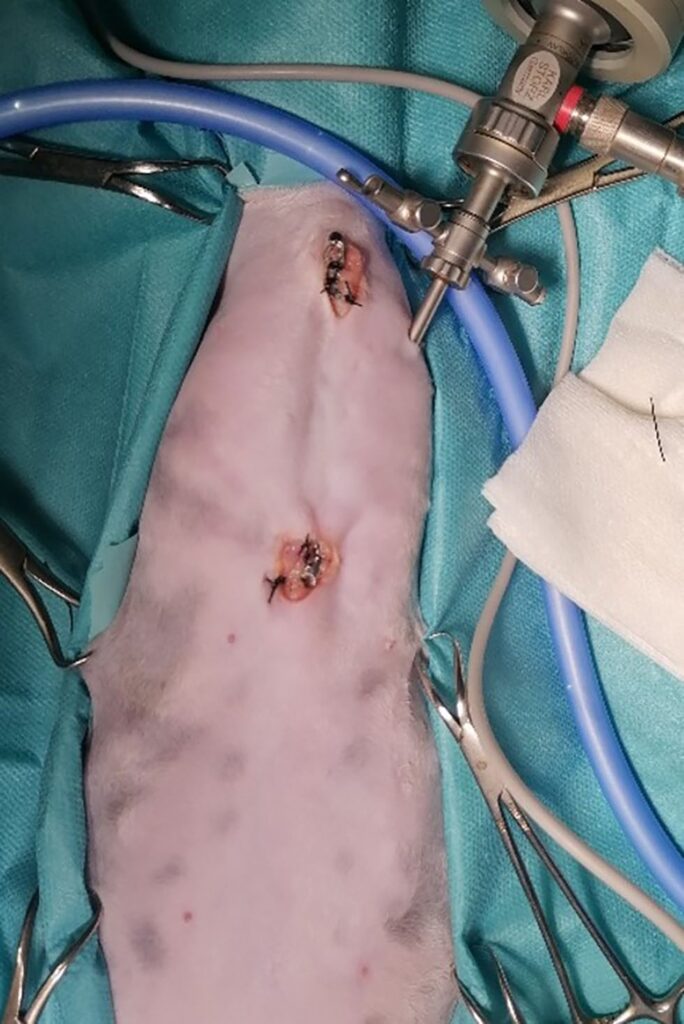
↑ 图片显示在微创放置锁定加压板后如何放置观察镜以观察胸腔。处于背卧位的猫头部位于图片上方。
插入一个2.7毫米、30°的硬质胸腔镜,从而观察肺塌陷和胸壁变形(下图a)。在剑突和胸骨水平做两个小的皮肤切口,以便在胸骨腹面皮下放置一个12孔的2.4毫米锁定加压板。这块钢板是两根环胸骨非吸收性聚酰胺缝线的锚定物,放置时与剑突和尾部胸骨相接。在近端再放置一条不可吸收缝线,穿过钢板上的第一个孔,以稳定钢板。使用胸腔镜进行术中监测可直接观察胸廓顺应性,便于精确调整缝合位置和牵引力。尾部缝合用于对胸骨进行腹侧牵引。
对胸骨施加牵引力,并在摄像头的引导下仔细观察,调整牵引力和缝合线的位置,以达到最佳胸壁对齐效果(下图b)。静脉导管被临时用作胸腔引流管,以解决医源性气胸,在肌肉层闭合后被移除。
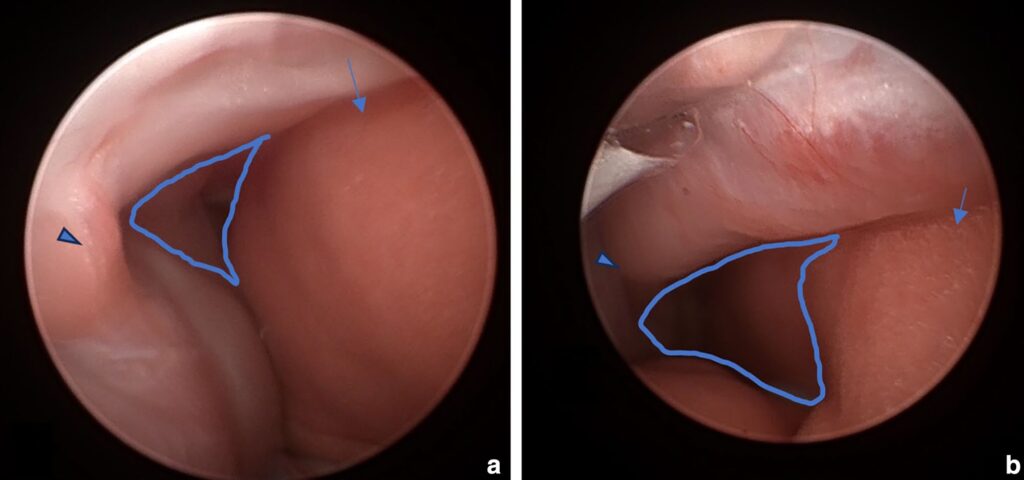
↑ 胸腔镜术中图像,显示(a)胸腔的可视化和(b)手术矫正过程中胸腔顺应性的逐步改善。胸壁(箭头)和左颅肺叶(箭头)在手术过程中增加了胸腔顺应性(连续蓝线)。
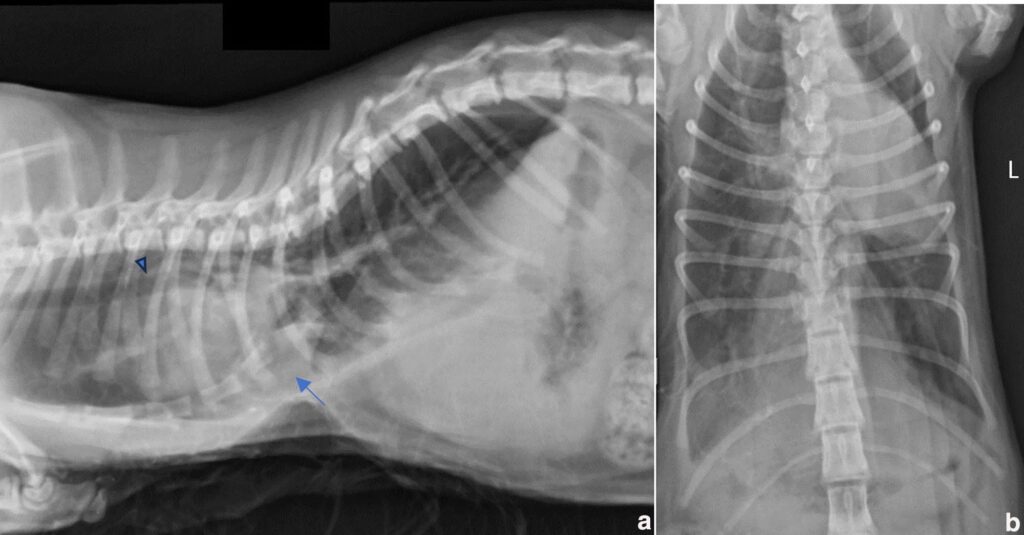
术后胸部正位X光片(下图)和CT显示胸廓畸形有所改善,植入物位置正确,无残余气胸。CT图像上的VI值为11,CI值为10.9。
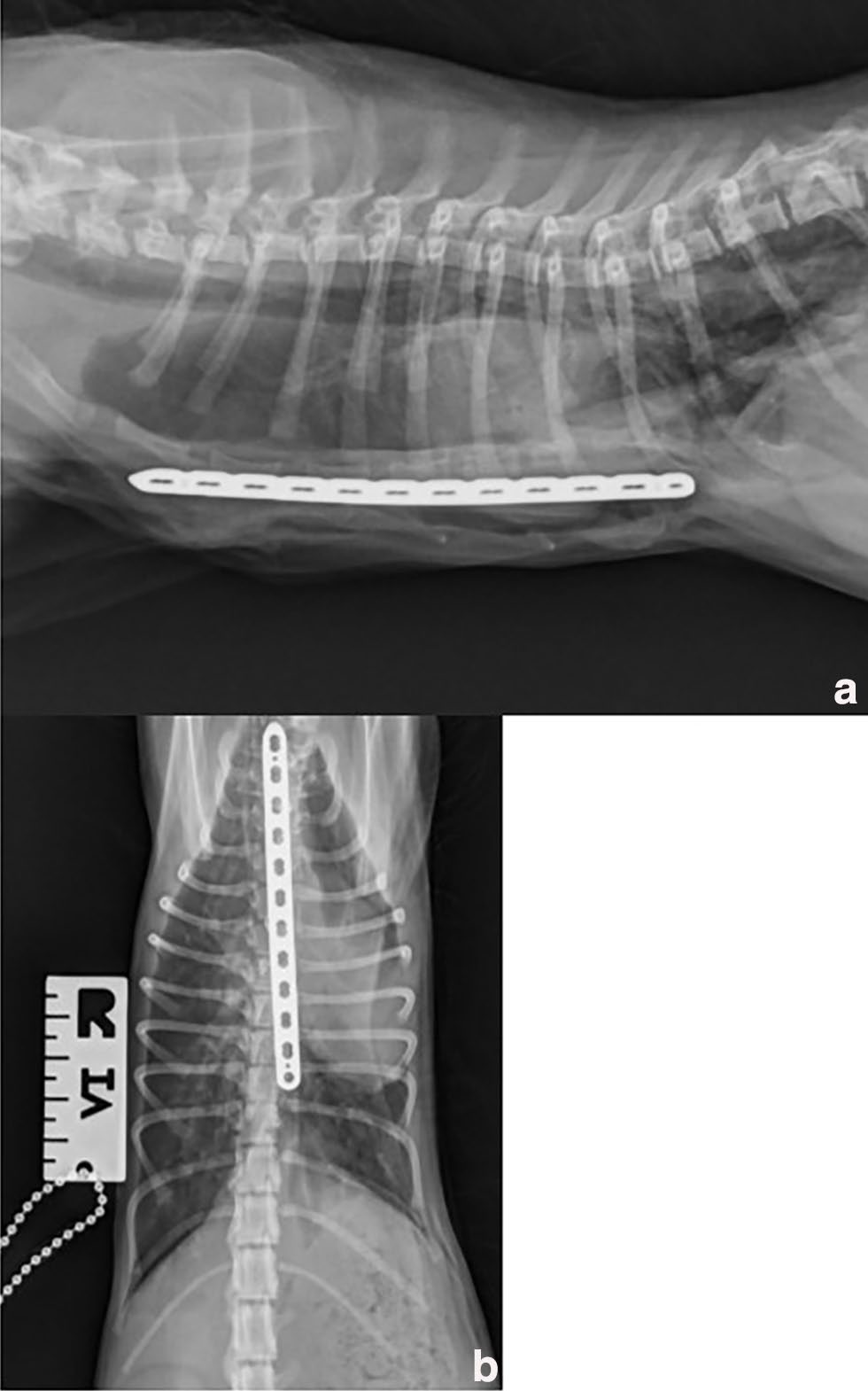
↑ (a)右侧位和(b)背腹位胸廓术后X光片,胸廓畸形已缩小至更正常的形态。与术前影像相比,肺顺应性明显改善。
04 预后
在氧气笼中恢复了12小时,并接受了吗啡(0.1 mg/kg,IV,q6h)治疗。每隔4小时使用格拉斯哥猫科综合疼痛量表(CMPS-F)对疼痛进行评估(平均值为0.4,范围0-1)。
术后第2天,临床症状明显好转,进食良好,体力充沛,没有任何呼吸困难的迹象。安排出院,并服用了为期5天的非甾体类抗炎药(美洛昔康0.05 mg/kg,PO,q24h),同时嘱咐严格限制运动,并在室内监护14天。还建议在无法直接监护宠物的情况下使用笼子。
术后第5天,出现轻度嗜睡和高热(40.1°C)。手术部位出现红斑和轻度血性分泌物。给予广谱抗生素(阿莫西林克拉维酸15 mg/kg,PO,q12h)治疗,5 天后临床症状缓解。每4周拍摄一次胸部正位片,监测肺部病变和肺不张的进展情况,结果显示病情逐渐好转。
术后2个月,第二次出现伤口感染(下图),表现为高热(39.8°C)、嗜睡。两个手术部位都出现了轻微的脓性分泌物和伤口开裂,植入物也随之暴露出来,表明伤口感染与植入物有关。接受了为期3周的第二个抗生素疗程(阿莫西林克拉维酸15 mg/kg,PO,q12h)。抗生素治疗结束后,伤口几乎完全愈合,但仍有一小块几毫米的区域未愈合,可能是对植入物的反应。由于感染持续存在,植入物在术后3个月被取出。
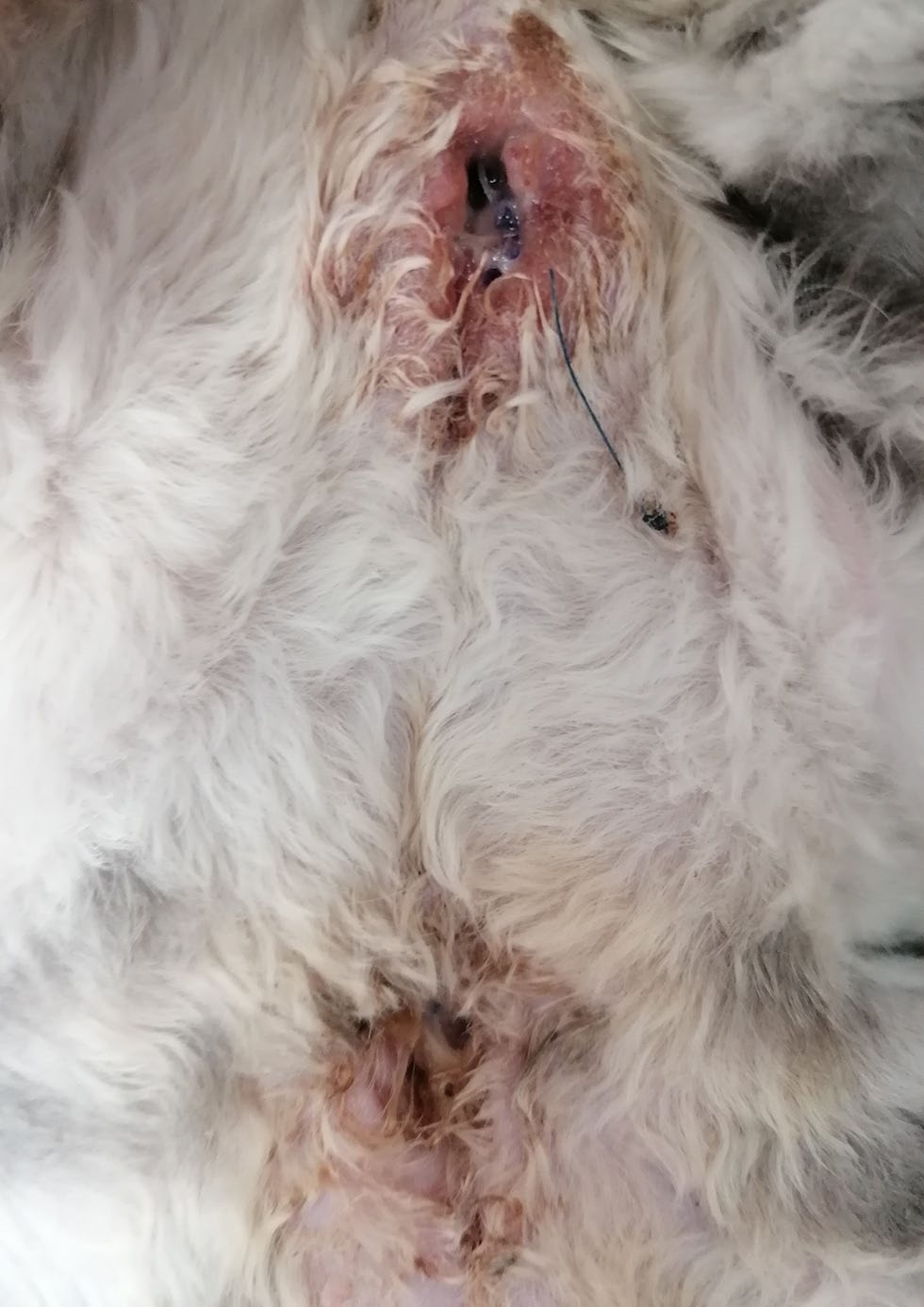
↑ 术后2个月手术部位感染。两个手术部位均出现伤口裂开。伤口有轻度脓性分泌物,并伴有轻度红斑。头位于图片上方,处于背卧状态。
术后12个月,没有出现与漏斗胸相关的临床症状,主人表示生活质量正常。
05 讨论
漏斗胸(Pectus excavatum,PE)是一种胸壁畸形,其特点是胸骨和肋软骨向内偏斜,导致胸廓背腹径减小[1]。一般认为这种情况并不常见[2]。其病因至今仍不十分清楚,但同窝多只动物患病的病例表明该病与遗传有关[3-6]。在猫中,缅甸猫[4]和孟加拉猫[7,8]具有品种易感性。
对于胸廓顺应性差的幼猫(年龄小于4个月),建议的治疗方法通常是使用外部夹板进行矫正[9]。对于胸骨不顺应的老年猫,不鼓励使用外部夹板[8]。矫正的目的是重塑胸部,实现肋软骨连接处和肋骨的向下牵引[10-12]。为此,首选的技术是进行胸骨周围缝合[13]。虽然目前还没有关于缝合位置的具体指导原则,但首要重点必须是谨慎操作,避开重要结构,因为损伤心脏、肺部和大血管的风险很大,尤其是对小患者而言。
与开放手术相比,胸腔镜手术恢复更快,住院时间更短[14]。尽管猫胸腔的工作空间有限,但视频辅助胸腔镜手术(VATS)是一种可行的替代方法,并越来越多地用于各种手术[15-18]。
鉴于本患者体型较小,手术损伤的风险是首要考虑因素。医生认为VATS可最大限度地减少术中并发症,从而大大提高护理效果。如果发生医源性损伤(如肺部或血管损伤),VATS还能更快地做出反应,并可选择转为开放手术,这是非可视化技术所不具备的优势。
直接可视技术可以优化缝合张力的调整,以达到最佳胸壁形态。本可以考虑使用荧光透视等其他方法来协助术中引导,但荧光透视缺乏VATS的直接视觉反馈,不能防止医源性损伤,而且会给手术人员带来辐射风险。VATS在缝合调整和可视化方面的精确度是透视法无法比拟的。
本病例的主要术后并发症是伤口感染。这种并发症与手术技术无关,但由于通常会使用大量的外来材料,因此通常与PE的矫正手术有关[10]。植入物相对于患者的大小可能导致了过度的炎症反应,继发感染可能是由于机械摩擦造成的。此外,还不能排除院内污染的可能性。
由于担心潜在的外部污染,首次出现伤口感染时没有进行培养和药敏试验,医生认识到这一决定可能与最佳临床实践不符。事后看来,为了更有效地指导抗菌治疗,第一次感染时进行培养和药敏试验应是明智之举。但如果在移除植入物后仍出现伤口感染,则有必要进行细菌拭子检测。
缝合处的张力也可能会影响血管供应,从而导致该部位感染。最终,植入物必须被取出,医生认为这是PE修复术后标准护理的一部分。在这种情况下,移除植入物前的较短的矫正时间可能就足够了。作者支持使用VATS,因为它在控制可能的出血或缝合造成的器官损伤方面具有优势,正如之前所建议的那样[22]。
总之,可以利用VATS为外科医生调整缝合张力提供精确的指导。VATS可与解决PE问题的各种既有技术相结合,从而提高手术的准确性。这是首次记录使用VATS矫正幼猫的PE,因为以前只在狗身上报道过。
文献来源:Venzo G, Libermann S. Thoracoscopic-assisted surgical stabilisation with a locking compression plate for pectus excavatum in a Maine Coon kitten. JFMS Open Rep. 2025 Mar 22;11(1):20551169251314253.
参考文献
1. Llabrés-Díaz F, Petite A, Saunders J, et al. The thoracic boundaries. In: Schwarz T, Johnson V. (eds). BSAVA manual of canine and feline thoracic imaging. British Small Animal Veterinary Association. Quedgeley, 2008, pp 340–376.
2. Monnet E. (ed). Small animal soft tissue surgery. Ames, IA: John Wiley & Sons, 2013, pp 720–725.
3. Ellison G, Halling KB. Atypical pectus excavatum in two Welsh terrier littermates. J Small Anim Pract 2004; 45: 311–314.
4. Sturgess CP, Waters L, Gruffydd-Jones TJ, et al. Investigation of the association between whole blood and tissue taurine levels and the development of thoracic deformities in neonatal Burmese kittens. Vet Rec 1997; 141: 566–570.
5. Rahal SC, Morishin Filho MM, Hatschbach E, et al. Pectus excavatum in two littermate dogs. Can Vet J 2008; 49: 880–884.
6. Hassan EA, Hassan MH, Torad FA. Correlation between clinical severity and type and degree of pectus excavatum in twelve brachycephalic dogs. J Vet Med Sci 2018; 80: 766–771.
7. Charlesworth TM, Sturgess CP. Increased incidence of thoracic wall deformities in related Bengal kittens. J Feline Med Surg 2012; 14: 365–368.
8. Yoon HY, Mann FA, Jeong S-W. Surgical correction of pectus excavatum in two cats. J Vet Sci 2008; 9: 335.
9. Fossum TW, Duprey LP, Huff TG. (eds). Small animal surgery. 4th ed. St Louis, MO: Elsevier Mosby, 2013, pp 983–988.
10. Risselada M, De Rooster H, Liuti T, et al. Use of internal splinting to realign a noncompliant sternum in a cat with pectus excavatum. J Am Vet Med Assoc 2006; 228: 1047–1052.
11. Crigel M, Moissonnier P. Pectus excavatum surgically repaired using sternum realignment and splint techniques in a young cat. J Small Anim Pract 2005; 46: 352–366.
12. Mestrinho LA, Ferreira CA, Lopes AM, et al. Open surgical correction combined with an external splint for correction of a non-compliant pectus excavatum in a cat. J Feline Med Surg 2012; 14: 151–154.
13. Fossum TW. Small animal surgery. 3rd ed. St Louis, MO: Elsevier Mosby, 2007, pp 867–895.
14. Schmiedt C. Small animal exploratory thoracoscopy. Vet Clin North Am Small Anim Pract 2009; 39: 953–964.
15. Kovak JR, Ludwig LL, Bergman PJ, et al. Use of thoracoscopy to determine the etiology of pleural effusion in dogs and cats: 18 cases (1998–2001). J Am Vet Med Assoc 2002; 221: 990–994.
16. Plesman R, Johnson M, Rurak S, et al. Thoracoscopic correction of a congenital persistent right aortic arch in a young cat. Can Vet J 2011; 52: 1123–1128.
17. Wormser C, Singhal S, Holt DE, et al. Thoracoscopic-assisted pulmonary surgery for partial and complete lung lobectomy in dogs and cats: 11 cases (2008–2013). J Am Vet Med Assoc 2014; 245: 1036–1041.
18. Griffin MA, Sutton JS, Hunt GB, et al. Video-assisted thoracoscopic resection of a noninvasive thymoma in a cat with myasthenia gravis using low-pressure carbon dioxide insufflation. Vet Surg 2016; 45: O28–O33.
19. Komsta R, Łojszczyk A, Dębiak P, et al. Computed tomographic evaluation of pectus excavatum in 14 cats. PLoS One 2022; 17.
20. Fossum T, Boudrieau R, Hobson H. Pectus excavatum in eight dogs and six cats. J Am Anim Hosp Assoc 1989; 25: 335–337.
21. Reid J, Scott EM, Calvo G, et al. Definitive Glasgow acute pain scale for cats: validation and intervention level. Vet Rec 2017; 180: 449.
22. Bobis Villagrà D, Charlesworth TM. A novel video-assisted thoracoscopic approach for pectus excavatum surgical treatment in a dog. Vet Surg 2022; 51: 1009–1015.