| 品种:短毛猫 |
| 年龄:2岁3个月 | |
| 性别:雄 | |
| 诊断:永存动脉干,左心房憩室 | |
01 主诉及病史
呼吸困难、张口呼吸、运动不耐受和发绀在过去6个月里加重。
自从这只猫被收养以来,主人就注意到了这些临床症状。
02 检查
体重3.3公斤。消瘦,体况评分3/9,体温38.2°C,心率180 bpm,动脉搏动正常。呼吸模式异常,呼吸频率增加(48次/min)和轻度呼吸困难。结膜和口腔黏膜出现紫绀,随着躁动而恶化。胸部听诊显示双侧出现4/6级收缩期胸骨旁杂音,呼吸音正常。腹部触诊未见异常,腹部轮廓正常。没有进行血液检查。
心电图显示窦性心律,平均心率190 bpm。超声心动图显示右心室游离壁明显肥大,舒张厚度8.7 mm,伴有乳头肌突出。右心房严重扩张(最大舒张期头尾径20.3 mm [<12 mm])。三尖瓣的瓣叶边缘严重增厚(下图)。左心房正常,最大舒张期头尾径13.7 mm [<16 mm]。左心室游离壁肥厚,舒张期厚度为7.3 mm。
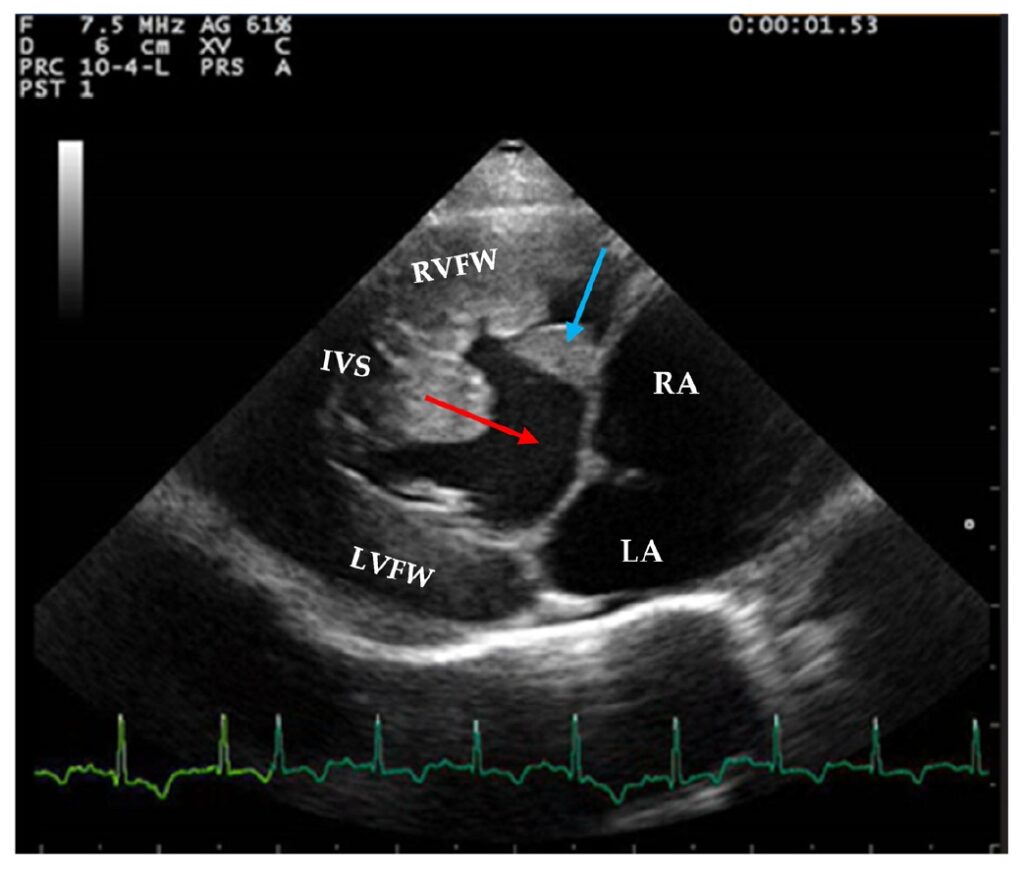
↑ 观察到大的室间隔缺损(红色箭头);三尖瓣严重增厚(蓝色箭头)。右心室游离壁严重肥大,左心室壁中度肥大,右心房扩张。RVFW:右心室游离壁,IVS:室间隔,LVFW:左心室游离壁;RA:右心房,LA:左心房。
在乳头肌水平的右侧胸骨旁短轴视图中,室间隔在收缩期和舒张期均变平(下图)。在右侧胸骨旁长轴和短轴视图中都发现了一个大的室间隔缺损,长轴视图中测量的直径至少为10.2 mm。
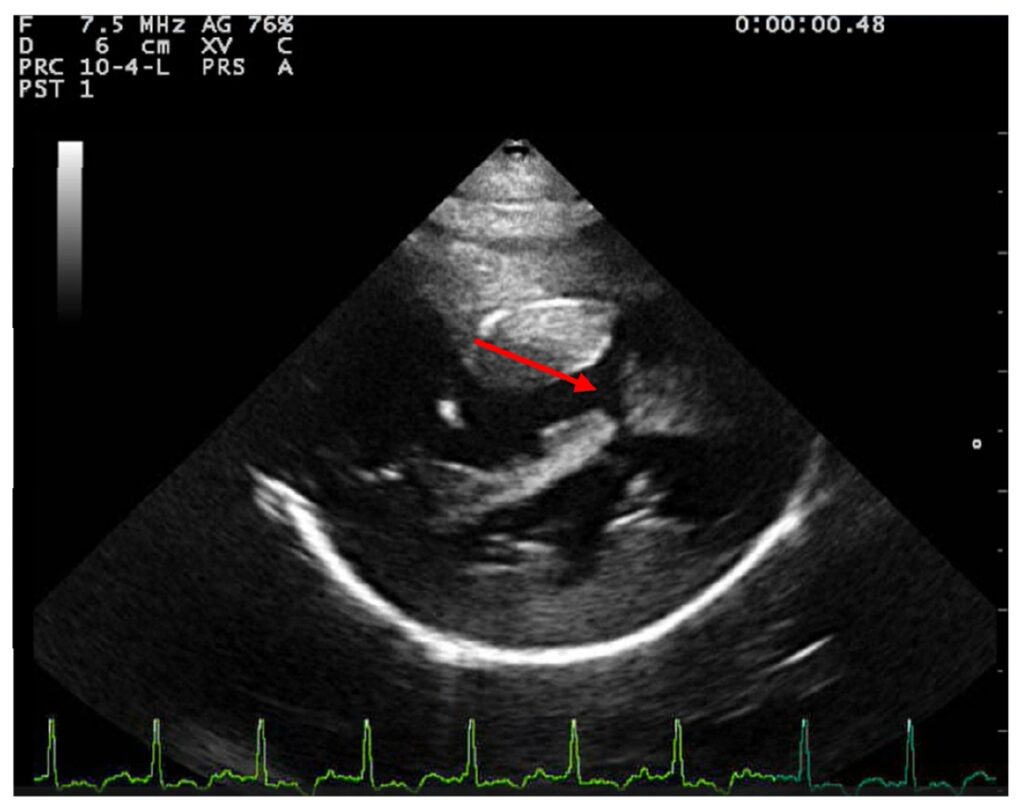
↑ 观察到室间隔缺损(红色箭头)。
彩色血流多普勒检查显示,室间隔缺损存在左向右分流(下图),峰值速度为1.3 m/s。发现一条大主干,起源于心脏底部,与两个心室相通。后腔静脉未扩张,吸气时塌陷。还进行了对比超声心动图检查,证实存在双向分流的室间通信。

↑ 在室间隔缺损的平面上进行彩色多普勒检查,发现了左向右的血流。
03 治疗及预后
不建议进行治疗,只进行了3个月的随访,后续主人没有再进行随访。
在诊断后1年零9个月死亡,并进行了全面尸检。
04 尸检
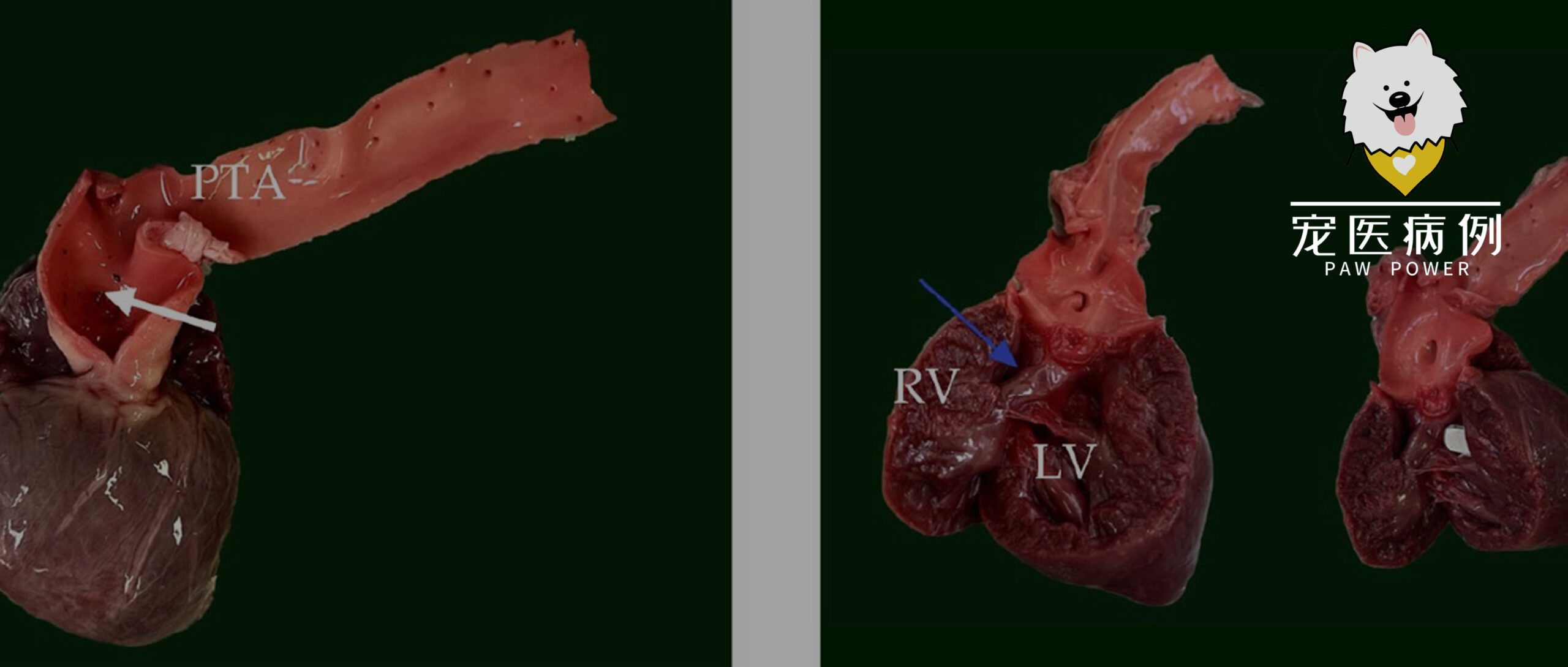
心脏明显增大(器官重37克,占总体重的1.12%),心室壁明显增厚(双侧心室肥大)。从心脏底部开始,观察到一条永存动脉干(PTA)(长0.8厘米)及其心室流出道(下图)。
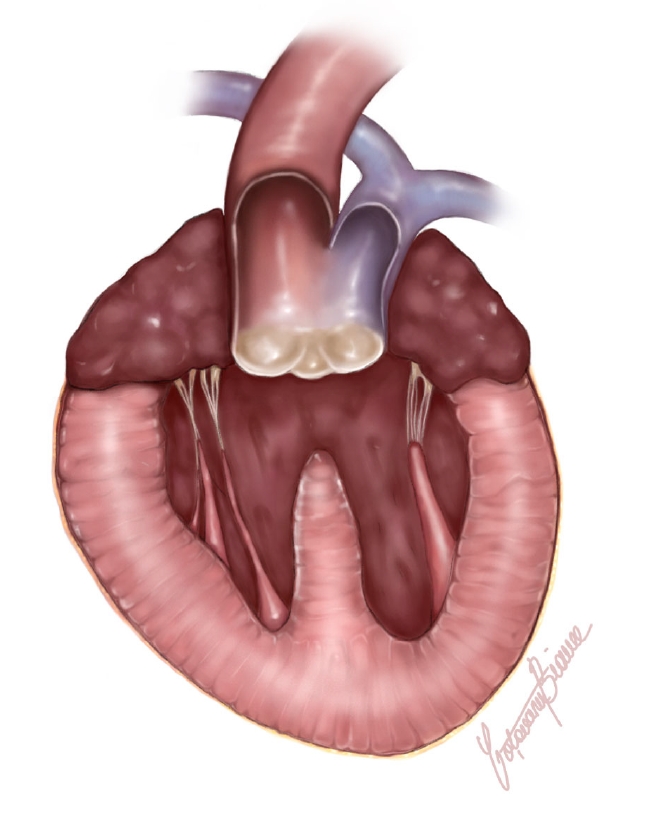
↑ 本病例中永存动脉干的解剖示意图。正面图,突出显示肺动脉和主动脉异常融合成一条源自心室的动脉干,同时伴有明显的室间隔缺损。蓝色(肺动脉)用于区分两条血管。
在距离PTA起源0.5厘米处,PTA产生了肺动脉,随后分支为右肺动脉和左肺动脉。在动脉干下方,在室间隔上段观察到一个1.2厘米的大的非限制性室间隔缺损。该PTA被确定为1型PTA(下图)。
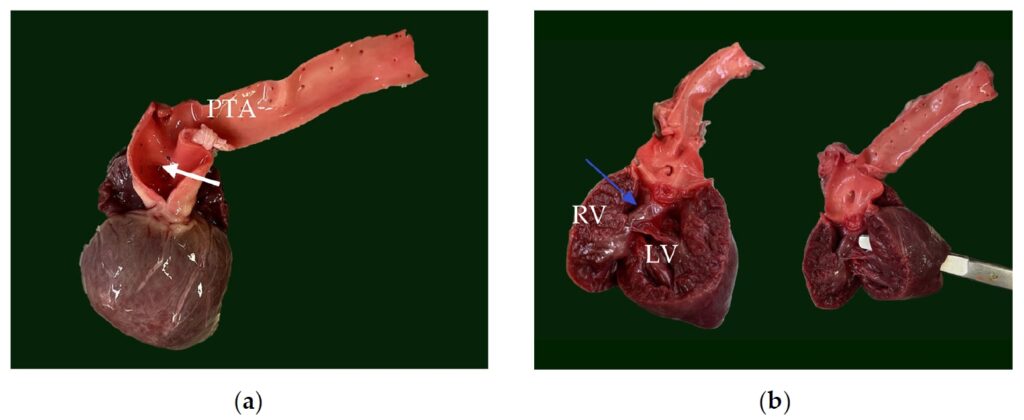
↑ (a)带有肺动脉开口的动脉干(白色箭头)。(b)室间隔缺损(蓝色箭头),通过室间隔缺损在两个心室之间形成直接连通;剪刀可以直接从左心室横穿到右心室。PTA:永存动脉干,RV:右心室,LV:左心室。
二尖瓣增厚并呈结节状,并伴有增厚的腱索(下图)。
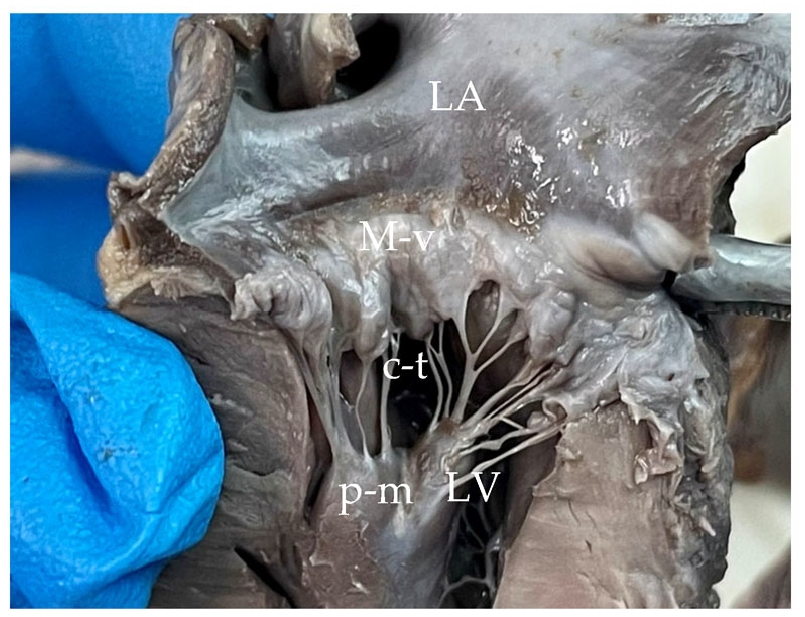
↑ 左心-二尖瓣,外观特征为粘液瘤样变性,瓣膜增厚结节状,腱索也增厚。LA:左心房,LV:左心室,M-v:二尖瓣,c-t:腱索,p-M:乳头肌,RA:右心房,RV:右心室,t-v:三尖瓣。
由于二尖瓣反流,左心房出现了心内膜反流疤痕(喷射线)。在左心耳内,存在一个与心房腔相通的小外翻结构(直径5 mm)(下图)。该结构被确定为心包范围内的左心房憩室。未观察到左心房疝或心包缺损的迹象。左心房憩室内壁光滑,完全被心外膜覆盖。

↑ 左心房憩室的外观(蓝色箭头),起源于左心房。
组织学上,憩室保留了心房壁所有三层,尽管它表现出心肌和心内膜的明显变薄,最薄的区域小于140 μm(下图)。
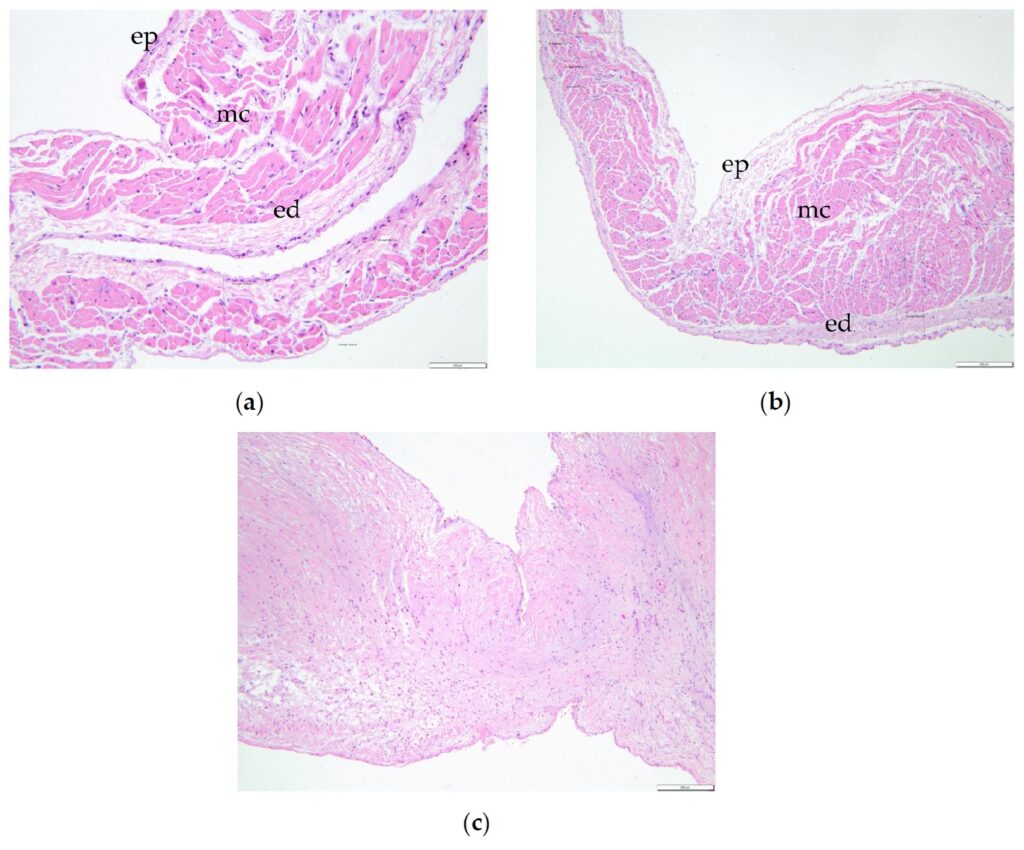
↑(a)左心房憩室在其顶点周围呈现出非常薄的外观,直径136.56 μm。(b)从左心房壁过渡到憩室,壁变薄(从936.26变为304.97 μm),尤其是心肌(从771.78变为190.01 μm)和心内膜(142.14变为51.76 μm)。(c)二尖瓣呈现粘液瘤样变性,海绵质增厚,松散排列的纤维结缔组织明显破坏和替代纤维。ep:心外膜,mc:心肌,ed:心内膜,spl:脾脏,pnc:胰腺,fb-t:纤维组织。
三尖瓣及其腱索均弥漫性增厚,伴有肥大乳头肌的异常分割。前乳头肌直径为6 mm,后部有一个小附属物。后乳头肌呈分叉状,而动脉下乳头肌又分为五个不同的节段。这些发现提示多余乳头肌的存在(下图)。

↑ 右心-三尖瓣,粘液瘤变性初期,腱索增厚,乳头肌过多和肥大。LA:左心房,LV:左心室,M-v:二尖瓣,c-t:腱索,p-M:乳头肌,RA:右心房,RV:右心室,t-v:三尖瓣。
除了心脏异常外,对胸腔的评估还显示了肺胸膜异常,其特征是右肺中叶水平的胸膜异常插入。这种异常表现为与胸壁和肺叶直接接触的纤维状透明膜,没有伴有明显的肺纤维化(下图)。
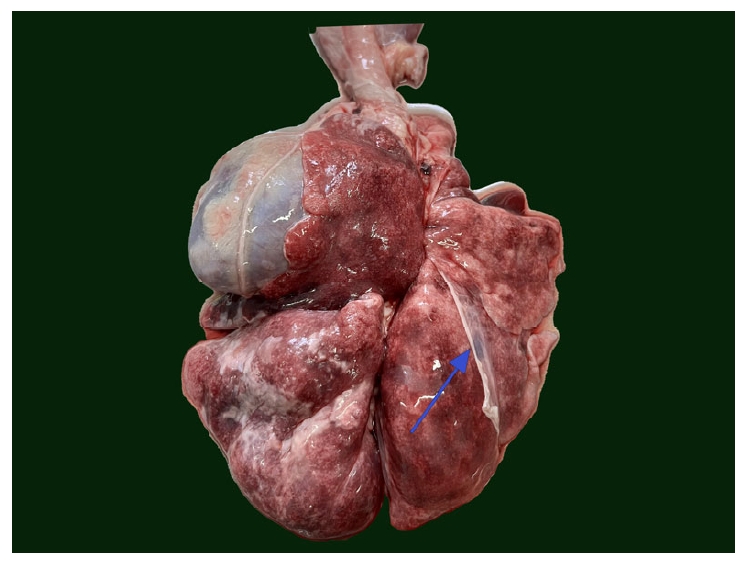
↑ 附着在肺胸膜上的异常纤维膜(蓝色箭头)的大体外观。PTA:永存动脉干,RV:右心室,LV:左心室。
除了所有胸部发现外,肉眼可见腹腔内脾实质延伸到胰腺尾部,组织学上证实为脾胰融合(下图)。
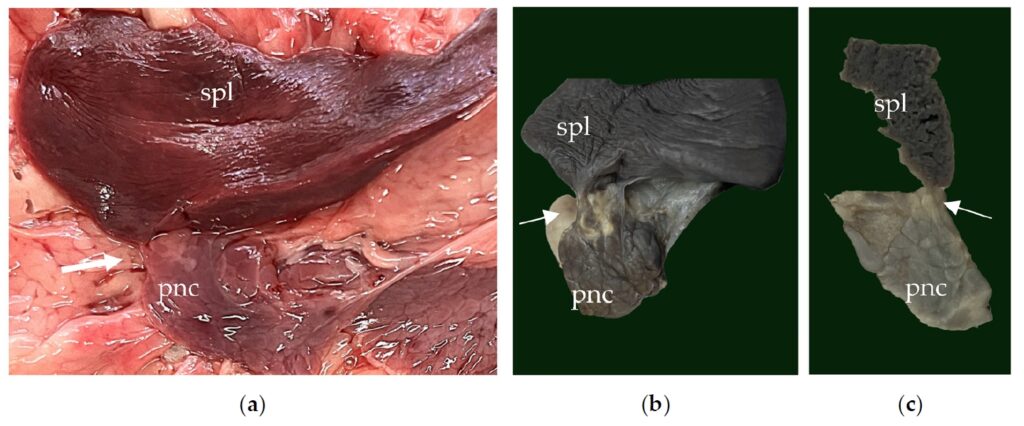
↑(a)脾胰融合的大体形态(白色箭头)。(b)福尔马林固定了融合物的外观(白色箭头)。(c)脾胰融合的纵切面(白色箭头)。spl:脾脏,pnc:胰腺。
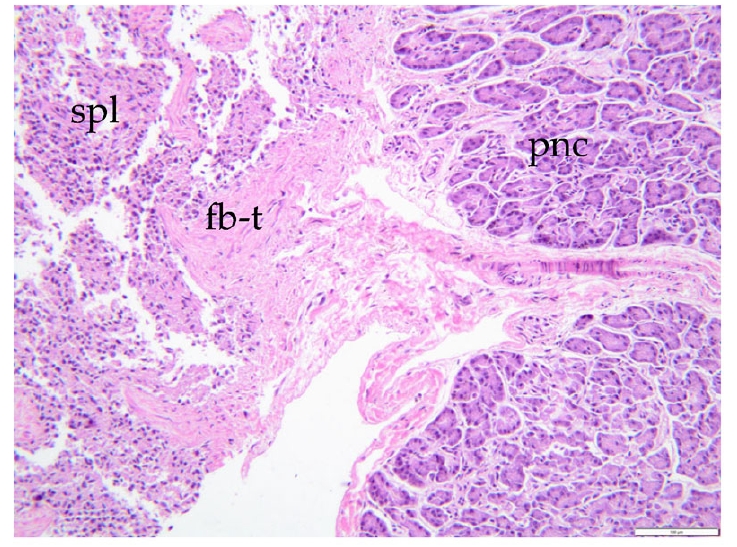
↑ 脾胰融合:脾脏和胰腺通过纤维成分牢固地结合在一起。纤维桥穿过脾脏和胰腺实质,使两个器官之间具有连续性。ep:心外膜,mc:心肌,ed:心内膜,spl:脾脏,pnc:胰腺,fb-t:纤维组织。
05 讨论
永存动脉干(Persistent truncus arteriosus,PTA)是猫的一种罕见先天性异常,其特征是胚胎动脉干无法分离为肺动脉和主动脉[1-8]。这将导致单个动脉干,通常伴有室间隔缺损[1]。PTA最常见的临床症状包括呼吸困难或呼吸急促、粘膜发绀和运动不耐受[3,6]。很难确定一个明确的结果,因为猫只报告了少数病例[2-6]。
根据主动脉-肺融合程度,PTA可分为4种类型:1型——动脉干同时产生升主动脉和单个肺动脉干;2型——从动脉干的背壁开始,左右肺动脉紧密相连;3型——从主动脉干的任一侧,一条或两条肺动脉分别出现;4型——肺动脉缺失,先天性明显缺乏第六主动脉弓,同时通过支气管动脉维持肺循环[1]。尽管在人类医学中进行了广泛的研究,但家猫PTA的报告仍然很少,这使诊断和治疗变得复杂[2-8]。
左心房憩室(Left atrial diverticulum,LAD)是一种囊状结构,从左心房壁广泛向外突出,其特征是囊状和光滑的轮廓。LAD被认为是一种解剖变异,直接与左心房腔相通,通常很小,不到1厘米,尽管偶尔会观察到更大的憩室。这些结构通常呈现分叶状,并可能表现出内部小梁[9,10]。
猫的1型PTA在之前的5篇出版物[2-6]中都有文献记录。这些报告只描述了家养的短毛猫,包括3只雄猫和2只雌猫。与本病例类似,大多数患者的诊断年龄在5个月到2岁之间,但在一只6岁的猫身上也发现了病变[6]。最常见的临床症状包括呼吸急促和发绀,通常会因压力或运动而加剧。在某些情况下,从较早的年龄就注意到了临床症状[6]。
本病例罕见地发现了一只猫的1型PTA,与LAD有关,LAD是一个与心房腔相通的5 mm光滑壁外翻,壁的组织学得以保留。这种结构和组织学描述与人类的发现相似,人的LAD被定义为轮廓光滑的小袋状结构,通常小于1厘米,并被认为是解剖变异[10,15]。即使在人类中,LAD也是一种罕见的畸形[9]。
脾胰融合是一种罕见的先天性畸形。这种情况包括胰尾和脾门融合或异位胰腺或脾脏组织的存在,是由于发育过程中胃背中膜内胰腺和脾脏之间的密切相互作用导致的胚胎发育障碍[16]。虽然脾胰融合异常在人类中有很好的记录,并且与13三体等先天性疾病有关[17],但包括猫在内的动物报告却很少。
总之,本病例突出了猫中罕见的1型PTA,与LAD有关。这些发现扩展了对动物LAD的理解,并与人类医学中记录的先天性异常进行了比较。本病例强调了详细诊断评估在兽医心脏病学中识别和表征复杂先天性异常的重要性。
文献来源:Constantin I, Cofaru A, Murariu R, Scurtu IC, Tăbăran FA. Concurrent Persistent Truncus Arteriosus and Left Atrial Diverticulum in a Domestic Short-Haired Cat. Animals (Basel). 2025 Mar 20;15(6):899.
参考文献
1.Collett R.W., Edwards J.E. Persistent truncus arteriosus: A classification according to anatomic types. Surg. Clin. N. Am. 1949;29:1245–1270.
2.Chuzel T., Bublot I., Couturier L., Nicolier A., Rivier P., Mai W., Cadoré J.L. Persistent truncus arteriosus in a cat. J. Vet. Cardiol. 2007;9:43–46.
3.Monge-Utrilla O., García-Rodríguez M.B., Cuesta-García N., Diez-Prieto I. Atrioventricular dissociation in a cat with persistent Truncus arteriosus. Vet. Med. Sci. 2023;9:1031–1035.
4.Bertrand A.F.T., Lazard M., Bouhsina N., Fusellier-Tesson M.S. What Is Your Diagnosis? J. Am. Vet. Med. Assoc. 2019;254:583–585.
5.Markovic L.E., Scansen B.A., Potter B.M. Role of computed tomography angiography in the differentiation of feline truncus arteriosus communis from pulmonary atresia with ventricular septal defect. J. Vet. Cardiol. 2017;19:514–522.
6.Nicolle A.P., Tessier-Vetzel D., Begon E., Sampedrano C.C., Pouchelon J., Chetboul V. Persistent Truncus Arteriosus in a 6-year-old Cat. J. Vet. Med. Ser. A. 2005;52:350–353.
7.Nakao S., Atkinson A., Motomochi T., Fukunaga D., Dobrzynski H. Common arterial trunk in a cat: A high-resolution morphological analysis with micro-computed tomography. J. Vet. Cardiol. 2021;34:8–15.
8.Kochi M., Sugimoto K., Kawamoto S., Inoue M., Machida N. Persistent truncus arteriosus with an anomalous coronary artery in a cat. J. Vet. Cardiol. 2021;35:8–13.
9.Gao C., Wang R., Wang G., Wang Y. Giant Left Atrial Diverticulum. J. Card. Surg. 2011;26:70.
10.Zimmerman S.L. Left atrial diverticula. In: Zimmerman S.L., Fishman E.K., editors. Pearls and Pitfalls in Cardiovascular Imaging: Pseudolesions, Artifacts, and Other Difficult Diagnoses. Cambridge University Press; Cambridge, UK: 2015. pp. 54–56.
11.Schober K., Savino S., Yildiz V. Right ventricular involvement in feline hypertrophic cardiomyopathy. J. Vet. Cardiol. 2016;18:297–309.
12.Schober K.E., Chetboul V. Echocardiographic evaluation of left ventricular diastolic function in cats: Hemodynamic determinants and pattern recognition. J. Vet. Cardiol. 2015;17:S102–S133.
13.Constantin I., Tăbăran A.F. Dissection Techniques and Histological Sampling of the Heart in Large Animal Models for Cardiovascular Diseases. J. Vis. Exp. 2022;184:e63809.
14.Prophet E.B., Mills B., Arrington J.B., Sobin L.H. Laboratory Methods in Histotechnology. Armed Forces Institute of Pathology-American Registry of Pathology; Washington, DC, USA: 1992.
15.Weerakkody Y., Tatco V. Left Atrial Diverticulum. Reference Article. [(accessed on 20 January 2025)].
16.Yildiz A.E., Ariyurek M.O., Karcaaltincaba M. Splenic Anomalies of Shape, Size, and Location: Pictorial Essay. Sci. World J. 2013;2013:321810.
17.Omeri A.K., Matsumoto S., Kiyonaga M., Takaji R., Yamada Y., Ando Y., Mori H., Uchida H., Iwashita Y., Ohta M., et al. Fusion anomaly of the pancreatic tail and spleen: A case report. J. Med. Case Rep. 2017;11:238.