软组织肉瘤(STS)是猫中常见的肿瘤。然而,尽管一些STS可以通过简单的手术切除治愈,但其他一些可能是极具侵袭性的肿瘤,难以成功治疗。
最近的一项研究表明,辅助放疗通常可以在存在残留微小病变的情况下实现良好的长期肿瘤控制。遗憾的是,猫的病理学仍然相对研究不足,它们的病理表现往往比较独特——猫注射部位肉瘤(FISS)就是一个很好的例子,说明猫在这方面表现得与众不同。
以前,我们无法对这些肿瘤进行预后判断,但现在提出了一个组织学分级系统。这篇文章将探讨猫STS的重要性以及FISS带来的复杂性。
在英国猫群的皮肤和软组织中,最常被诊断出的肿块类型是什么?这就是我们在2018年通过研究一家大型英国商业诊断实验室的病例来试图回答的问题。
该研究共纳入了来自9200只猫的9600多个肿块,其中大多数来自初级保健机构。共有89种不同的组织学诊断,其中少数(6.6%)是非肿瘤性肿块(如分枝杆菌感染、真菌肉芽肿和毛囊囊肿等)。
对于肿瘤性肿块,良性肿瘤和恶性肿瘤几乎平分秋色(分别为47.6%和52.7%),这突显了对这些肿块进行组织病理学检查的必要性。
01 软组织肉瘤的类型
在研究肿瘤时,最常见的10种组织学类型占据了所有病例的80%以上(表1)。其中最常见的四种包括基底细胞瘤、“纤维肉瘤“、鳞状细胞癌和肥大细胞瘤。
有趣的是,这四种最常见的肿瘤与其他欧洲(2000年代)和北美(1990年代)类似研究中猫的肿瘤类型一致,尽管具体的顺序有所不同(图1)。
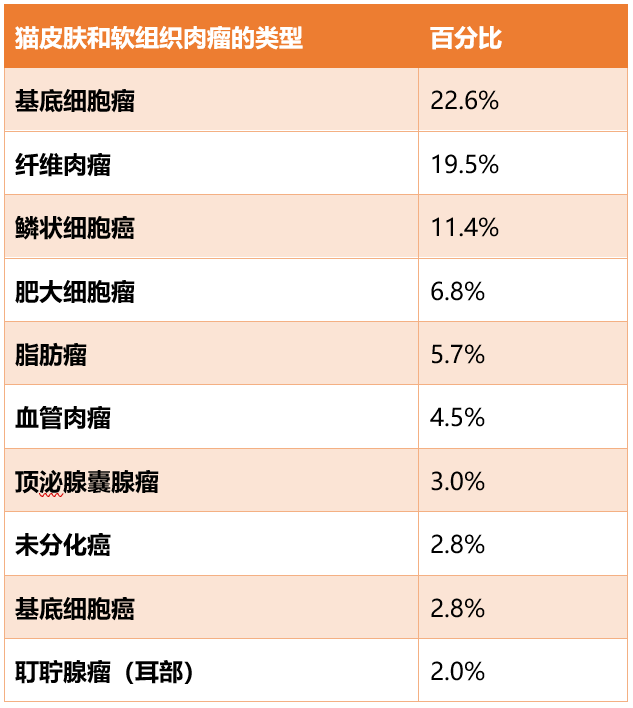
表1. 英国猫皮肤和软组织肿瘤的前10名诊断结果。
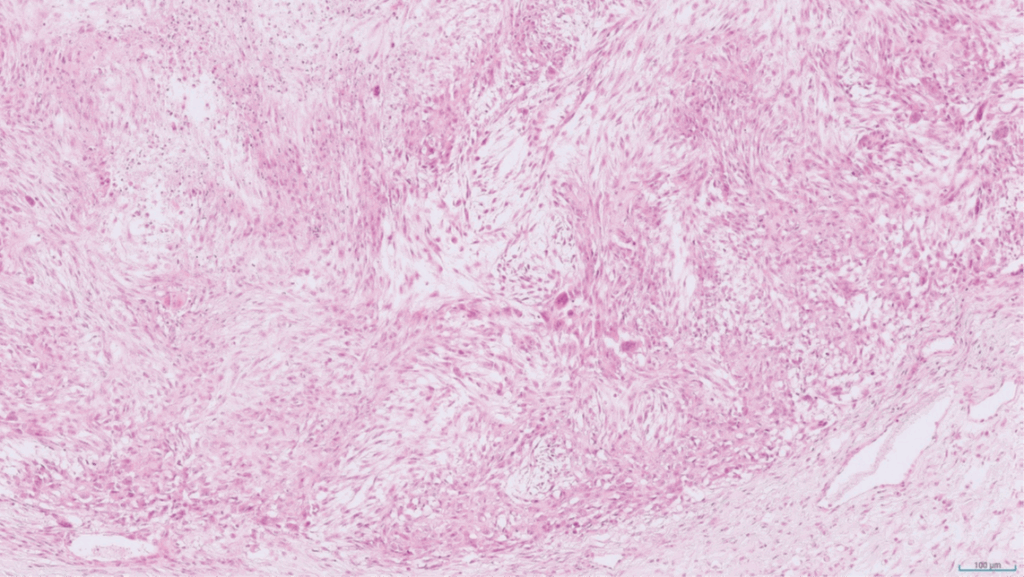
图1. 1940年意大利一只猫的软组织肉瘤。某些肿瘤的诊断似乎并未随时间改变。H&E染色,20倍放大。
“纤维肉瘤”使用了引号,因为这个术语可能与这些研究中的STS同义。这些是起源于软结缔组织的梭形细胞肿瘤,具有不同的组织学起源,但通常被视为一个组别;它们在发病率上仅排在基底细胞瘤之后位居第二(基底细胞瘤是另一组具有不同组织学起源但通常被视为一个组别的肿瘤)。
尽管STS是一组常见的肿瘤,并且在猫患者中可能表现出多种生物学行为,但直到最近,还没有一种预后检测方法,尽管对于狗的同类肿瘤,长期以来一直有一个广泛使用的分级系统。
猫的一个额外复杂问题是存在FISS——这些肉瘤起源于先前注射疫苗的部位、其他形式的注射,或者偶尔是其他形式的“创伤性损伤”,例如芯片植入。
在组织学上,FISS通常是但并非总是纤维肉瘤,往往更具生物学侵袭性,多发生在年轻猫身上,比非注射部位的同类肿瘤具有更高的局部复发率和更大的转移潜力。
然而,目前还没有明确的组织学诊断标准。相反,它们的诊断通常依赖于一组临床和病理特征,包括肿瘤的物理位置、该部位先前注射或其他创伤的兼容临床病史,以及各种提示性的大体和组织学特征,包括高度浸润性生长、大面积中央坏死、显著的淋巴细胞浸润、肿瘤细胞和巨噬细胞的显著多形性,以及巨噬细胞内有胞浆色素(之前曾被推测为佐剂;图2)。
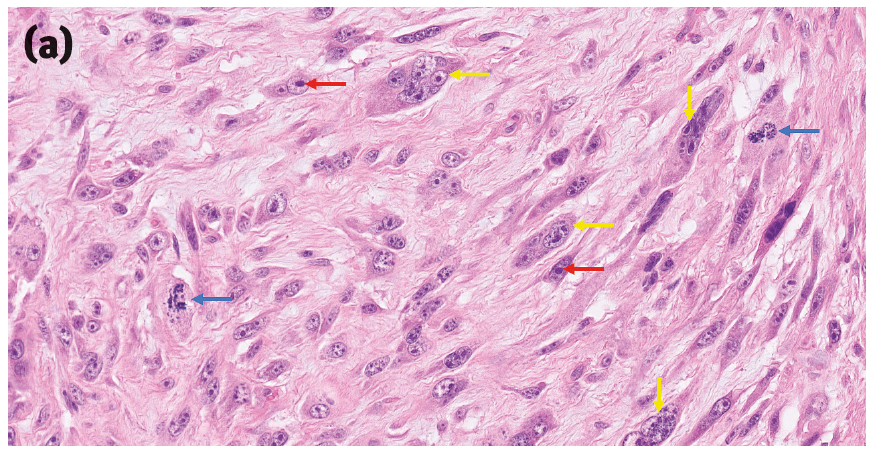
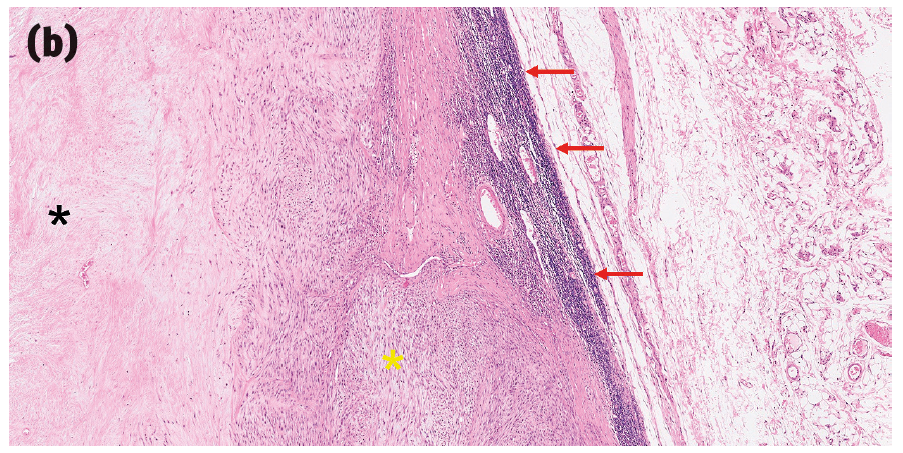
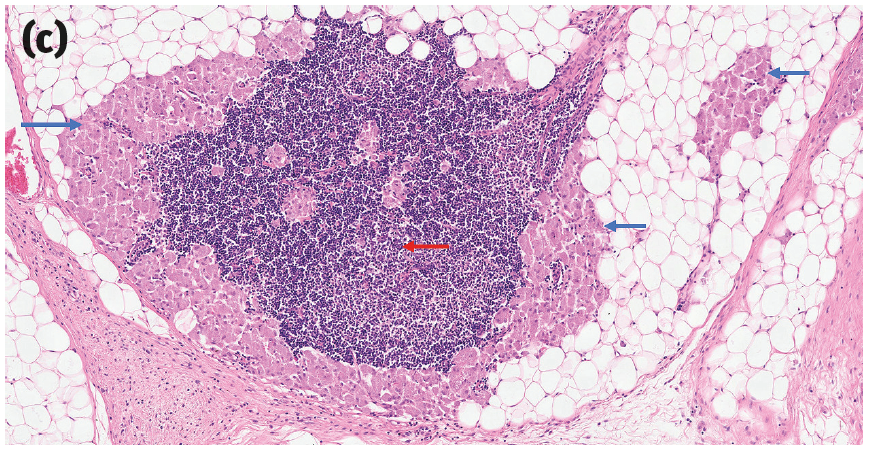
图2. 一些提示猫注射部位肉瘤的组织学特征。(a)肿瘤细胞具有大小和形状各异的细胞核、多核(黄色箭头)、多个大而显著的核仁(红色箭头),以及有时会出现非典型有丝分裂象(蓝色箭头)。(b)猫注射部位肉瘤(黄色星号为肿瘤)有一个大面积的中央坏死区域(黑色星号)以及周边的淋巴细胞带(红色箭头)。(c)猫注射部位肉瘤边缘的巨噬细胞区域,细胞质内有细小的嗜碱性颗粒(蓝色箭头)和淋巴细胞(红色箭头)。
这些组织学特征是可变的,且没有任何一种是这些肿瘤所特有的。这使得病理学家很难将FISS与其他STS区分开来。
02 分级系统
STS是一组以梭形肿瘤细胞为特征的肿瘤(因此有时也被称为梭形细胞肿瘤),其恶性程度各不相同。有些人认为,低级别肿瘤不应被称为肉瘤,而更适合命名为“软组织肿瘤”或“软组织的肿瘤”,因为“肉瘤”一词带有负面的含义。
这些肿瘤往往被归为一组,因为它们在患者体内表现出类似的行为,具有局部复发和浸润性生长的潜力,但总体转移风险通常较低。仅根据常规的H&E染色切片,而不使用免疫组化染色,也很难自信地区分不同的组织学类型,而免疫组化染色的成本通常在预后效用方面并不值得。
犬STS长期以来一直被赋予组织学分级,低级别(I级)肿瘤的预后较好,而高级别(III级)肿瘤的预后最差。犬STS的分级系统与人类STS的分级系统相同;然而,不同物种的STS中包含的肿瘤类型有所不同(表2),不同肿瘤亚型的流行率也各不相同。
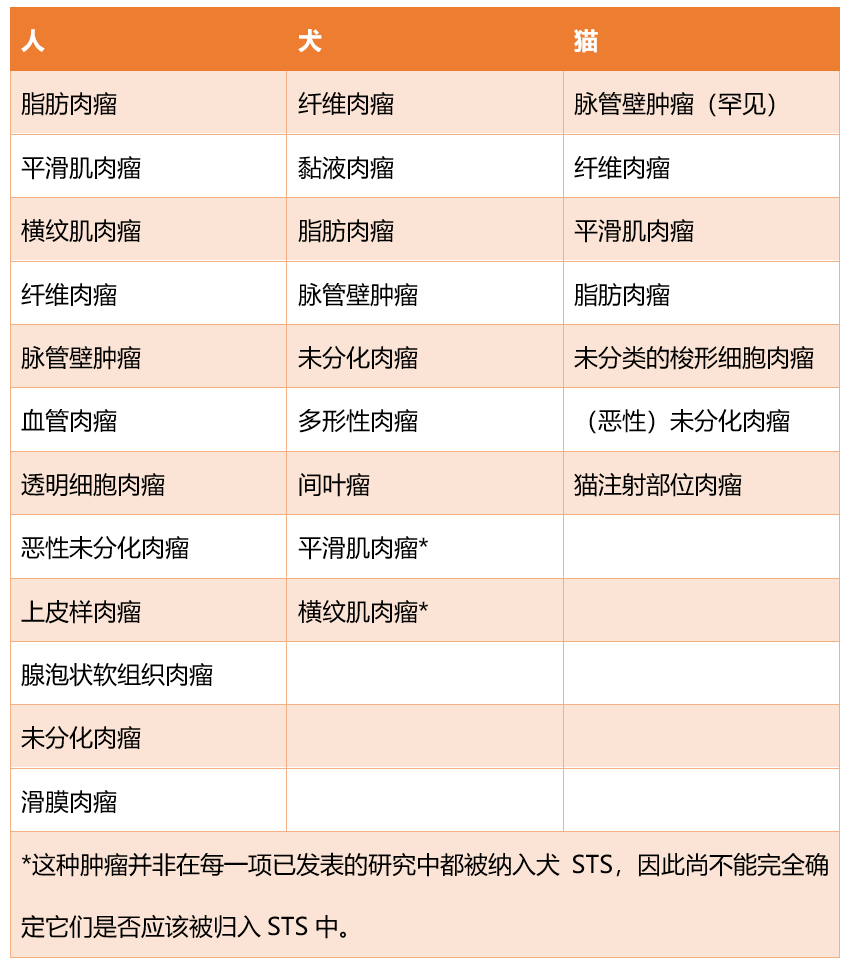
表2. 根据物种,软组织肉瘤中包含的肿瘤组织学类型。
在人类中,STS总体上是较为罕见的肿瘤。血管肉瘤(内皮细胞来源的恶性肿瘤,无论是血管内皮还是淋巴管内皮)被纳入人类STS,但在犬(或猫)STS中,血管肉瘤并不被视为其中的一部分。
平滑肌肉瘤(平滑肌来源的恶性肿瘤)被纳入人类STS。在一些已发表的研究中,平滑肌肉瘤被纳入犬STS,而在其他研究中则没有;在猫中,有人建议将毛囊平滑肌肉瘤(起源于立毛肌的恶性平滑肌肿瘤)纳入其中。
分级系统是为人类STS的预后而开发的。它结合了三个值,一个用于评估肿瘤内是否存在坏死以及坏死的程度,第二个用于评估有丝分裂数量,第三个用于评估一个相对主观的标准,称为“分化评分”——即评估肿瘤细胞与正常组织的相似程度。这三个单独的值相加得出总分,对应低级别(I级)、中级别(II级)或高级别(III级)(表3)。
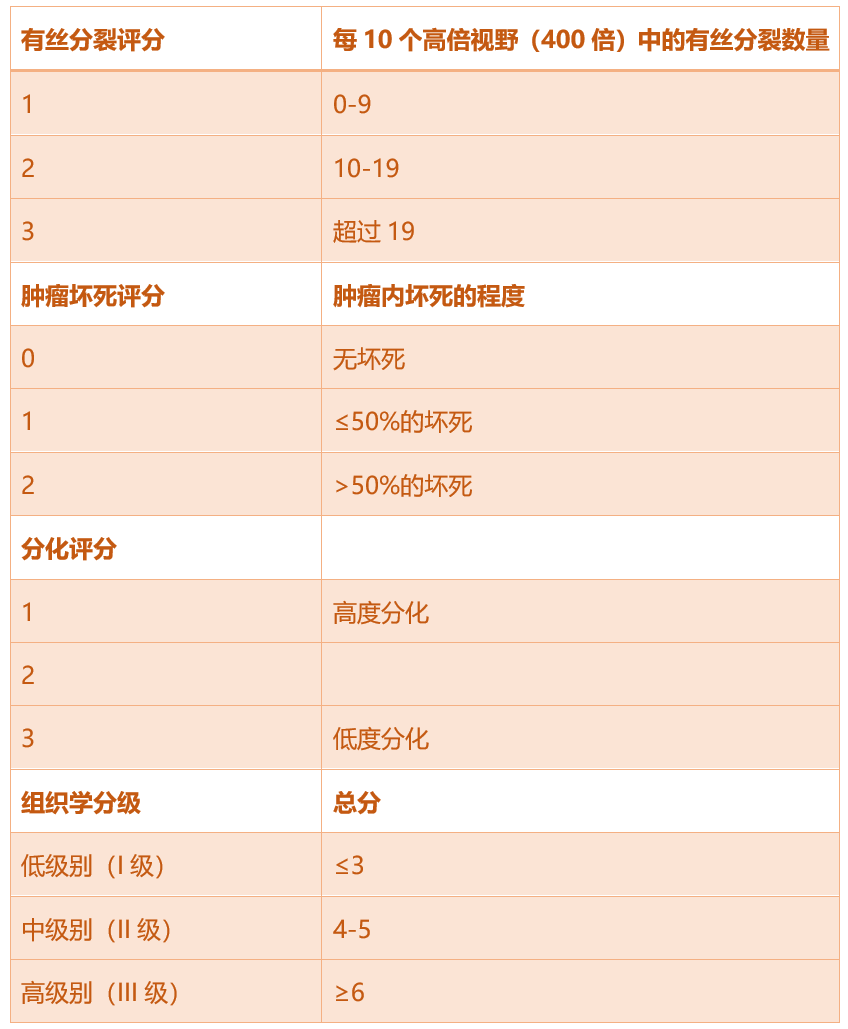
表3. 人和犬软组织肉瘤的分级系统。
最初的研究对155例人类STS的七个独立标准进行了评分,以观察哪些与生存时间、首次转移时间或首次局部复发时间相关。没有任何一个标准与首次局部复发时间具有统计学意义的相关性,但有五个标准与首次转移时间和生存时间显著相关。
对于人类STS患者来说,似乎生存时间与首次转移时间的关系更为密切,而不是局部复发时间。这与犬猫患者不同,我们通常更担心局部复发会影响它们的生活质量,并可能导致更激进的手术、其他治疗方式,甚至最终的安乐死。
尽管转移性疾病似乎较为罕见,但与人类医学相比,动物患者中怀疑的转移性疾病或局部复发很少通过组织病理学确认,且通常不进行尸检以确认死因。最终影响临终决策的因素在动物患者中非常不同,这也影响了研究结果和生存时间的研究终点。
在1984年的研究中,Trojani等人选择了三个与预后相关的标准,并将它们结合起来制定了人类STS的分级系统(表3)。多年来,我们一直将这一人类分级系统应用于犬STS。然而,当犬的肿瘤类型和潜在结果与人类有所不同时,分级结果能告诉我们什么呢?
03 预后
已有几项研究对此进行了调查,结果略有不同。其中一项研究关注的是局部复发,而不是转移性疾病。
研究发现有两个预测因素:一是“干净”的切缘,它们可以预测无肿瘤生存时间——事实上,干净的组织学切缘是局部复发的最重要预后因素,30例完全切除肿瘤的病例均未复发。
其次,分级可以预测局部复发,但不能预测患者的总生存时间。其他研究则不同意这一观点,认为分级与生存时间之间存在一定的相关性,但尚未达成明确的共识。此外,不同研究中对“干净”、“接近”、“完全”或“狭窄”等切缘术语缺乏统一的定义,也使得不同研究之间的结果难以比较。
但是猫呢?为什么我们不使用同样的系统?很少有研究将猫STS作为一个整体进行研究,或者将它们作为单独的肿瘤(例如神经鞘瘤)进行研究,大多数出版物都专注于FISS,而不是其他形式的STS。
由于FISS具有特别的侵袭性,以及与疫苗接种和其他潜在医源性原因的明显联系,它理所当然地吸引了大部分的关注(和资金)。一些研究将人/犬STS分级系统应用于FISS,但没有一项发现它对预后特别有用。
相反,一项研究发现,肿瘤大小(福尔马林固定后的3.75厘米)和有丝分裂计数(最佳临界值为每10个高倍视野20个)最利于预测局部复发,有丝分裂计数也与死亡率相关。我们可以在诊断和预后FISS(仅限FISS)时使用这些特征,但这又回到了我们如何能够特异性地、100%确信地诊断FISS的问题上。
04 提议的猫分级系统
这就是我们在决定进行研究时的情况——目标是提出一个专门为患有任何类型STS的猫设计的组织学分级系统,包括FISS。我们特别选择了能够获取存档组织的病例,并且这些病例也能提供最长的临床结果随访时间;许多病例有长达6年的潜在随访时间。
我们通过向最初提交活检样本的诊所提交问卷来获取这些临床结果,寻找有关局部复发、转移、治疗和生存时间的信息。如果患者已经死亡,我们则进一步寻找死因的详细信息,以确定其是否与肿瘤有关,还是其他原因。
令人欣慰的是,这些猫中有些在6年之后仍然活着,尽管它们在患有STS时已经处于中年或老年,许多猫在这期间死于其他原因,如慢性肾病。
与此同时,病理学家对这些病例进行了独立审查,且在审查过程中对临床结果一无所知。类似于最初研究,我们尽可能多地基于H&E染色切片评估了各种独立特征——我们希望任何由此产生的分级系统都能被其他病理学家轻松复制,无需额外的特殊或免疫组化染色,尽可能客观且快速应用。
我们分析了每个特征与结果之间的统计学关联。确定这些特征后,我们尝试将它们组合成分级系统。我们最初评估了两种不同的分级系统,但最终选择了表现更好的那一个。我们选择的特征与犬/人的系统相似,保留了有丝分裂计数和肿瘤坏死评分,但用炎症评分替换了分化评分(表4)。
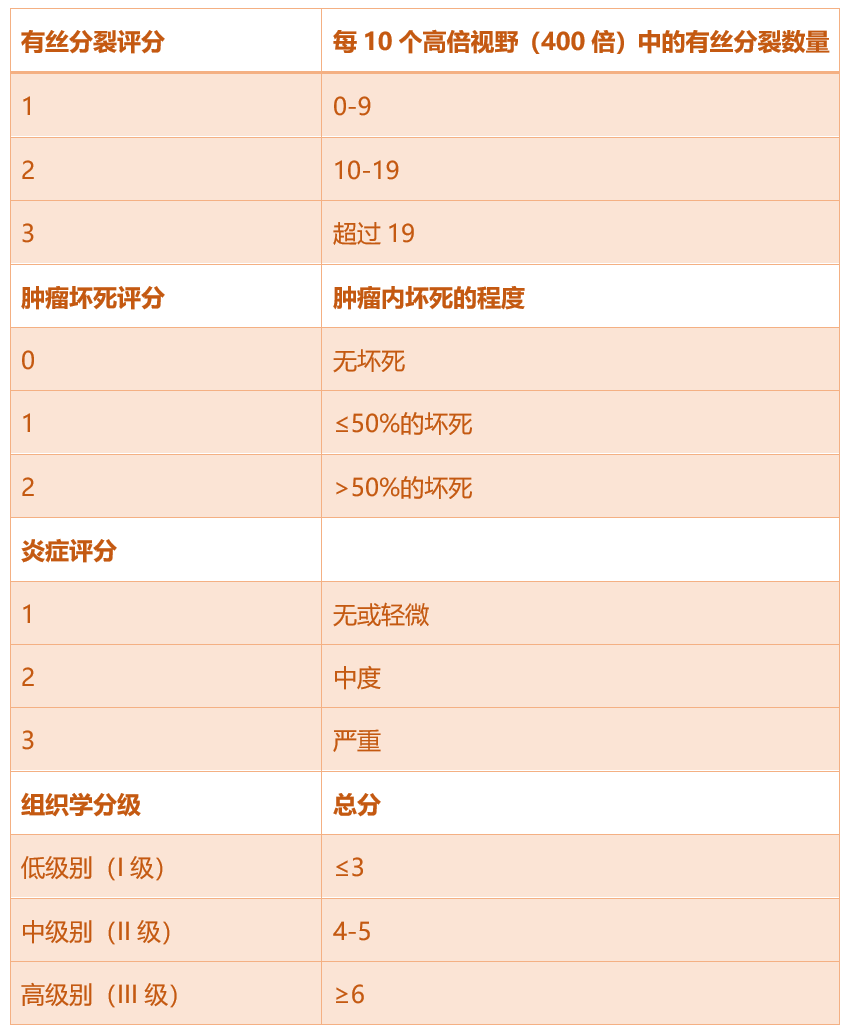
表4. 猫软组织肉瘤的分级系统。
批评者会立即指出,这是一个主观评分,远非理想的替代品,然而,它确实取代了另一个主观标准(分化评分)。此外,统计分析证实,这一特征与我们队列中的结果相关性最强。在Trojani等人的研究(1984)中,作者认为分化评分存在主观性问题,但也是他们模型中“具有最佳预后价值”的标准。
随后,我们回到这些病例中,应用分级系统来看其表现如何。47例病例的队列中包括22只因肿瘤相关疾病死亡的猫,以及25例猫仍然存活或死于非肿瘤相关原因的病例。这两组之间的中位生存时间存在统计学差异。
分级系统将我们的队列分为三个大致相等的组别,分别对应低级别(I级)、中级别(II级)和高级别(III级)肿瘤;每个组别的中位生存时间分别为900.5天、514天和283天(图3),这表明该系统是有效的。
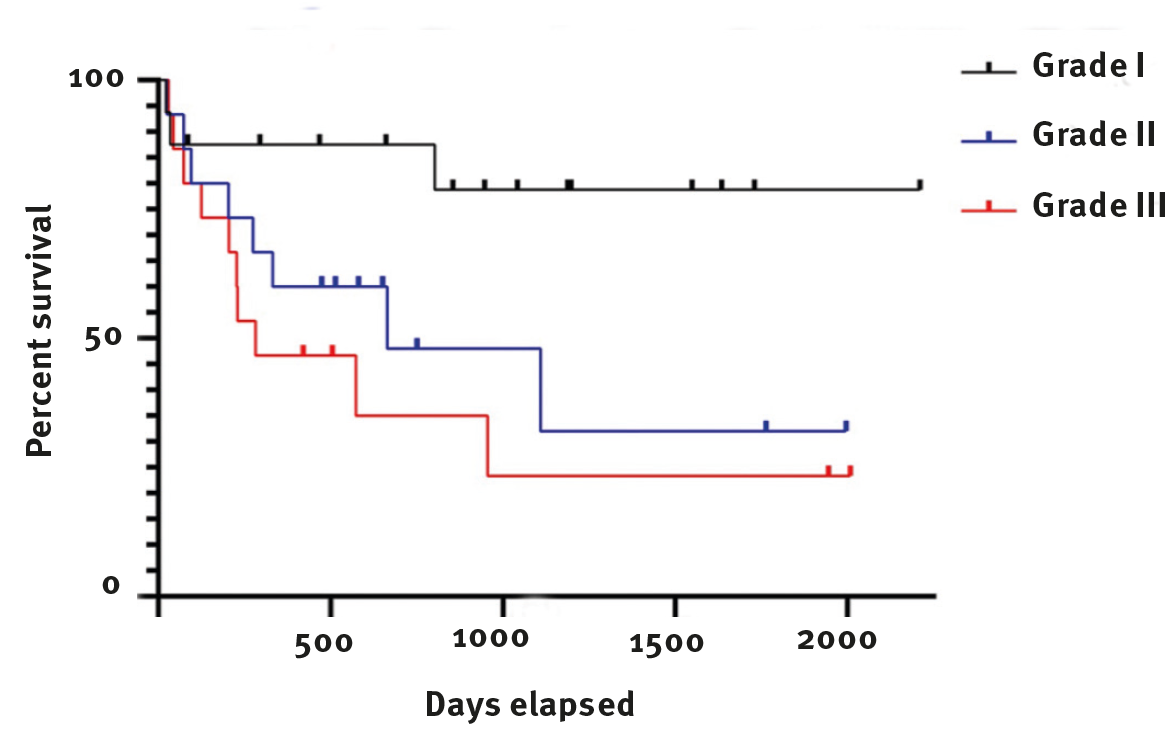
图3. 根据组织学分级的Kaplan-Meier生存曲线。I级肿瘤用黑线表示,II级用蓝线表示,III级用红线表示。标记线表示截断的病例,即在该时间点失访或死于非肿瘤相关原因。
更有趣的是,当我们更仔细地查看每个组别中的病例时,会发现一些情况。对于I级肿瘤的猫,16只中有3只死于肿瘤相关疾病,但这在实际生活中意味着什么呢?其中两例未尝试进行治疗,可能是因为肿瘤的位置或大小、经济原因、生活质量相关问题或预先存在的医疗状况。对于第三例,报告的原因是局部复发,但与此同时,该患者已经存活了802天。
如图3所示,许多I级类别的猫在长时间的随访期间死于非肿瘤相关原因,鉴于它们在诊断时的年龄,这并不令人惊讶。
对于患有II级肿瘤的猫,15只中有8只死于肿瘤相关疾病。其中6只有局部复发,1只怀疑有转移(但请注意,局部复发和怀疑的转移均未通过活检确认,因此我们只能依赖临床怀疑)。对于剩下的1例,没有提供有关死因的进一步细节,只知道这只猫死于肿瘤相关疾病。然而,即使超过一半的猫死于STS,这个队列的中位生存时间仍然达到了514天。
不出所料,患有最高级别(III级)肿瘤的猫的预后较差,16只中有11只被报告死于肿瘤相关原因。其中4例有局部复发,另外4例未尝试治疗,3例怀疑有转移。转移的报告部位包括肺、肾和其他软组织。或许更令人惊讶的是,这个队列的中位生存时间仍然达到了283天。
中级别和高级别的组别更有可能包括患有FISS的猫,我们确实发现II级和III级肿瘤中具有多核巨细胞和胞浆内色素颗粒的巨噬细胞等特征的比例更高。或许正是FISS中存在的炎症成分使得我们在提议的分级系统中的炎症评分如此重要,因为我们知道FISS特别与炎症以及广泛的坏死区域有关。
问卷调查可以是开放式的,一些受访者提供的信息虽然难以纳入已发表的论文,但仍很有趣。例如,许多猫在诊断后6年仍然存活这一事实支持了“能切除就有治愈机会”的说法。由于这些肿瘤往往发生在老年个体中,它们更可能在肿瘤复发或转移性病变发生或达到影响生活质量的阶段之前,死于其他健康问题。
转移性疾病总体上似乎较为罕见,尽管随着组织学分级的升高,风险略有增加。如果任何局部疾病可以被治愈或良好控制,那么对于I级肿瘤来说,还是有一些乐观的理由的。
另一个发现是局部复发在临床中的实际影响。对于一些病例,局部复发意味着需要再次手术,但对于其他病例,可能被认为再次手术不可行,或者不符合患者的利益。在动物患者中,终点往往依赖于主人和兽医对生活质量的评估,这与人类医学有所不同。
最后,有些病例总会让我们对理性科学的最佳尝试感到困惑——一个特别的病例说明了进行此类研究的挑战,但本身也非常发人深省。肢体截肢治愈了猫STS,但却导致剩余肢体发生退行性变化,最终无法获得良好的生活质量,并导致了安乐死。我们是将这归类为非肿瘤相关死亡还是肿瘤相关死亡呢?
05 总结
现在我们有了这个提议的系统,接下来该怎么做呢?Dobromylskyj等人(2021)的研究引起了广泛关注,据我所知,该系统目前正在全球范围内被广泛应用,但我们不能就此止步。不仅对于猫STS,对于许多肿瘤,我们都迫切需要更大规模的、最好是前瞻性的、多机构的研究来验证和完善我们的预后方法。
我们应该继续探索可能更好的预后标准,尽可能转向客观评估,理想情况下易于复制,尽量减少病理学家之间的差异,并能够适用于实际病例和情况。我们需要清晰简洁地传达研究结果,通过跨学科的合作达成共识,例如通过兽医癌症指南和方案小组等组织。
对于猫STS,我们需要考虑是否将FISS纳入STS,或者是否应该以不同的方式处理这些病例。如果我们要这样做,我们也需要更明确的诊断标准,以确保我们首先准确诊断这些肿瘤。
对于剩下的STS,我们是否应该继续将它们作为一个组进行评估和研究,或者是否应该尝试将它们细分为更具体的实体并分别进行研究?理想情况下,分级系统应该应用于“一种物种,一种肿瘤类型”,但在现实中,通过这样做获得的任何预后信息的显著增加的价值,必须能够证明在时间、专业知识和额外染色方面的额外成本是合理的。
最后,我们需要结合其他预后数据来源,例如临床特征和新兴的肿瘤遗传学分析领域,同时研究这些肿瘤的发病机制,以防止它们首先在我们的伴侣动物中出现。
参考文献:Dobromylskyj, M. (2025), Update on feline soft tissue sarcomas. In Practice, 47: 351-361.