一般情况
| 品种 | 混种犬 |
| 年龄 | 3岁 |
| 性别 | 雄 |
| 是否绝育 | 否 |
| 诊断 | α-1抗胰蛋白酶缺乏症 |
01 主诉及病史
希望进一步检查漏出性胸腔积液、慢性干咳、慢性呼气性呼吸困难、嗜睡、食欲下降和体重减轻的原因。
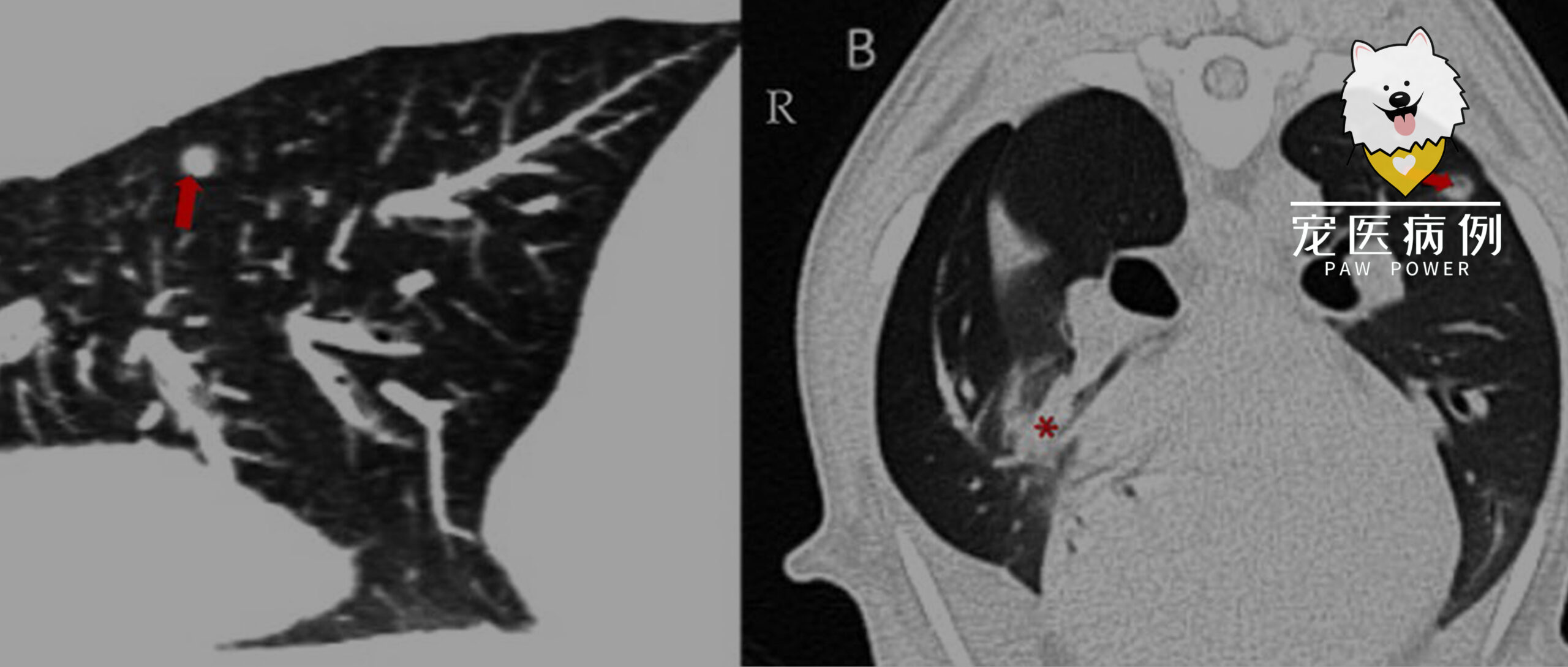
生活在城市,无烟雾、毒物或重金属接触史。转诊兽医已完成血常规、血生化及C反应蛋白等检查,结果均正常。胸部X线显示胸腔积液;胸部CT示中度胸腔积液,左肺叶见多个直径1–4 mm的小圆形结节(图1)。

图1. 首次CT检查:左肺矢状面重建(A)及右肺中叶水平横断面图像(B)。主要发现为左肺叶圆形阴影(箭头)及右肺中叶多发实变伴空气支气管征(星号)和胸腔积液。非实变肺实质的衰减值为-850至-800 HU(正常肺组织参考范围:-846至-713 HU)。
转诊兽医对积液进行总蛋白、细胞学、LDH及细胞计数分析,判定为漏出液,但未找到胸腔漏出液及持续咳嗽的病因。转诊前曾接受多种药物治疗,包括抗生素(阿莫西林-克拉维酸、恩诺沙星、多西环素)、呋塞米、美洛昔康、抗组胺药及短程抗炎剂量地塞米松,均未见临床改善,具体剂量不详。
02 检查
呈轻度呼气性呼吸困难,体况评分4/9,双侧前部肺音增强,其余检查未见异常。入院后复查血常规及血生化:红细胞压积位于下限(37% [37–55]),总蛋白及白蛋白轻度下降(4.24g/dL [6.00–7.50];白蛋白2.29g/dL [2.58–4.73]),血尿素氮升高(48.5mg/dL [20–40])。C反应蛋白正常(0.8mg/dL [<35]),后续复查持续偏低。
粪便隐血试验阳性,结合用药史,考虑为胃肠道出血(可能与先前美洛昔康及地塞米松有关)。给予奥美拉唑(1mg/kg IV q12h)、硫糖铝(30mg/kg PO q8h)及马罗匹坦(1mg/kg IV q24h)治疗后,出血停止,5天内指标恢复正常。
肝功能检查及血清渗透压(302mOsm/kg [290–310])均正常。胸腔积液确认为纯漏出液,总蛋白0.5g/dL,无炎性细胞,细菌培养阴性。心脏超声未见异常。
心丝虫及血管圆线虫抗原ELISA阴性。粪便漂浮及Baermann-Wetzel法查肺虫亦阴性。凝血功能排除血栓状态。抗核抗体、血清蛋白电泳正常。利士曼原虫、犬埃立克体、伯氏疏螺旋体血清学结果均<1:20。尿液分析及尿蛋白/肌酐比正常。腹部超声仅见轻度胃肠炎征象。
首次CT后78天复查胸部CT,并行支气管镜及支气管肺泡灌洗,以及超声引导下肺细针抽吸。CT示原肺结节已消失,但右肺叶出现多发实变,仍伴胸腔积液(图2)。纤维支气管镜及右肺实变区支气管肺泡灌洗液和细针抽吸细胞学检查仅见大量肺泡巨噬细胞及极少量中性粒细胞,结果无明显异常。细菌培养及药敏试验检出极低浓度的多杀巴斯德菌,对阿莫西林敏感。胸腔积液及肺穿刺样本的PCR检测分枝杆菌、刚地弓形虫和真菌均为阴性。
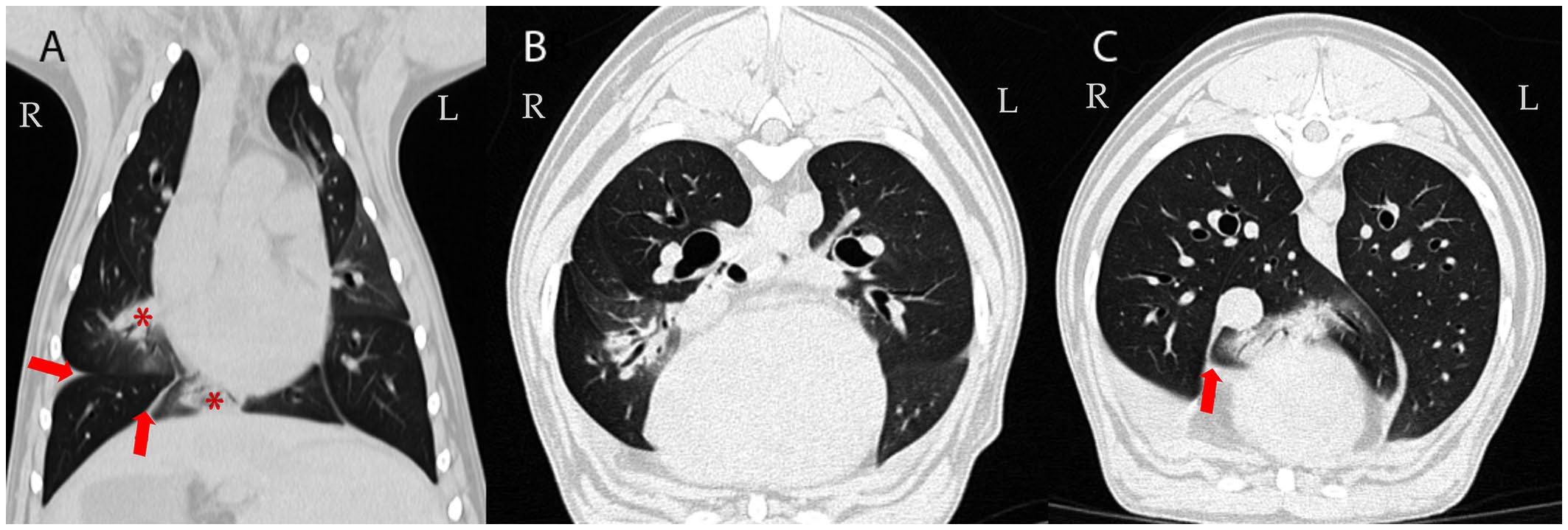
图2. 78天后复查CT:肺背侧(A)及横断面图像(BC)。右肺中叶及副叶仍见多发气道相关实变(A图星号)及胸腔积液(箭头)。非实变肺实质衰减值-850至-800 HU(正常肺组织参考范围:-846至-713 HU)。
排除上述所有潜在病因后,鉴别诊断考虑罕见间质性肺病,如环境与职业暴露(石棉肺、矽肺、外源性过敏性肺泡炎)、肺泡蛋白沉积症、寄生虫感染(卡氏肺孢子虫、中殖孔绦虫)、α-1抗胰蛋白酶缺乏症、脂质性肺炎、系统性炎性疾病(如狼疮或结节性多动脉炎),以及特发性间质性肺炎。
03 治疗
由于始终未能明确病因,且经多次胸腔穿刺仍反复出现胸腔积液,遂行肺及胸膜手术活检与组织病理学检查。
经右侧开胸,完整切除右肺中叶并切取壁层胸膜活检。选择右侧入胸是因为影像显示右胸病变最为显著,而右肺中叶既严重受累又最易手术操作。
大体可见,该肺叶呈过度膨胀区与萎陷区相间,膨胀区肺组织菲薄、脆弱,符合肺气肿与肺不张改变;其余肺叶、胸膜、心包、纵隔及区域淋巴结外观与触诊均未见异常。按标准术式行全叶切除,既确保获得足量组织供病理检查,也去除病变最严重之肺实质。为持续管理胸腔积液,于右侧第八肋间植入14F胸膜港。
肺及胸膜标本行常规石蜡切片,HE染色。镜下见广泛肺泡扩张、肺泡壁/间隔破坏致肺泡腔融合(肺气肿)(图3),与几乎完全萎陷之肺泡区域交替分布。肺泡萎陷考虑为胸腔积液压迫所致压缩性肺不张,其特征为肺泡壁紧密排列,残存裂隙状肺泡腔。肺气道、间质、脏层胸膜及血管内均无炎症。铁染色仅见少量含铁血黄素的肺泡巨噬细胞;PAS染色未检出病原体。

图3. 肺组织学图像示肺泡显著扩张、肺泡腔融合,符合肺气肿(箭头)。肺内无炎症。
除组织病理学检查外,还进行了组织细菌及真菌培养,以及分枝杆菌PCR检测,结果均为阴性。基于组织学所见,考虑α-1抗胰蛋白酶缺乏症(A1ATD)为肺气肿及持续胸腔积液的可能鉴别诊断。
采用文献所述夹心ELISA法对血清A1AT进行定量测定。连续两次检测显示,患犬血清A1AT浓度极低(<180 mg/L),与健康犬血清样本相比几乎无法测出,强烈提示A1ATD。为进一步确诊,在另一实验室采用免疫分析法复测,A1AT浓度仍低(13.6 mg/L [732-1802])。
术后3天患犬出院,给予支持治疗,并指导若持续出现呼吸困难可通过胸膜港引流积液,因目前犬尚无针对该病的病因治疗报道。
04 预后
于2周、4周、2个月、6个月及1年随访,咳嗽已消失,除持续胸腔积液外,患犬临床表现健康。经港引流最初需每两周一次,后减至每月一次。
05 讨论
α1-抗胰蛋白酶缺乏症(A1ATD)是一种由SERPINA1基因突变引起的罕见遗传性疾病,导致α1-抗胰蛋白酶(A1AT)合成减少或缺失。A1AT是一种主要由肝细胞产生的丝氨酸蛋白酶抑制剂,其主要功能是抑制中性粒细胞弹性蛋白酶,保护肺组织免受蛋白水解破坏。
A1ATD在人类中表现为早发性肺气肿、慢性阻塞性肺疾病或肝硬化,临床表现具有显著异质性。根据表型不同,可分为肺型、肝型或混合型。肺型患者常在年轻时出现呼吸困难、咳嗽及反复呼吸道感染,而肝型则表现为新生儿胆汁淤积或成人期肝硬化。
A1ATD的诊断依赖于血清A1AT水平检测、基因分型及组织病理学检查。尽管人类A1ATD已有较深入研究,但在兽医学领域,尤其是犬中,相关报道极为罕见,其发病机制、临床表现及治疗策略尚不明确。
本病例报道了一只3岁雄性混血犬,因持续性胸腔积液、慢性干咳及呼吸困难就诊。经过多次影像学检查、胸腔穿刺及实验室检测,最终通过肺组织病理学检查发现肺泡壁破坏、肺泡腔扩大,确诊为肺泡性肺气肿。
血清A1AT水平显著低于检测下限,结合组织学特征,确诊为A1ATD。这是首例犬类因A1ATD导致持续性胸腔积液及多肺叶肺泡性肺气肿的报道。
该病例在诊断过程中面临诸多挑战。首先,A1ATD在犬中极为罕见,临床医生对其认识不足,易误诊为感染性肺炎、肿瘤或过敏性肺病等。其次,常规影像学检查(如X线及CT)未能直接提示肺气肿,仅显示局灶性实变及胸腔积液,提示CT在识别早期或微小肺气肿方面存在局限性。最终,通过肺叶切除及组织病理学检查才明确诊断,说明组织学检查在确诊中的关键作用。
此外,该犬无肝病表现,血清肝功能指标正常,符合人类A1ATD中“肺型”表型。胸腔积液为漏出液,无明显炎症或感染迹象,推测其形成机制可能与A1AT缺乏导致的肺泡壁破坏、微血管通透性增加有关。尽管未发现明显炎症细胞浸润,但慢性蛋白溶解活性增强可能诱导局部毛细血管通透性升高,促使低蛋白液体渗入胸膜腔。
总之,本病例首次证实犬也可发生A1ATD,并可表现为持续性胸腔积液及肺泡性肺气肿,提示A1ATD应被纳入年轻犬只出现不明原因呼吸困难的鉴别诊断中。尽管目前尚无针对犬A1ATD的特异性治疗方案,但通过胸腔引流及对症支持治疗,可在一定程度上改善患犬生活质量。
未来应加强对犬A1ATD的研究,包括基因突变筛查、疾病模型建立及治疗策略探索,以提高对该病的认识和管理水平。同时,本病例也强调了组织病理学在疑难呼吸系统疾病诊断中的重要性,提醒临床兽医在面对持续性、难以解释的症状时,应考虑罕见遗传性疾病的可能性。
文献来源:Doulidis PG, Frizzo-Ramos C, Bertram CA, Grünzweil OM, Kneissl SM, Degasperi B, Hirt RA, Burgener IA, Luckschander-Zeller N. Case Report: α1-antitrypsin deficiency causing persistent pleural effusion and multilobar alveolar emphysema in a young dog. Front Vet Sci. 2025 Oct 28;12:1678702.