一般情况
| 品种 | 混种犬 |
| 年龄 | 11岁 |
| 性别 | 雌 |
| 是否绝育 | 未知 |
| 诊断 | 副神经节瘤 |
01 主诉及病史
因主人发现其饮水量增加就诊。
超声显示腹腔内有一来源不明的肿块,遂在另一家机构进行了CT。根据CT结果怀疑为胰腺肿瘤伴肝淋巴结转移,随后转诊。
02 检查
体重7.2 kg,患犬无任何症状(除了多饮),整体状态良好。
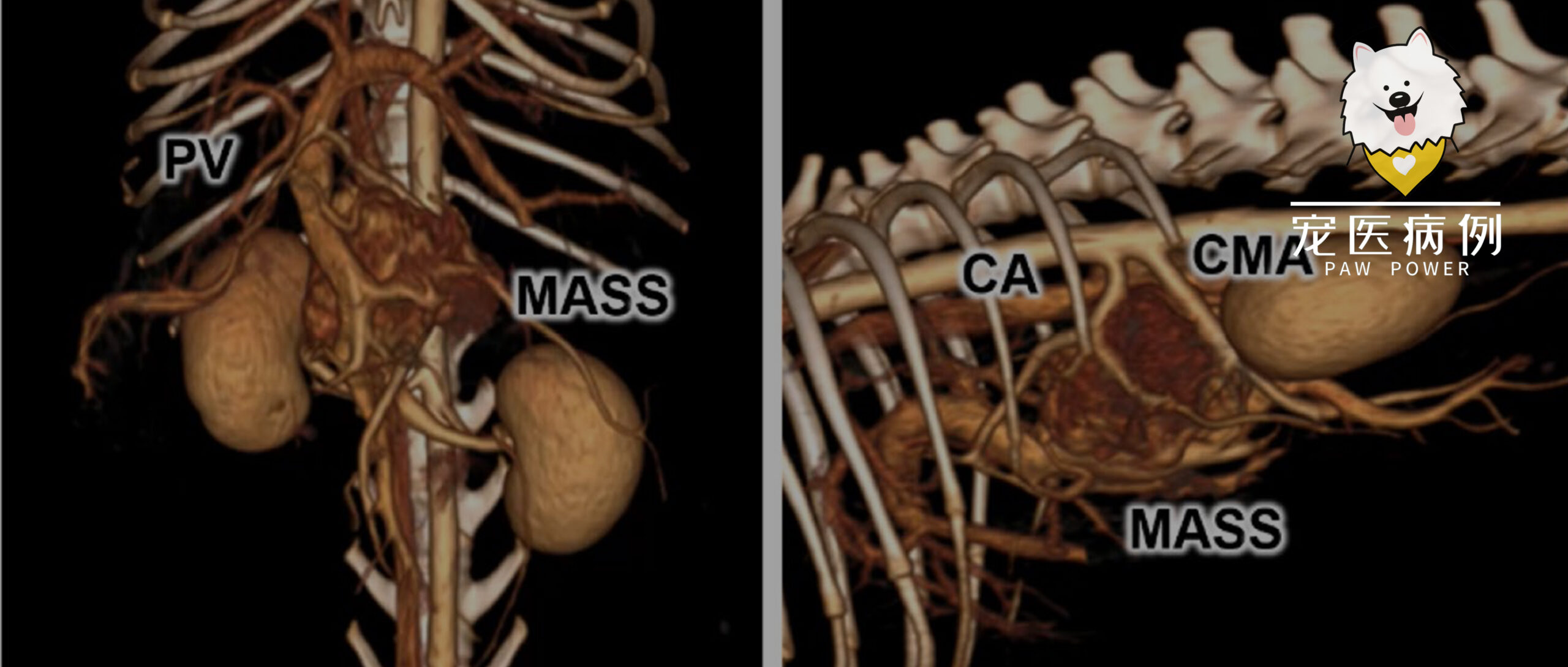
重新审阅了转诊兽医提供的CT图像(图1):肿块大小为38×27×35 mm,将门静脉向前腹侧推移,位于腹腔动脉、肠系膜上动脉与门静脉之间,动脉期明显强化。肿块与胰腺表面接触,但无胰腺实质浸润征象;肝淋巴结无肿大,增强模式正常,故判定无淋巴结转移;亦未见远处转移。肿块动脉期显著强化且位于中线大血管旁,初步诊断为腹膜后副神经节瘤,而非胰腺肿瘤。
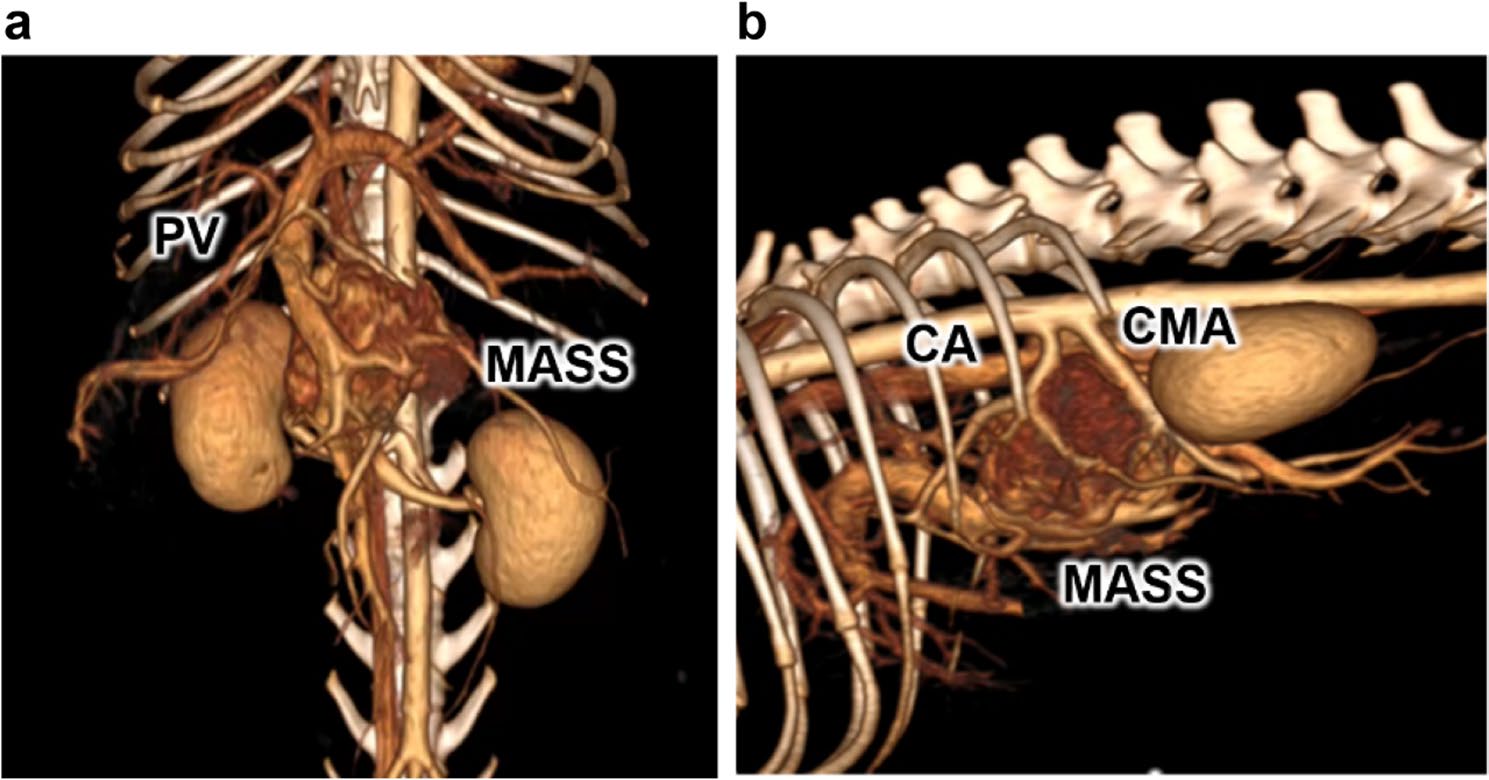
图1. CT扫描图像的三维重建:前面观(a)和右侧观(b)。CA:腹腔动脉;CMA:肠系膜前动脉;PV:门静脉。
03 治疗
因其位置特殊,手术切除风险极高。回顾性研究提示托西尼布对犬副神经节瘤可能有效。为缩小肿瘤体积,术前试用托西尼布(帕拉丁),剂量2.8 mg/kg,口服,每周一、三、五各一次。
第36天,超声显示肿块最大短径无明显变化,但患犬在给药后出现急性右前肢跛行,并逐渐加重;骨科与神经学检查未见异常,考虑为托西尼布相关不良反应,遂将剂量减至2.1 mg/kg,仍按周一、三、五给药,并密切监测。减量4天后跛行消失,继续以2.1 mg/kg维持,1个月后复查CT评估疗效。
第64天,动物整体状态依然良好,无任何临床症状。
尽管CT未见远处转移征象,但肿块体积明显增大(48×34×43 mm)。虽不能排除肿瘤生长与托西尼布减量至2.1 mg/kg有关,经与主人商议后仍决定施行手术,并停用托西尼布。
术后检测甲氧基肾上腺素组分,结果显示甲氧基肾上腺素/肌酐为106.3,去甲氧基肾上腺素/肌酐为251.6。由于内分泌检查是在托西尼布试验后而非初诊时进行,无法排除用药期间过度激素分泌被抑制,但检测结果提示该肿块为非功能性副神经节瘤。因此,术前未给予交感神经阻滞剂,直接进行手术。
第82天,行开腹肿瘤切除术。术前静注芬太尼5 µg/kg作为前驱麻醉;再静注丙泊酚10 mg/kg诱导。气管插管后,以异氟烷联合纯氧(0.5 L/min)和空气(0.5 L/min)机械通气维持麻醉。局部麻醉:在T8-9、T9-10、T10-11水平行椎旁神经阻滞,使用左布比卡因2 mg/kg。术中及术后镇痛:芬太尼5–20 µg/kg/h持续输注。术中心动过缓时静注阿托品;低血压时持续输注多巴胺5.0 µg/kg/min、去甲肾上腺素0.1–0.4 µg/kg/min及加压素1 IU/kg/min。抗生素:头孢唑啉20 mg/kg静注,每90–120 min重复一次至手术结束。
将动物仰卧保定后,采用“奔驰车”标志切口开腹;将包含胰腺的大网膜向头侧牵开,分离横结肠与十二指肠共有系膜,并把结肠向尾侧牵拉以显露肿瘤。肿瘤将门静脉主干向腹侧顶压,中心位于门静脉与胃脾静脉汇合处。胰腺左叶与肿块腹侧紧密粘连,分离困难,遂以3-0缝线结扎并切断通往胃、脾静脉的胰腺分支,再部分切除胰腺(图2)。
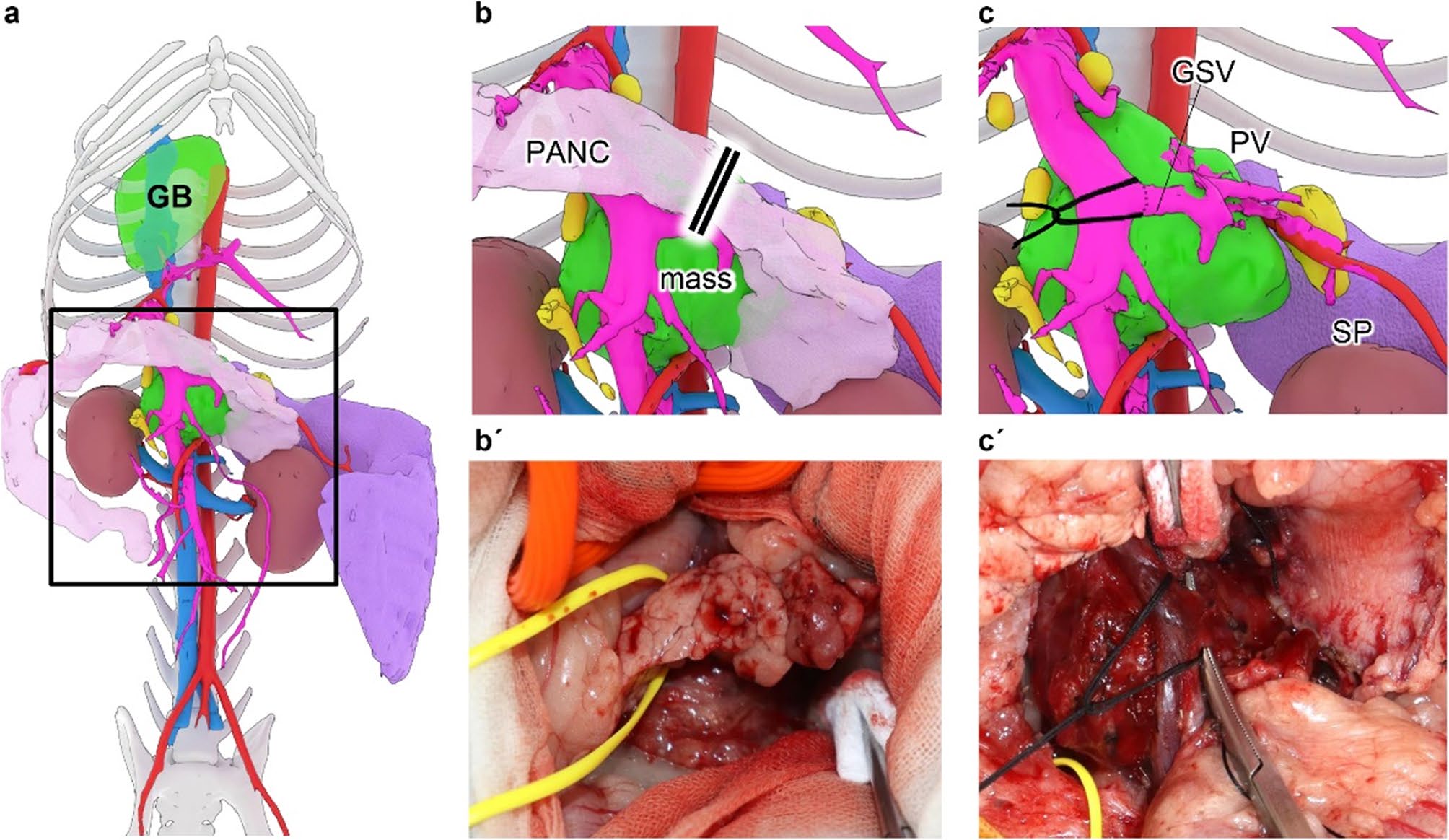
图2. CT图像三维重建。a. 腹部全景,显示肿块与周围脏器的相对位置。b. 胰腺左叶切断。b’. 与图2b对应的术中实拍照片。c. 汇入门静脉主干的胃脾静脉被结扎。c’. 与图2c对应的术中实拍照片。GSV:胃脾静脉;PV:门静脉;SP:脾脏;PANC:胰腺;GB:胆囊。
门静脉主干与肿块粘连,但从肿块头侧仔细分离,使其完整脱离肿块包膜,未受损伤。因左肝淋巴结位于肿块腹侧、邻近门静脉主干,其周围包膜结构予以保留。先整块结扎并切断流入、流出血管,随后肿块仍侧向附着继续操作。胃静脉与脾静脉在与门静脉主干汇合处与肿块粘连,遂结扎后切断。接着处理动脉系统:左胃动脉与脾动脉在瘤体内交织,无法保留,故在瘤体与胃之间近端切断左胃动脉;于腹腔动脉瘤侧基底选择性保留肝动脉,而脾动脉则与左胃动脉一并结扎切断(图3)。
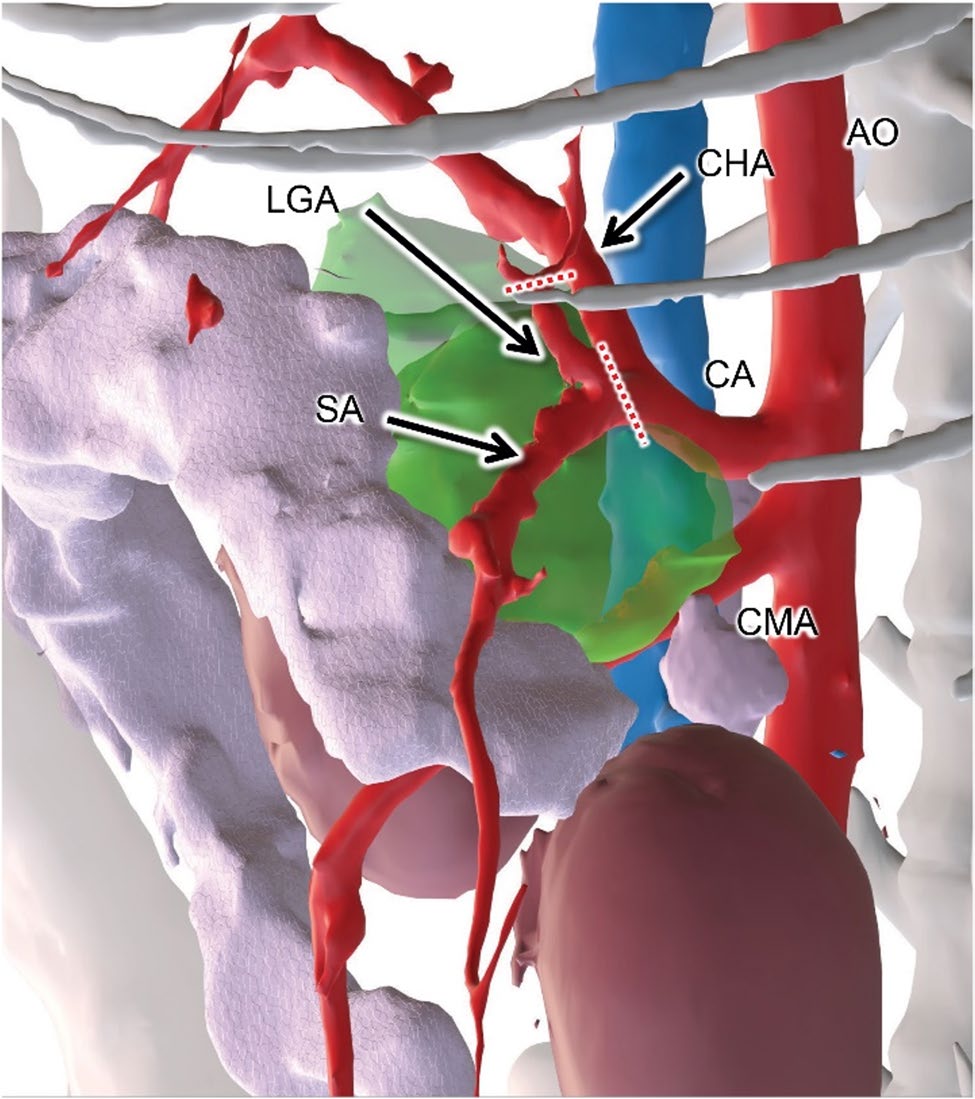
图3. 术前CT三维重建。AO:主动脉;CA:腹腔动脉;CHA:肝总动脉;CMA:肠系膜前动脉;LGA:胃左动脉;SA:脾动脉;红色虚线:结扎部位。
结扎并切断左胃动脉和脾动脉后,检查胃壁(图4)。胃壁出现缺血,动脉搏动减弱,静脉淤血。据此判断,若切断肝总动脉将导致胃缺血,且腹腔动脉能否保留亦不确定,遂保留肝总动脉,将肿块自腹腔动脉剥离,并连同网膜一并切除。
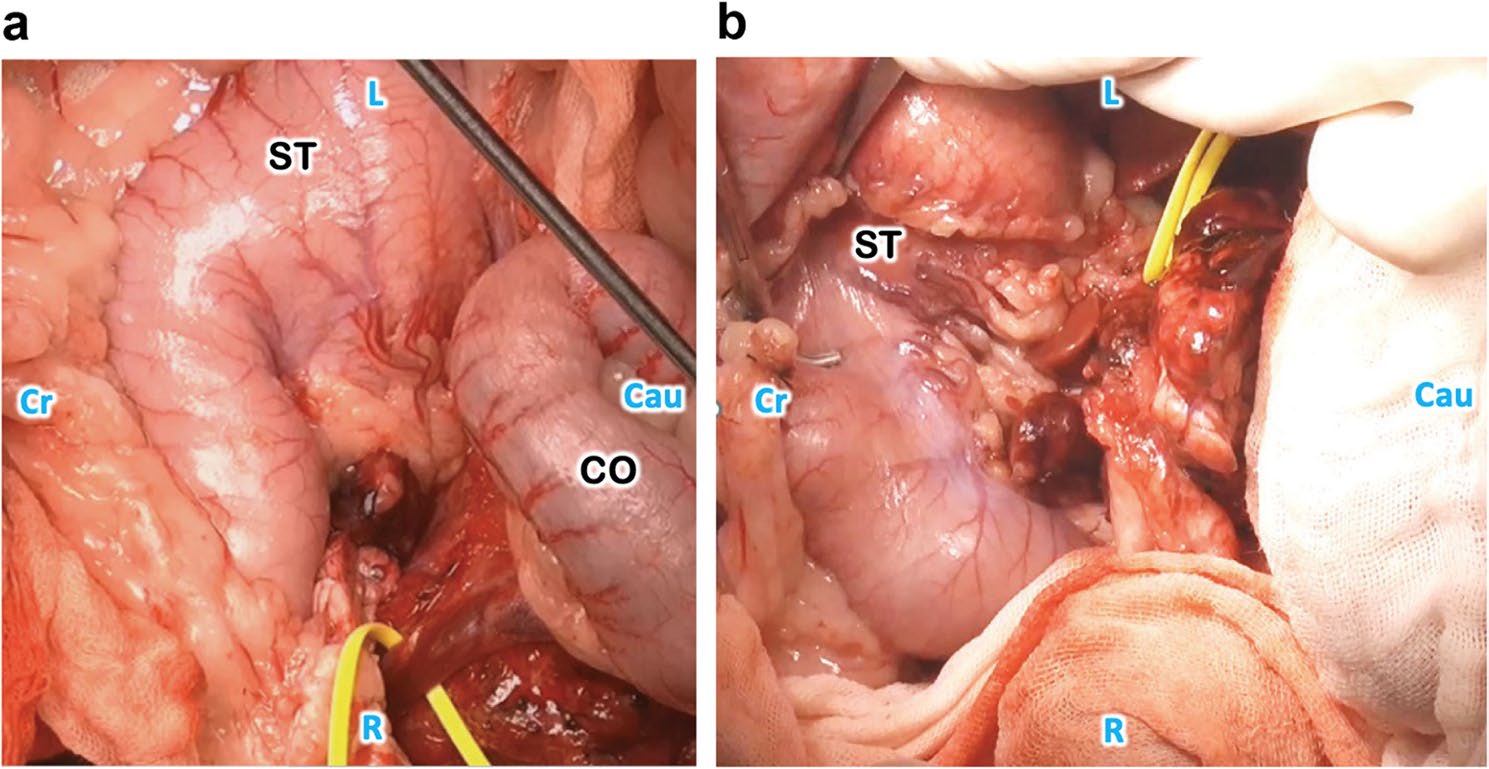
图4. 胃壁血流变化。a. 分离左胃动脉和左脾动脉前。b. 分离左胃动脉和左脾动脉后。CO:结肠,PV:门静脉,ST:胃。
待胃壁颜色恢复正常后,结扎并切断由腹腔动脉直接供瘤的血管,最终于门静脉与腹主动脉之间将肿块完整移除(图5)。
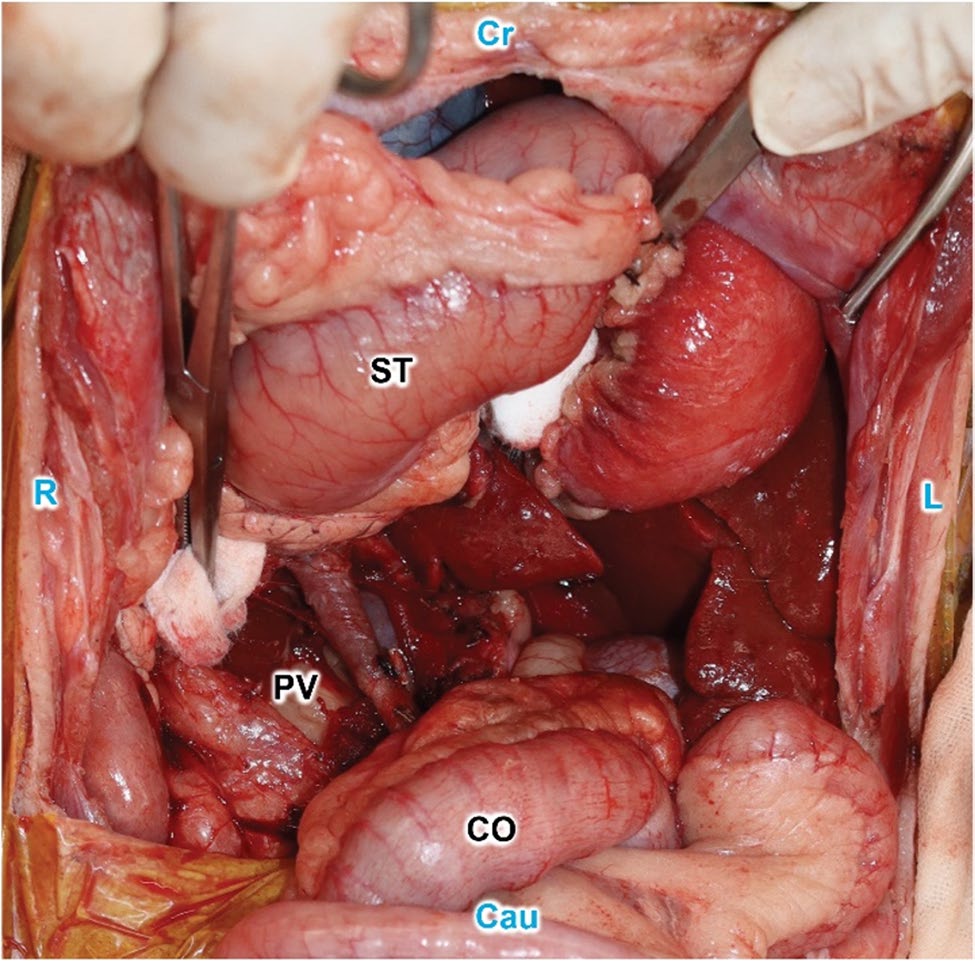
图5. 肿块切除后的腹腔大体观。CO:结肠,PV:门静脉,ST:胃。
肿瘤、胰腺左叶、脾脏及左肝淋巴结被整体切除(图6)。确认止血后,于近端空肠置入6 Fr饲管作为术后早期营养通道,并于腹腔放置闭式引流管。按常规关腹,手术结束。术中麻醉管理期间,因操作肿块未出现血压骤变或心律失常,故未使用交感神经阻滞剂及抗心律失常药物。
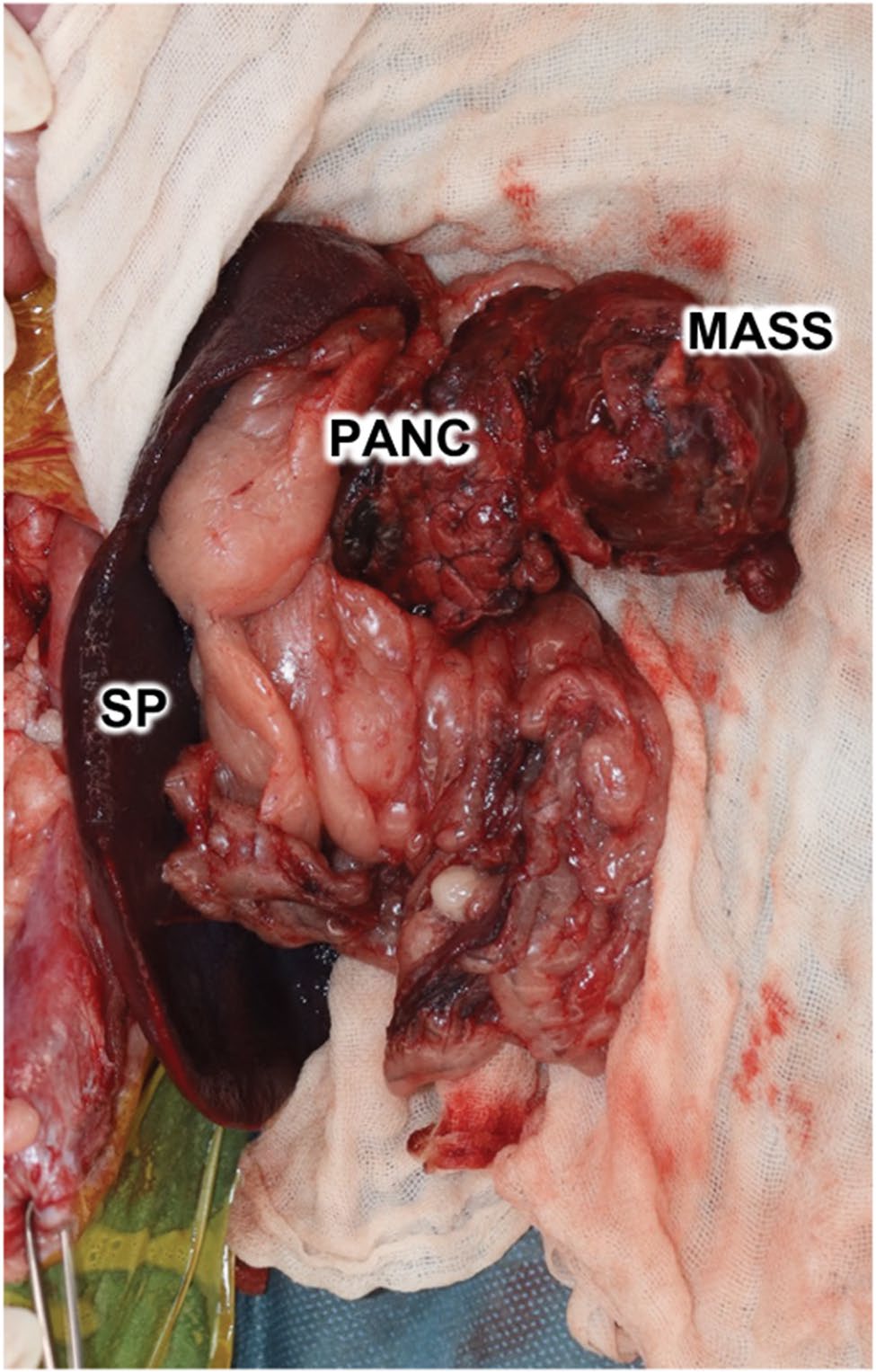
图6. 切除肿块的大体观。PANC:胰腺,SP:脾脏。
组织病理学检查证实为副神经节瘤。肿瘤被类似包膜的结构包裹,无包膜外浸润,切缘完整;脾脏及肝淋巴结亦未见转移灶。
04 预后
术后第1天,患犬清醒,生命体征平稳,但出现厌食;超声示胃内中等量积液。脂肪酶632 IU/L [10–160],肝酶ALT>1000 IU/L,提示急性胰腺炎。遂未予经口饲喂,改为经空肠管给予低脂流质食物。
术后第3天,胃排空改善,但仍轻度嗜睡;血小板降至144×10³/µL。超声发现自胃体至幽门处一混合回声团块压迫胃腔,内无血流信号。为明确性质,于无麻醉下行CT检查,评估保留的肝总动脉及门静脉血流、胃左区域侧支及有无肝脓肿等感染灶。CT示该压迫病灶与周围组织无连接、内部无血流,考虑为术后血肿;肝总动脉及门静脉血流良好,胃左动脉已通过肝动脉及右胃动脉与胃左区形成侧支循环(图7、8)。未见其他异常。脂肪酶仍高,但无胰腺炎临床表现。
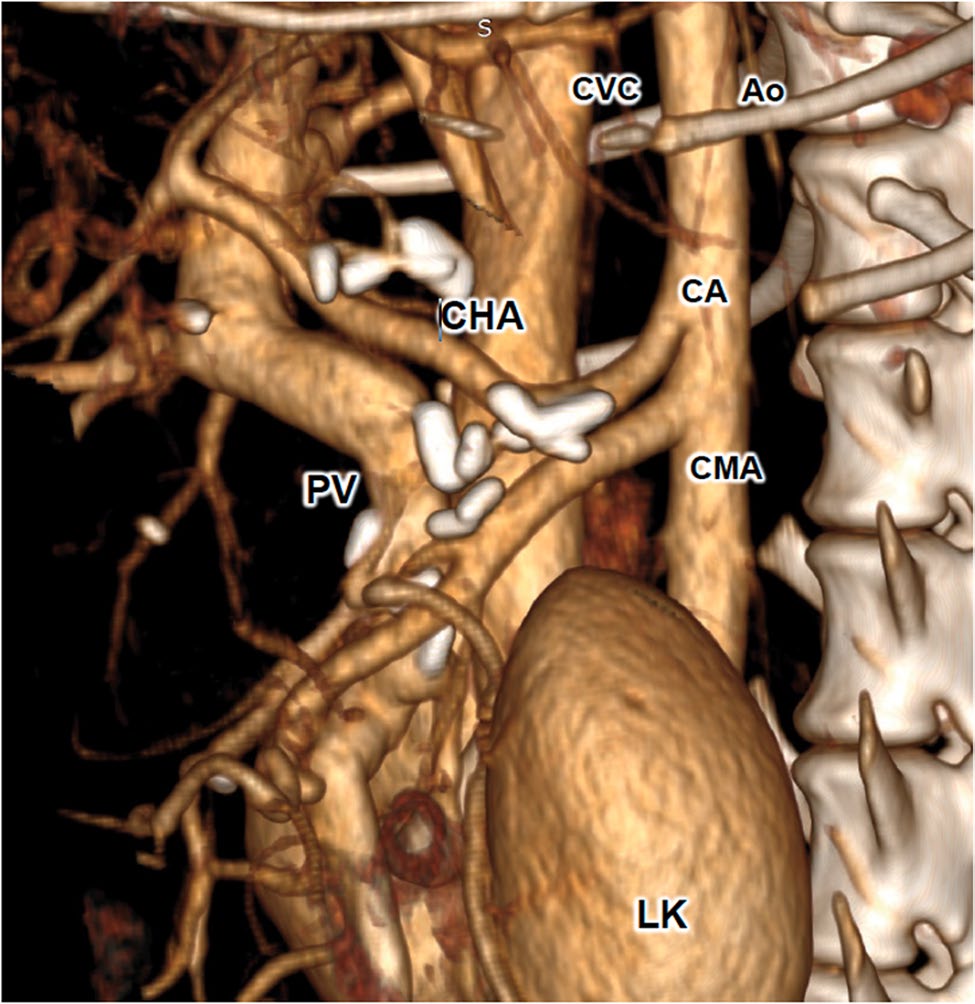
图7. 术后CT重建三维图像左侧观:腹腔动脉轴中,肝动脉得以选择性保留。AO:主动脉;CA:腹腔动脉;CHA:肝总动脉;CMA:肠系膜前动脉;LK:左肾;PV:门静脉;CVC:后腔静脉。
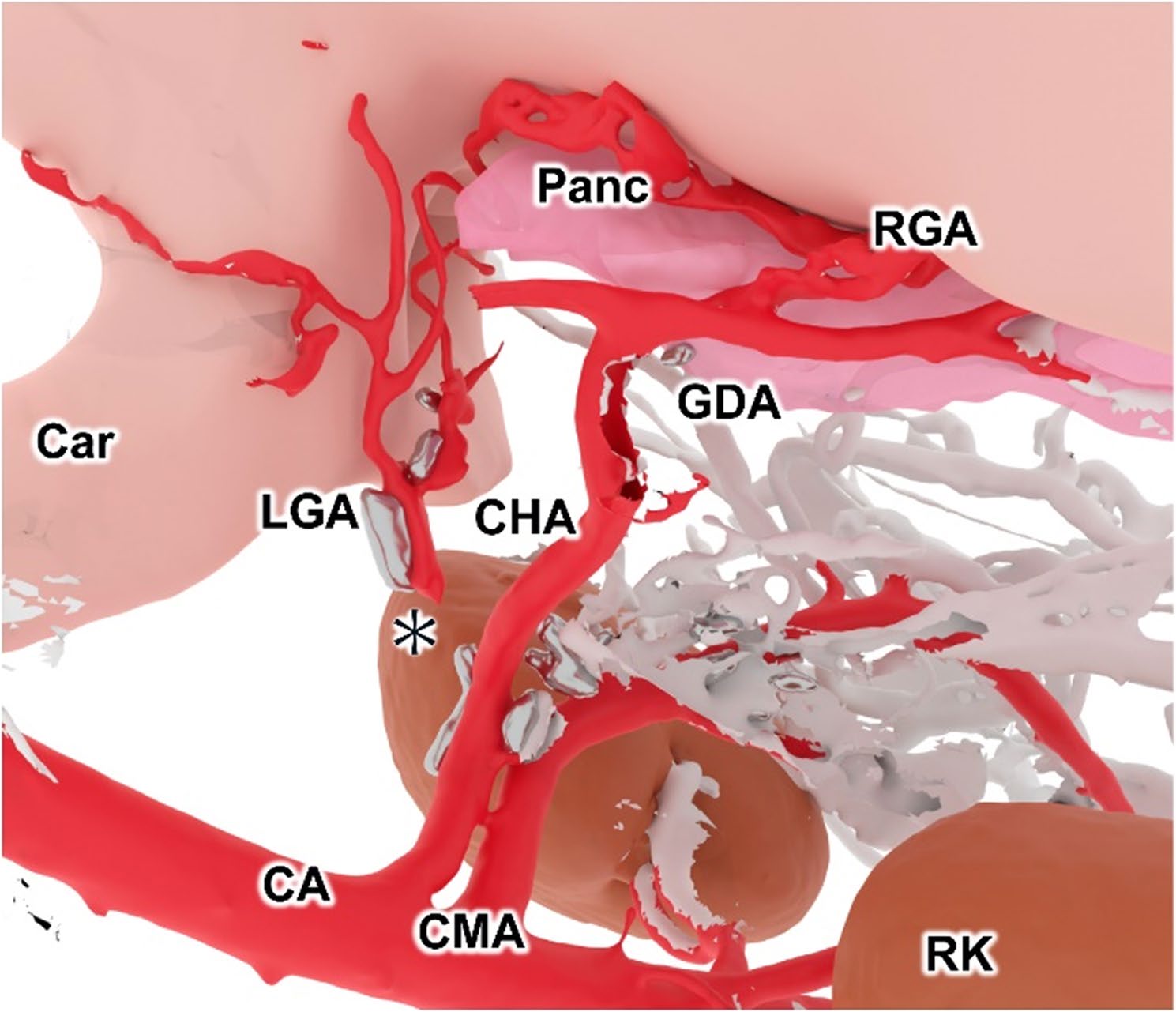
图8. 术后CT重建胃小弯侧三维图像。AO:主动脉;CA:腹腔动脉;Car:贲门;CHA:肝总动脉;CMA:肠系膜前动脉;GDA:胃十二指肠动脉;LGA:胃左动脉;RK:右肾;PANC:胰腺。
术后第7天,肝酶恢复正常。血肿逐渐缩小,食欲恢复,术后第27天出院。
术后第265天及第729天于本院CT检查均未见转移或复发,恢复良好。
05 讨论
副神经节瘤(PGL)是起源于神经嵴副神经节细胞的神经内分泌肿瘤,犬多发生在颈动脉体及主动脉体,腹膜后原发者罕见。与嗜铬细胞瘤不同,PGL可分泌或不分泌儿茶酚胺;本例术后尿分馏检测仅轻度升高,临床未见高血压或阵发性心动过速,属“非功能性”PGL。
该病对放化疗均不敏感,完整切除是获得长期存活的唯一手段。然而腹膜后PGL常包绕腹主动脉三大干支——腹腔动脉(CA)、肠系膜前动脉(CMA)及门静脉(PV),术中易引发大出血或术后脏器缺血,故外科报道极少,犬领域更缺安全共识。
患犬肿瘤位于CA分叉部,紧贴胰腺、PV及CMA,初诊医院误判为胰腺癌伴淋巴结转移。高分辨率CT及三维重建显示病灶沿主动脉生长、动脉期显著均质强化,符合PGL影像特征。
鉴于解剖风险,先尝试酪氨酸激酶抑制剂托西尼布进行新辅助“降期”,但剂量2.8 mg/kg 出现可逆性跛行,减量后肿瘤反增10 mm,提示药物控制效果有限,遂决定手术。
本例最大亮点是“选择性腹腔干切除”。术中发现脾动脉与胃左动脉(LGA)已被肿瘤包裹,无法骨骼化,而肝总动脉(CHA)可自瘤体分离。作者先试行阻断LGA,胃壁即刻缺血发绀;保留CHA并观察到胃色转红后,才离断LGA、脾动脉及胰腺体尾部,完成en-bloc切除。
术后第3天CT三维重建证实:胃左区血流经CHA→胃右动脉→胃小弯侧代偿,胃壁血肿实为静脉渗血形成的压迫性血块,1周内自行吸收。ALT及LIPA的短暂升高亦在7 d内复常,提示犬肝脏及胰腺对一过性低灌注具备良好代偿能力,与Keskitalo 等的“犬CMA侧支可在3 h内开放”之实验结果相符。
术后出现急性胃淤滞及胰酶升高,符合“缺血再灌注+胰腺部分切除”后胰腺炎-胃动力障碍模式。经空肠造口早期肠内营养、制酸及促动力治疗,27 d即出院。随访至术后729 d,CT未见复发或转移,证明非功能性、包膜完整的腹膜后PGL 可通过激进手术获得治愈。
人医对CA根部联合切除(Appleby 手术)已证实:只要CHA或胰十二指肠弓完整,胃可凭胰十二指肠及胃右动脉代偿。犬解剖类似,但缺乏量化数据。本例在术中实时评估胃壁颜色、术后CT血管成像,提供了犬代偿路径的直观证据,填补了空白。此外,人腹膜后PGL 转移率高达66%,而犬目前报道均未见转移,提示种属间生物学行为差异,亦需更多病例验证。
总之,本报告首次证实:
①在保留CHA 的前提下,犬可安全耐受LGA、脾动脉及胰腺体尾联合切除;
②术中直视+术后影像双重评估是保证胃、肝血供的关键;
③对化疗耐药、解剖高风险的非功能性腹膜后PGL,激进整块切除可获得长期无病存活。
未来应建立犬PGL的术前儿茶酚胺筛查规范,开展多中心随访,以进一步明确CA切除的指征与极限,并探索术前栓塞或腔镜技术在此类疑难病例中的应用价值。
文献来源:Takeuchi K, Hosoya K, Owaki R, Kinoshita R, Kim S, Okumura M. Successful surgical removal of a retroperitoneal paraganglioma in the celiac artery trifurcation in a dog. BMC Vet Res. 2025 Nov 7;21(1):651.