一般情况
| 品种 | 混种猫 |
| 年龄 | 4岁 |
| 性别 | 雌 |
| 是否绝育 | 是 |
| 诊断 | 腹腔淋巴结脓肿 |
01 主诉及病史
因厌食和嗜睡一周就诊。
未见呕吐或腹泻等胃肠道症状。既往无病史,也未使用过任何药物,包括糖皮质激素或免疫抑制剂。
02 检查
体重2.78 kg(体况评分2/5)。体格检查显示发热(40.0°C)及体重减轻。白细胞增多(29.4×10⁹ cells/L [5.5-19.5],表现为杆状中性粒细胞(4.3×10⁹ cells/L [0-0.7])、分叶中性粒细胞(19.1×10⁹ cells/L [2.5-12.5])和嗜酸性粒细胞(5.8×10⁹ cells/L [0-1.5])均升高。
血生化显示猫血清淀粉样蛋白A显著升高(71.8 μg/mL [0-6.8])。FIV和FeLV血液检测均为阴性。胸部X线未见明显异常。腹部超声发现肝区和膀胱附近有边界不清的低回声团块(图1A)。尿液分析未见异常,无细菌或真菌感染证据。
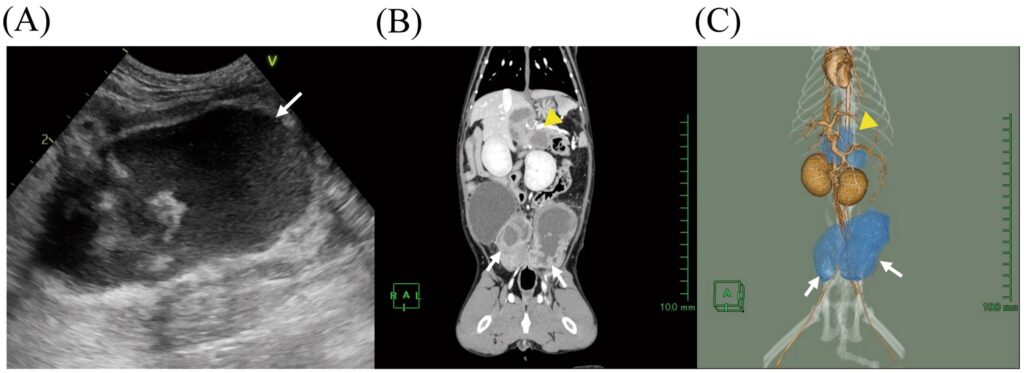
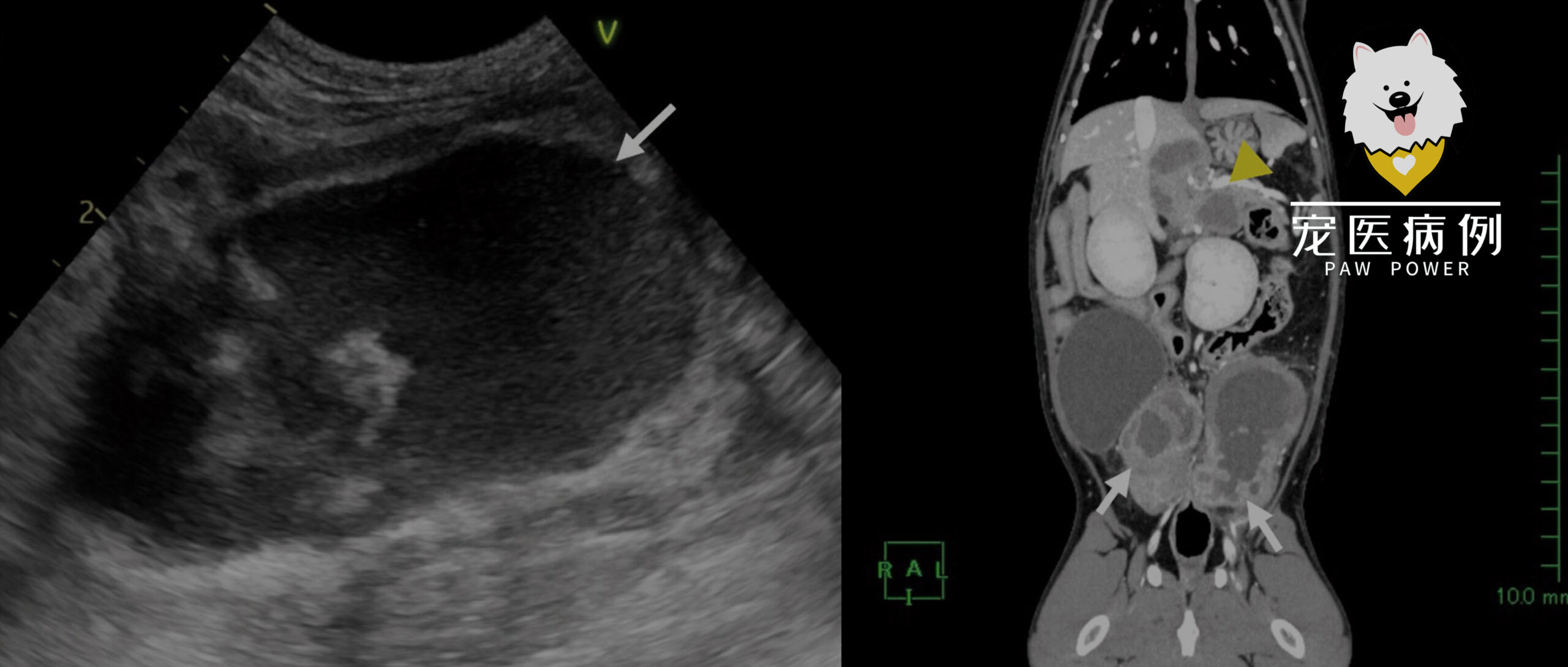
图1. 超声及增强CT影像。(A)第1天髂内淋巴结的腹部超声图像。(B)第2天增强冠状位CT图像及(C)三维CT重建。黄色箭头示肝淋巴结,白色箭头示髂内淋巴结。3D图像中淋巴结以蓝色显示。
为进一步评估腹腔肿块,第2天在全麻下行CT。CT显示左髂内淋巴结增大(35×36×58 mm),右髂内淋巴结(19×23×45 mm),右肝淋巴结(22×13×31 mm)及左肝淋巴结(15×12×18 mm)亦增大。这些淋巴结呈囊性结构,伴结节周围对比增强,中央区域可见异质性液体积聚(30-60 HU)(图1BC),导致降结肠狭窄并压迫左深旋髂动静脉。
在超声引导下行肿大髂内及肝淋巴结细针抽吸,抽出乳白色液体(图2A)。抽吸物细胞学检查见中性粒细胞及巨噬细胞浸润,未发现肿瘤细胞;革兰染色可见革兰阳性球菌(图2B)。据此,肿大髂内及肝淋巴结被诊断为脓肿。
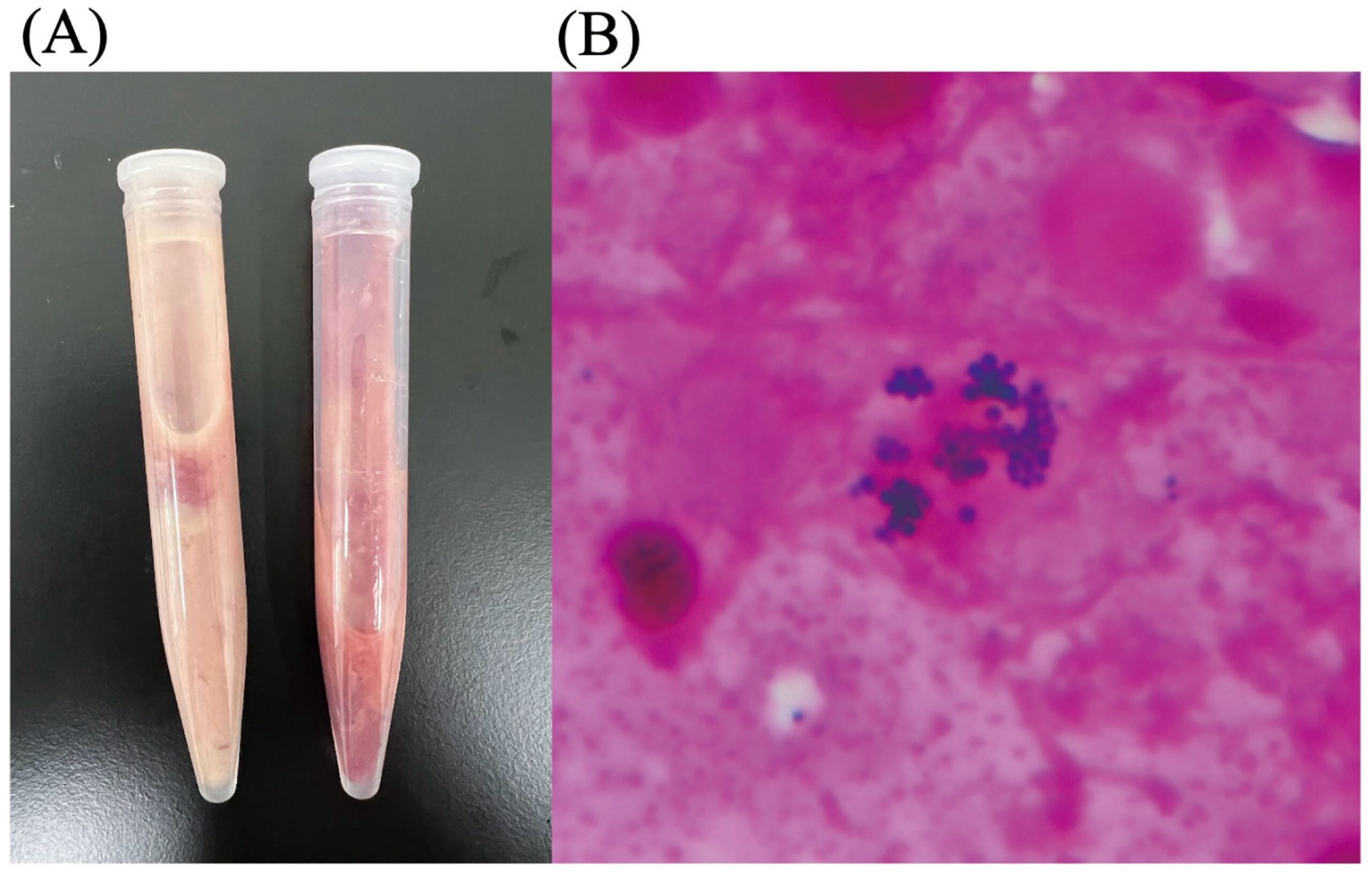
图2. 腹腔淋巴结脓肿穿刺液及革兰染色结果。(A)自腹腔淋巴结脓肿抽出的乳白色液体。(B)穿刺液革兰染色涂片可见革兰阳性球菌。
髂内及肝淋巴结穿刺样本送交细菌培养、菌种鉴定及药敏试验。此外,为探究髂内淋巴结脓肿的病因,行结肠镜检查,但结肠黏膜组织病理学未见异常。
03 治疗
自第2天起住院并接受治疗至第8天。依据腹腔淋巴结脓肿的革兰染色结果,在细菌培养及药敏试验结果回报前,先给予经验性抗生素治疗:静脉注射头孢唑啉30 mg/kg,每日两次。然而,该治疗未能退热,超声亦未见腹腔淋巴结缩小。
第6天,髂内及肝淋巴结培养及菌种鉴定结果为金黄色葡萄球菌。结合药敏试验结果及对头孢唑啉反应不佳,于第6天起改用阿莫西林:静脉注射20 mg/kg,每日两次。
第8天,阿莫西林治疗使体温降至38.4°C,嗜睡及厌食改善,遂出院。同日开始口服阿莫西林20 mg/kg,每日两次。
04 预后
第20天,自开始阿莫西林治疗后状态良好;腹部超声示肝及髂内淋巴结体积缩小。白细胞总数降至10.8×10⁹ cells/L,杆状中性粒细胞0×10⁹ cells/L,分叶中性粒细胞3.5×10⁹ cells/L,嗜酸性粒细胞2.1×10⁹ cells/L;猫血清淀粉样蛋白A亦恢复至参考区间内(<3.0 μg/mL)。
第90天,全麻下复查CT,腹腔淋巴结进一步缩小:左髂内淋巴结10×12×14 mm,右髂内淋巴结8×7×6 mm,右肝淋巴结7×6×10 mm,左肝淋巴结12×12×10 mm(图3AB)。因淋巴结内仍见液体潴留,继续阿莫西林治疗。
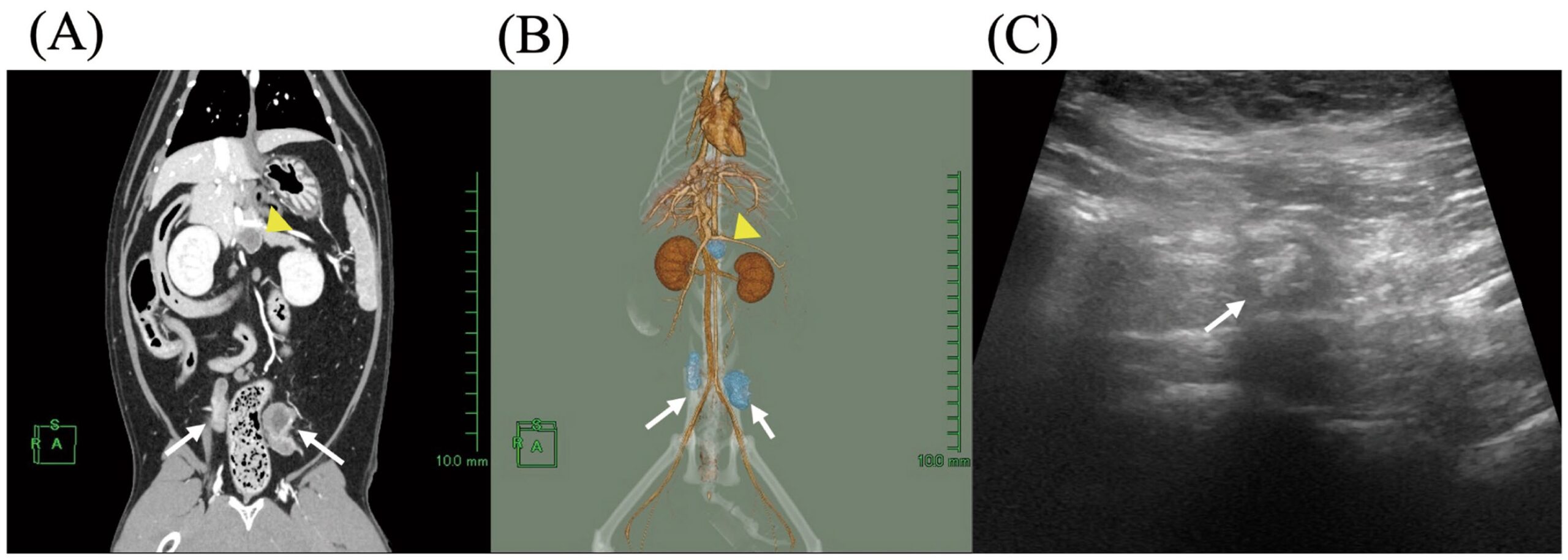
图3. 抗生素治疗期间腹腔淋巴结脓肿的随访影像。(A)第90天增强冠状位CT图像;(B)三维CT重建;(C)第132天髂内淋巴结腹部超声图像。黄色箭头示肝淋巴结,白色箭头示髂内淋巴结;3D图像中淋巴结以蓝色显示。
第132天,淋巴结体积进一步缩小,已无液体积聚(图3C)。阿莫西林持续使用至第182天以防复发;此后停药。
第689天,猫状态良好,无临床症状及复发;超声未见淋巴结肿大,腹腔淋巴结脓肿已完全消退。
05 讨论
猫腹腔内淋巴结脓肿(LA)在临床极少见,既往仅有个案报告,且病灶多局限于肠系膜淋巴结,病原主要为大肠杆菌或单核细胞增生李斯特菌。
本病例首次证实金黄色葡萄球菌亦可引起猫多发腹腔淋巴结脓肿,并累及髂内、肝门两组淋巴结,提示该病原的致病谱及毒力被低估。
金黄色葡萄球菌为猫皮肤、口腔、鼻腔常见共生菌,可通过血行、淋巴或破损黏膜进入腹腔;一旦宿主免疫屏障受损,即可形成化脓灶。猫腹腔深部淋巴结缺乏特异的“引流-感染”对应关系,感染途径常隐匿,本例结肠镜未见异常,进一步支持血源播散可能。
患猫以高热、厌食、体重下降为主要表现,实验室突出表现为中性粒细胞带状核增多、嗜酸粒细胞增高及血清淀粉样蛋白A(f-SAA)显著升高。中性粒细胞左移与f-SAA共同提示急性细菌感染;嗜酸粒细胞同步升高在猫腹腔感染中罕见,但在金黄色葡萄球菌相关嗜酸性硬化性纤维增生中已有报道,推测细菌超抗原或毒素可激活Th2通路,介导嗜酸粒细胞趋化。经阿莫西林治疗后,嗜酸粒细胞与病灶同步好转,进一步支持其继发性。
腹部超声首诊发现“囊性低回声团”,CT证实为淋巴结中央液化、周围环状强化,伴降结肠及髂血管受压。鉴于病灶深在且多发,手术风险高,团队选择超声引导细针穿刺获取脓液,既明确脓肿性质,又通过革兰染色快速发现革兰阳性球菌,为后续靶向用药赢得时间。值得注意的是,穿刺前剃毛、消毒,尽量降低皮肤污染;培养结果仅分离到单一金黄色葡萄球菌,且对阿莫西林高度敏感(抑菌圈40 mm),皮肤常见污染菌未检出,可基本排除污染。
初始经验性头孢唑啉无效,提示社区获得性耐甲氧西林菌株或β-内酰胺酶产生可能;根据药敏结果及时切换阿莫西林后,体温、食欲、炎症指标迅速改善。鉴于病灶为多发、不可切除的深部脓肿,作者参照犬腹腔淋巴结脓肿经验,采用“长疗程、高剂量”策略:静脉→口服序贯,总疗程6个月。
随访CT及超声显示淋巴结逐渐缩小、液化消失,停药后689天无复发,证实该方案在猫亦安全有效。长疗程的理论依据为:淋巴结血供相对较差,脓肿壁纤维屏障可阻碍药物渗透,短期用药易导致残留病灶与复发。
总之,本病例首次证实金黄色葡萄球菌可致猫多发腹腔淋巴结脓肿,且对阿莫西林敏感。临床遇到不明原因高热、嗜酸粒细胞增高及腹腔囊性淋巴结病变时,应将金黄色葡萄球菌纳入鉴别诊断。深部、不可切除的淋巴结脓肿需依据药敏结果选择敏感药物,并足量长程应用;影像引导穿刺既是诊断关键,也可替代手术引流。本例治疗成功为今后类似病例提供了循证依据,也提醒临床医师重视“共生菌”在特定条件下的致病潜能。
文献来源:Tamura K, Kushida K, Iwanaga T, Fukushima R, Ohmori K. Case Report: Multiple intra-abdominal lymph node abscesses due to Staphylococcus aureus in a cat. Front Vet Sci. 2025 Nov 17;12:1654990.