
01 血型
血型反映红细胞膜上遗传性细胞表面抗原的表达。犬已发现多种不同抗原,而特定抗原在受血者体内引发免疫反应的能力(即免疫原性)各不相同。本文不逐一详述所有已知血型。
犬最重要的血型系统为犬红细胞抗原(DEA)系统,其中最具免疫原性的抗原为DEA 1。DEA 1曾进一步分为DEA 1.1、1.2、1.3亚型,但现已明确,DEA 1系统表现为抗原表达从阴性到阳性的连续谱,而非不同抗原的独立表达。犬可能为DEA 1阴性(不表达DEA 1抗原)、DEA 1弱阳性(表达量低)或DEA 1强阳性(表达量高)。
全球范围内,DEA 1阳性犬普遍多于DEA 1阴性犬,但比例因品种和地域差异显著。犬通常不天然存在DEA 1同种抗体;若DEA 1阴性犬输入DEA 1阳性红细胞,受血者将在4~7天(或更短)内产生抗DEA 1抗体。这些抗体可致输注红细胞过早破坏,并使致敏的阴性犬在未来再次接受阳性血时发生溶血性输血反应。
因此,DEA 1阴性犬应优先输注DEA 1阴性红细胞。DEA 1阳性犬可接受DEA 1阴性或阳性红细胞,因其不会产生抗DEA 1抗体。DEA 1阴性红细胞适用于所有未输过血的犬,但该血源有限,应仅留给阴性受血者,除非绝对紧急。
建议在所有受血犬输注红细胞前,无论其输血史如何,均进行DEA 1血型鉴定及供-受者配型。除DEA 1外,部分血型在犬中极为常见,例如DEA 4,其表达于98–100%的犬红细胞膜上。
若罕见的DEA 4阴性犬输入红细胞,有98%的概率会接触到DEA 4阳性血,从而致敏产生抗DEA 4抗体;这不仅可导致输注红细胞提前破坏,还会使未来寻找相容血液极为困难。
同理,大多数犬呈Dal抗原阳性,但某些个体(尤其斑点犬、杜宾、西施和拉萨犬)缺乏该抗原。Dal阴性犬若输入Dal阳性血,同样可致输注红细胞早期破坏,并影响后续输血相容性。英国近期已可检测DEA 4与Dal血型,但目前尚无充分理由在非高风险品种中常规开展。
所采集的犬血浆不应含有临床意义的抗红细胞抗体,因为供血犬均为未输血个体且天然同种抗体罕见,故犬血浆输注前无需血型匹配。请注意,猫血浆中存在天然同种抗体,因此猫供血者与受血者在输注血浆前应进行血型配对。血小板输注是否需血型匹配尚存争议。英国宠物血库目前建议进行配对。单一血小板单位可能来自多个供体,且在制备过程中红细胞污染程度略高于其他血浆制品。鉴于尚无共识,作者建议在输注血小板前进行血型匹配。
02 交叉配血
尽管DEA 1是犬最公认的血型,红细胞上仍存在许多其他抗原;受血犬输血后可能对这些抗原产生不同程度的致敏,抗体生成时间不一(1~7天)。若日后输注不相合血液,即使DEA 1相容,也可能引发输血反应。因此,既往接受过红细胞输注的犬,再次输红细胞前必须进行交叉配血。
目前建议:只要受血犬在4~7天前曾输过红细胞,每次后续输血均需交叉配血,且终生如此。
主侧交叉配血将受血犬血浆与供血犬红细胞混合,检测是否出现凝集;次侧交叉配血则将受血犬红细胞与供血犬血浆混合。若主侧出现凝集反应,则禁止使用该供血犬红细胞,以免发生严重输血反应。
若次侧交叉配血出现反应,最好另选一个在主侧和次侧均相容的血液单位,但次侧不相容通常不会引发明显反应;事实上,许多次侧不相容可能是假性结果(如患犬自身凝集)。
目前有多种交叉配血方法,可靠性不一,操作者的经验也影响结果判读。条件允许时,建议送外部实验室进行交叉配血;院内仅用于紧急情况。
据作者所知,尚未有首次输血(包括DEA 1不合)的未输血犬在当时发生急性溶血性输血反应的确证病例。尽管实验室证据表明,未输血受血犬与潜在供血犬之间可能存在免疫不相容,兽医血液学与输血医学会输血反应小动物共识声明(TRACS)目前并不推荐对未输血受血者进行交叉配血。对于曾接受过红细胞、血小板或血浆的患者,在输注血浆或血小板时通常无需交叉配血(即无需将供血单位中的红细胞与受血者血浆进行主侧匹配)。该领域证据不足,无法给出明确建议,作者目前在上述情况下亦不进行交叉配血。
03 输血前考虑
与某些药物给药类似,血液制品可干扰实验室检测,因此除非危及生命,输注前必须采集相关样本。只要临床允许,建议完成血型鉴定、血常规(含新鲜血涂片,必要时做盐水凝集试验和Coombs试验)及生化全套(含肾功能、肝酶、白蛋白、球蛋白和胆红素)。
输注血小板或血浆时,还需基线凝血检查(血小板计数、凝血酶原时间PT、活化部分凝血活酶时间APTT),血小板输注另需血型。除血型及必要凝血项目外,只要已留样,无需等待全部检测结果即可输血。若时间允许,应尽可能完成额外基础检查,以评估个体动物的预后;例如,若犬患有出血性血管肉瘤且已广泛转移,其预后极差、长期存活率极低,此时是否输血需慎重考虑。此类情况易引发伦理困境,必须与宠主充分沟通并做好记录。
04 供血犬标准
英国政府已对用于血库储存的供血犬设定强制标准;该标准不适用于诊所内即时采血,而此类即时采血在临床中十分常见。表1列明了英国供血犬的具体要求。
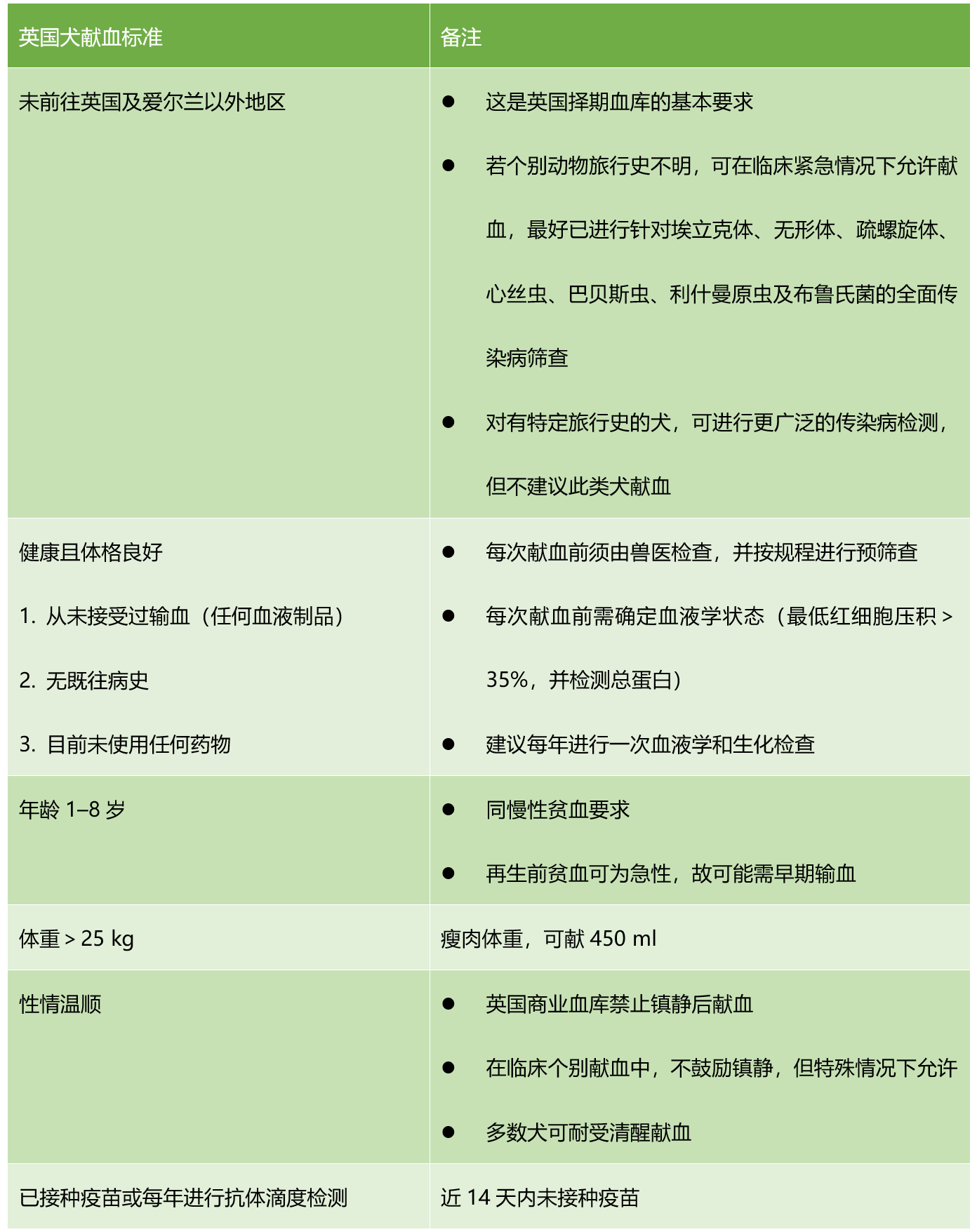
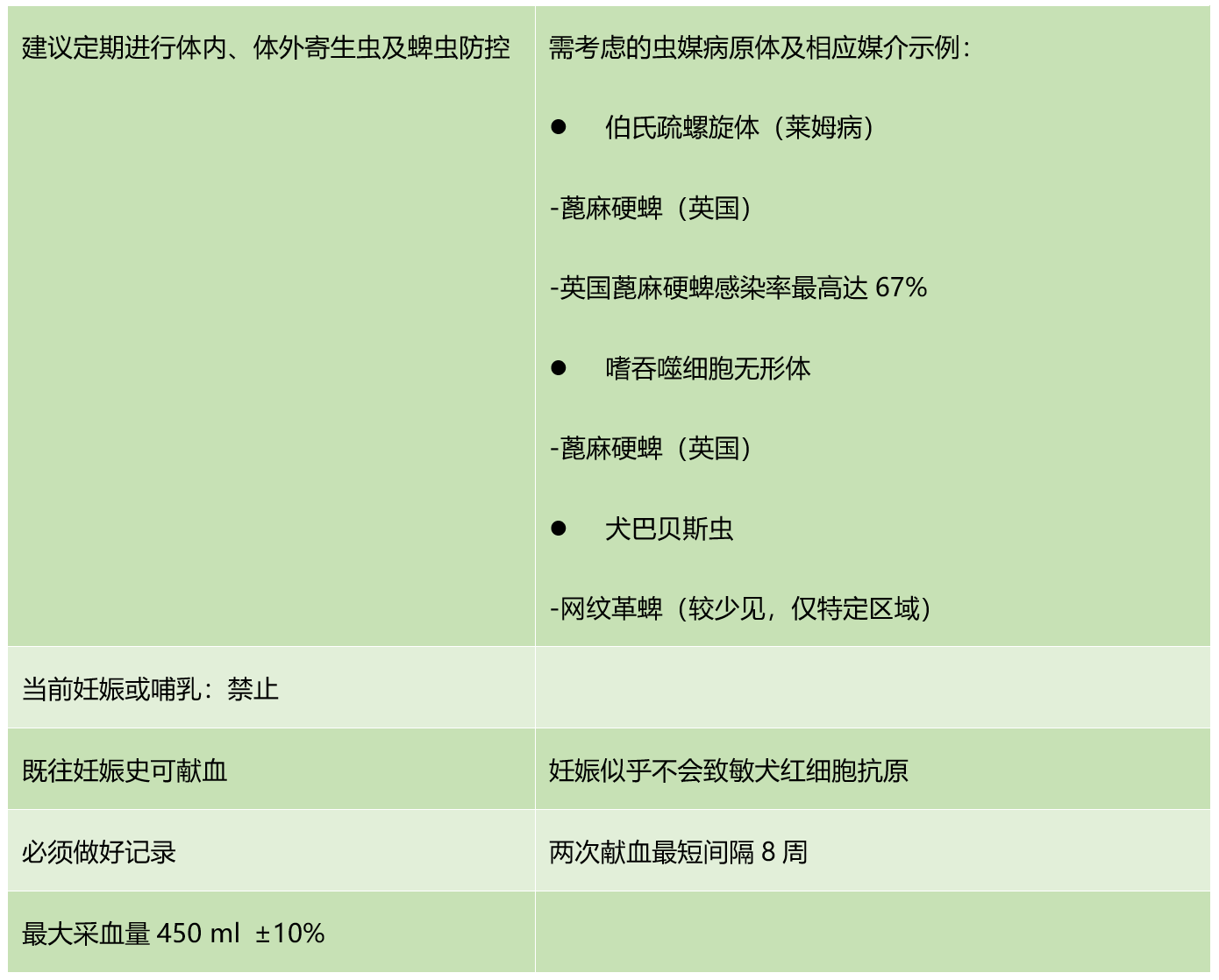
表1:英国犬献血标准。
05 采血操作
如第一部分所述,使用商品化犬血单位通常是最高效、最实用的输血方式。但在某些特定情况下,诊所需自行采血,例如需要全血或无法及时从商业血库获得血液时。框1和框2总结了在诊所环境内采血的要点。
框1:供血犬采血所需设备
■ 理想4人:2人固定供犬,1人采血,1人管理采血袋
■ 电剪、稀释洗必泰、酒精棉
■ 局部麻醉霜或喷雾
■ 含相应抗凝剂的采血袋(250 ml或450 ml)
■ 或含适量抗凝剂的注射器(如为小型受血犬采少量血,可用枸橼酸磷酸葡萄糖腺苷)
■ 敷料与剪刀
■ 体重秤
框2:供血犬采血操作流程
■ 在颈静脉区域大面积剃毛并涂局部麻醉霜/喷雾,等待约45分钟
■ 按当地说明准备采血袋
■ 称量采血袋并去皮归零
■ 让供血犬侧卧于桌面软垫,轻柔保定
■ 戴手套,对相应颈静脉进行外科消毒
■ 助手抬高颈静脉,另一助手将血袋置于患犬下方
■ 将针头刺入颈静脉
■ 松开血袋管夹——血液开始流入
■ 助手定期轻摇血袋,使抗凝剂与血液充分混合
■ 血袋快满时,称重至250 ml(263 g)或450 ml(477 g),视袋规格而定;允许±10%容量偏差,以防枸橼酸中毒或体外凝血(即225–275 ml [237–289 g] 或405–475 ml [429–500 g])
■ 夹闭管路,助手停止抬颈静脉
■ 缓慢拔针,无菌棉按压1–2分钟;必要时加轻颈绷带
■ 标签注明供体ID(或名字)、采集日期时间、采血员及血型
■ 室温保存,若需保留部分血小板活性,应在4–6 h内使用
■ 若采用无菌密闭系统采集,可2–6 °C冷藏保存35天,但血小板及止血功能会降低
■ 输注期间非必要不给药,以便区分药物反应与输血反应;必须用药时勿断开血液管路,应另建静脉通路■ 输注期间不喂食,减少呕吐/腹泻风险,避免误判为输血反应
06 血液制品输注流程
1. 准备
■ 输血前务必完成受血犬所有相关血样采集。
■ 全程戴手套,操作血液制品时保持无菌技术。
■ 血浆应在33–37°C水浴中解冻20–30 min;血袋须装入保护性塑料袋后置于水浴,温度>37°C可致蛋白变性。
■ 无水浴时可用干热法(如夹于腋下);禁止微波,防止过热。
■ 浓缩红细胞(pRBC)无需主动加温;加温可增加溶血并促进细菌繁殖。
■ 对于小型犬、麻醉或低体温患犬,避免输注冷藏红细胞;应先在室温下回温。
■ 所有血液制品须经带滤器的输血器或注射器+延长管输注;若使用haemonate滤器,每输注50 ml血液制品必须更换一次滤器。
■ 使用输血器时,切勿挤压滴壶。
■ 若使用T型接头,尽可能移除无针注射端口,以降低红细胞通过时受损的风险。
■ 输血前最好带患犬散步,让其排尿/排便,因输血过程中不应断开血液管路。
■ 浓缩红细胞单位和已解冻血浆单位可分装,以便一单位用于多名患犬,或让同一患犬缓慢输注(见框3)。
框3:分装浓缩红细胞或解冻血浆
血液制品分装指南
所需设备
■ 输液架
■ 1单位犬pRBC或已解冻血浆
■ 检查手套、酒精棉片
■ 1个专用于血袋的无针穿刺接头
■ 无菌注射器(最好螺口锁):每次抽取换用新注射器
■ 标签
准备pRBC/解冻血浆单位
■ 为受血者选择最合适的血单位
■ 洗手并戴手套
■ 轻摇血袋,使成分均匀
■ 将血袋挂于输液架
■ 撕下血袋端口之一的小盖,保持无菌
■ 无菌取出穿刺接头(关闭通气帽),插入血袋端口
抽取血液制品
■ 从无菌包装取出注射器;建议用20 ml注射器,50 ml不易操作且负压过大
■ 取下无针阀保护帽,置于无菌包装内备用
■ 注射器连接无针阀
■ 缓慢轻柔抽吸所需量,避免过大负压
■ 仅抽取所需量,余量留袋
■ 注射器加无菌堵头并贴标签
■ 可多次抽取,每次均换无菌注射器
■ 每次抽后,用酒精棉消毒血袋阀口
■ 抽毕,将保护帽盖回无针阀
储存
■ 注射器标签注明:日期、时间、品名、姓名缩写、有效期、编号、犬红细胞抗原状态
■ 分装后注射器应在4–5小时内使用;注射器不能储血,因气体可交换。已开口血袋可2–6 °C血库保存,≤24小时
■ 从冰箱取出后,每支注射器或已开口血袋(pRBC或解冻血浆)须4小时内用完
■ 检查污染征象:过多气泡、凝块、纤维蛋白丝、深紫至黑色变色;血浆呈灰色亦属异常,异常即弃。
例如:供多个受血者使用,或单次输注预计超过4小时而需延长给药时间
2. 输注
■ 尽量使用新置或未满24 h的静脉导管。
■ 禁止与含钙液体(如哈特曼液)同路输注。
■ 蠕动泵可增加红细胞溶血风险;需使用经厂家确认适用于红细胞的专用输液泵。无合适泵时,严密监测下可用重力滴注。
■ 小型犬禁用重力滴注,以防过快输注和循环超负荷;应使用注射器驱动器。
■ 延长管须用血液制品预冲。
■ 体重<5 kg犬,先以0.3 ml血液制品预冲T型接头,确保前15–30 min缓慢输注时患者仍能接收血液。
■ 起始15–30 min缓慢输注:0.25–0.5 ml/kg/h。
■ 若无输血反应,可据容量状态、合并症及紧急程度提速至2–10 ml/kg/h。
■ 紧急情况可按需尽快输注。
■ 血液制品启封后最多4 h内输完,除非分装处理(见框3)。■ 非必要勿在输注中途断开管路,以防污染。
07 输血监测
■ 输前记录基线:红细胞压积、总蛋白(TP)、黏膜颜色、血压、体温、脉搏、呼吸(TPR),并记录血清/血浆及尿液颜色
■ 前30分钟内每5–15分钟记录一次TPR,此后每30–60分钟一次;如有异常,立即停止输血并按输血反应处理流程执行大量输血(定义为3小时内输注血量超过患犬血容量的一半,或24小时内超过全血容量)会因抗凝剂用量大,增加低钙血症及低凝状态的风险。
08 输血反应
血液制品在很多情况下可挽救生命,但固有风险不可避免。输血反应类型、严重程度(从良性到致命)、发生时机(急性vs延迟)及所需干预各不相同。
文献中对输血反应的定义不一,导致识别、分类和记录困难,因此其发生率难以估算,不同物种、定义及血品报告为0–38%。2021年发布的TRACS对输血反应的定义、临床表现、预防、监测、诊断与治疗提供了全面概述,表2列出了各类输血反应的定义。



表2:输血反应:定义与病因。
发热是输血过程中最常见的变化之一,可见于非溶血性发热性输血反应、溶血性输血反应、输血传播感染(TTI)及输血相关急性肺损伤(TRALI);也可源于基础疾病,如脓毒症或免疫介导性溶血性贫血(IMHA)。
不同情况严重程度与处理各异,需先明确发热原因再采取措施。非溶血性发热反应不危及生命,但为排除性诊断,需多步评估以决定是否继续或停止输血。
输血相关循环超负荷(TACO)在临床亦较常见;血浆制品产生胶体渗透压,较浓缩红细胞和晶体液更易致容量超负荷。许多受血犬血容量正常,更易发生容量过载,因此强调成分输血以减少输注量。
其他常见输注期表现包括呼吸困难、心动过速(可伴或不伴低血压)、呕吐、血管性水肿、荨麻疹、瘙痒或过敏性休克征象(胃肠道症状、胆囊壁水肿、血性腹水或皮肤反应)。图1提供了处理输血反应的流程图。无证据支持输血前用抗组胺药预处理,故不推荐此做法。
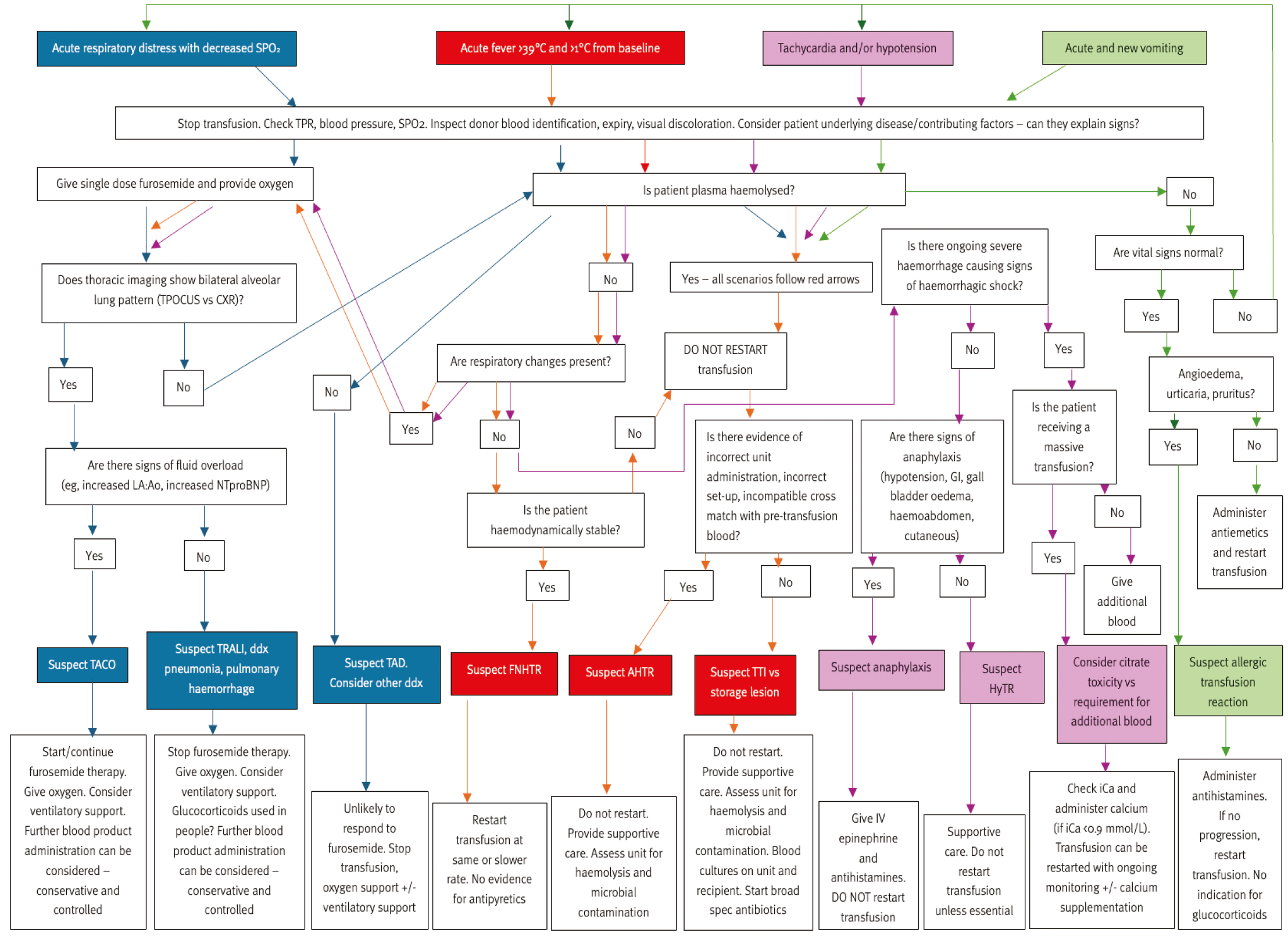
图1:输血过程中常见临床体征的流程图。按颜色箭头判断最可能的输血反应类型及所需处理。AHTR,急性溶血性输血反应;CXR,胸部X线;ddx,鉴别诊断;FNHTR,非溶血性发热性输血反应;GI,胃肠道;HyTR,低血压性输血反应;iCA,离子钙;IV,静脉注射;LA:Ao,左房-主动脉血流比;NT-proBNP,N末端B型利钠肽前体;SPO₂,血氧饱和度;TACO,输血相关循环超负荷;TAD,输血相关呼吸困难;TPR,总外周阻力;TPOCUS,床旁胸部超声;TRALI,输血相关急性肺损伤;TTI,输血传播感染。
09 常见问题
问:能否同时输注不同血制品,如浓缩红细胞与新鲜冰冻血浆?
答:最好一次只输一种;若发生反应,可迅速锁定原因。紧急情况下可同输多种。
问:输血后何时复查PCV/TP以评估效果?答:旧观点认为血红蛋白平衡需数小时,但人与犬研究均显示输后即刻PCV与数小时后无差异,故可即刻或3–4 h后检测;若持续失血,解读结果时应予考虑。
10 总结
血制品虽可救命,但伴风险,部分可致命。须了解潜在危害,仅于指征明确时使用,并以最安全方式输注。牢记血液极为珍贵,仅限合适临床场景使用。
参考文献:Threlfall, A. and Ekkebus, S. (2025), Canine blood transfusion in the UK. Part 2: putting theory into practice. In Practice, 47: 516-525.