
| 病例1 | |
|---|---|
 | 品种:比格犬 |
| 年龄:3岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:硬膜内神经束膜瘤 | |
01 主诉及病史
5个月前出现左后肢跛行。
02 检查及预后
MRI显示左侧尾椎管内有一个巨大、轮廓清晰的纺锤形肿块。该肿块从L5椎体尾端延伸至L7椎体中部,导致L5-L7脊髓节段严重侧向移位和压迫。主人选择了安乐死,并对该犬进行了尸检。
03 尸检
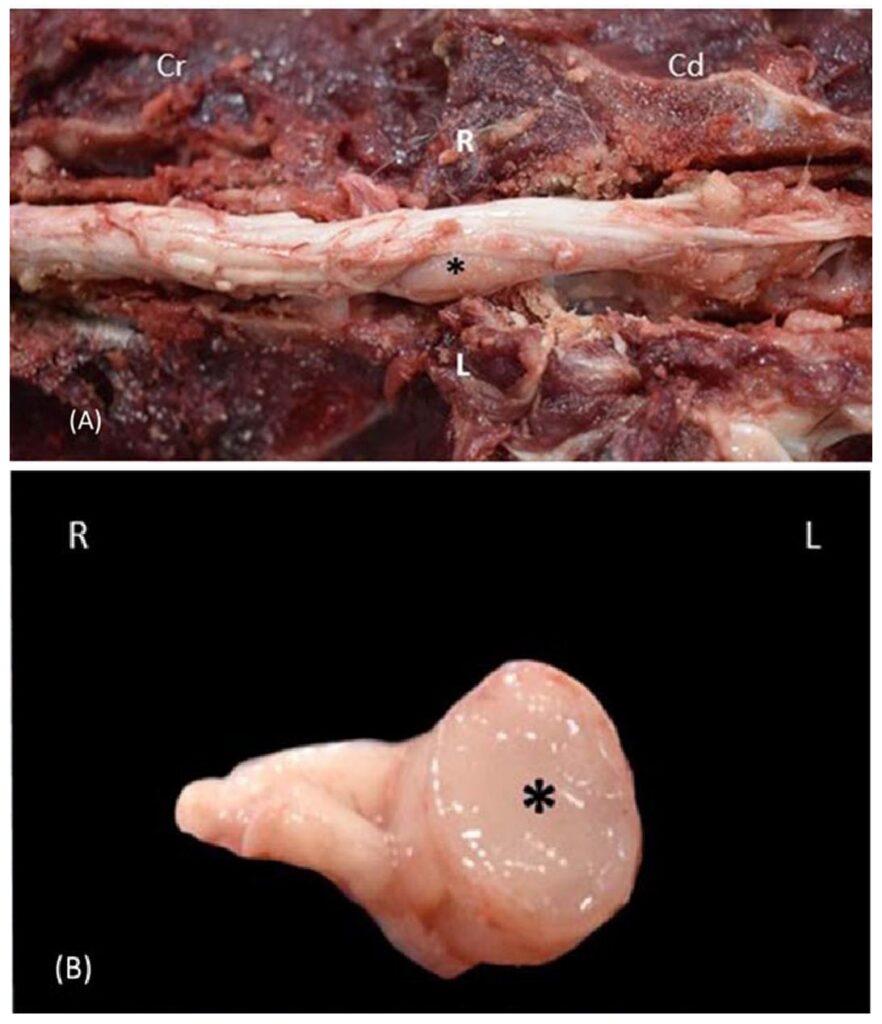
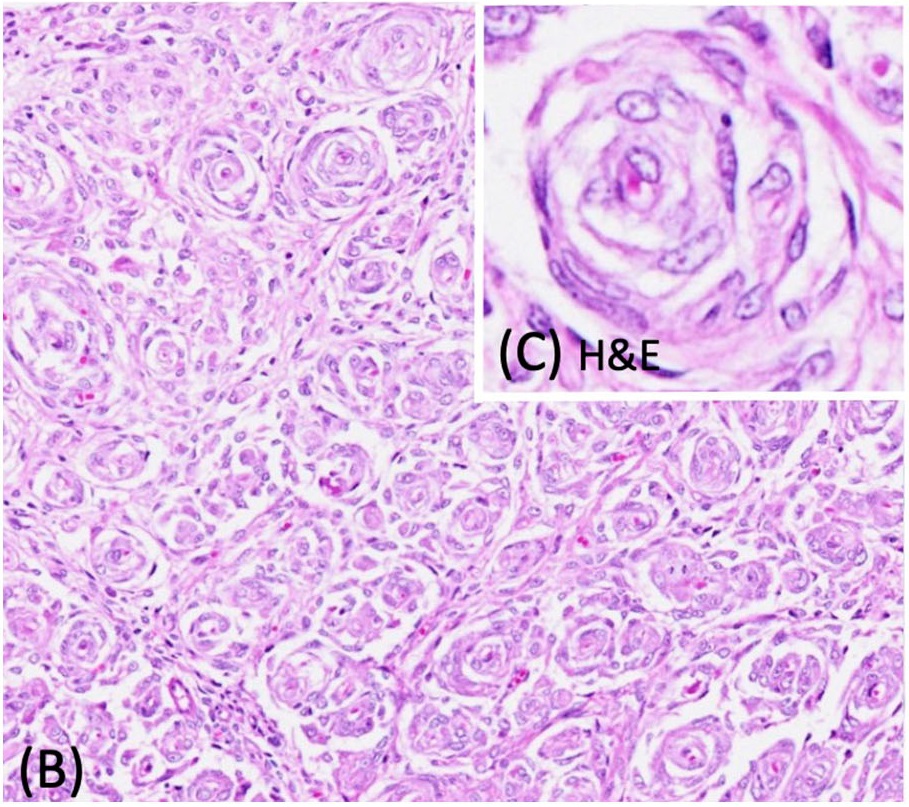
左侧L5脊神经根肿大,发现一个界限清楚、无包膜、坚实、棕褐色、2×0.5×0.5 cm肿块,明显压迫邻近的L5-L7脊髓(下图)。
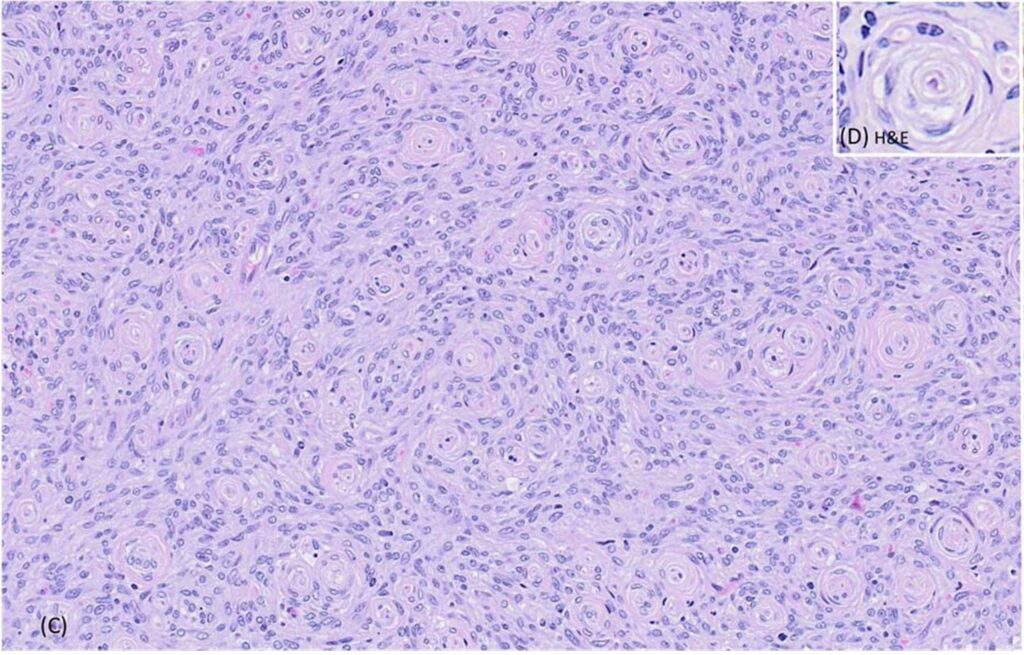
组织学结果显示,肿块无包膜,轻度浸润,细胞密集,由纺锤形细胞组成,呈同心片状排列,包绕中央轴突或毛细血管,形成假性神经球结构(下图)。肿瘤细胞的边界模糊不清,有少量嗜酸性细胞质。细胞核呈椭圆形至拉长形,染色质呈细条纹状,有1-3个小核仁。肿瘤细胞有轻度异形细胞增多和异形核分裂,在10个400倍视野中有4个有丝分裂图形。
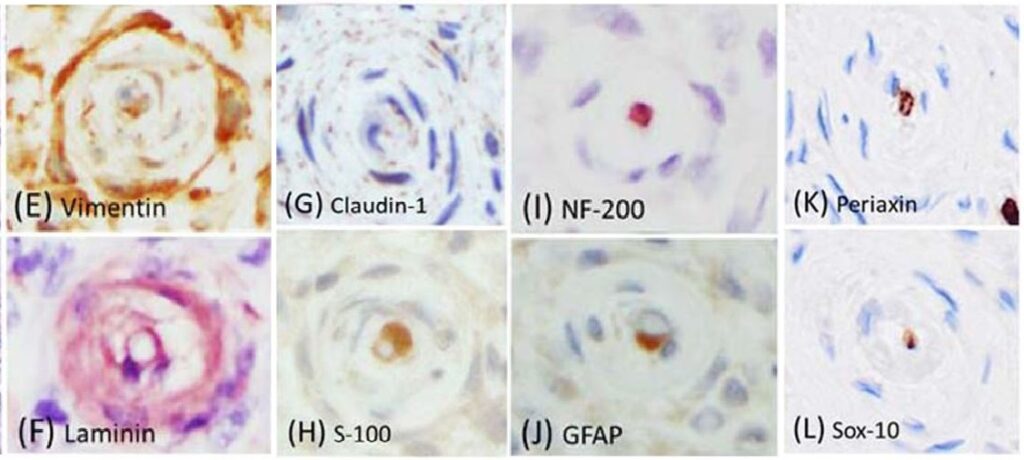
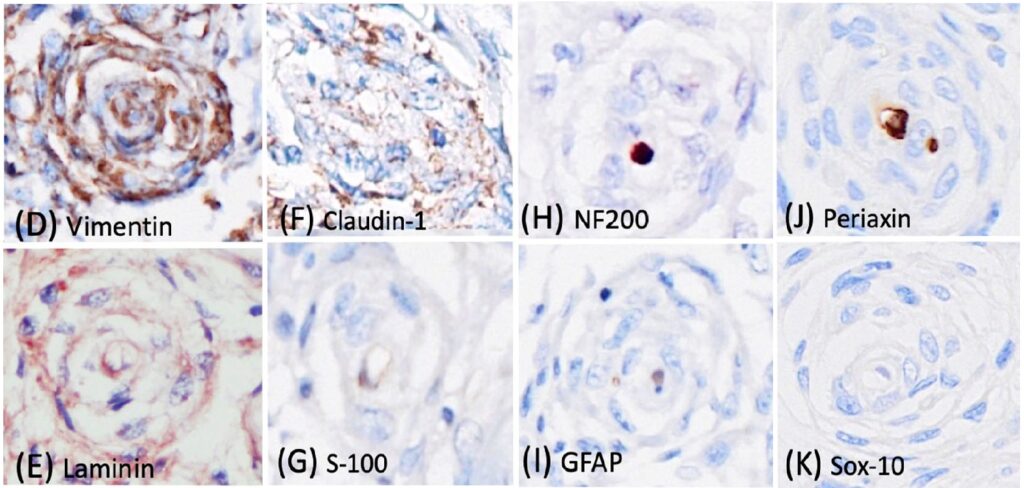
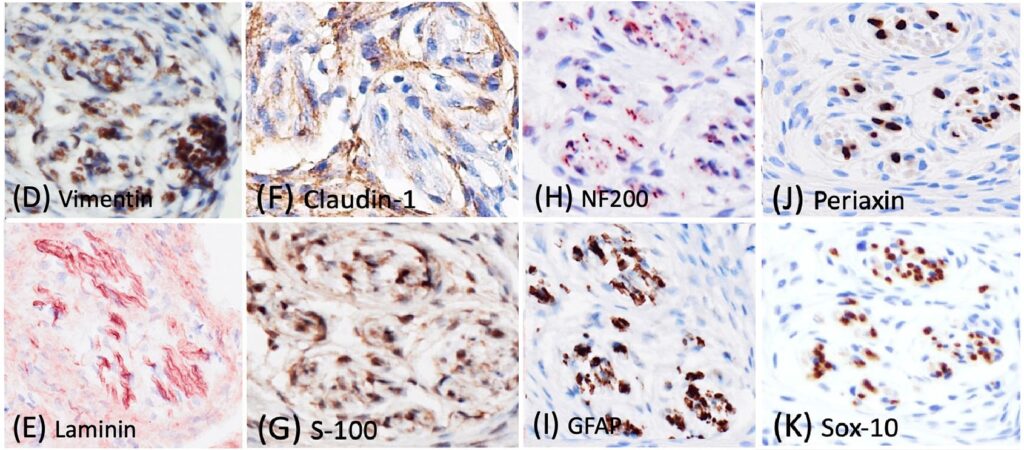
免疫组化结果显示,约90%的肿瘤性神经束膜细胞的细胞质中含有强且弥漫的Vimentin(下图E)和Laminin(下图F)表达,约50%的细胞质中含有Claudin-1免疫标记(下图G)。S-100(下图H)和GFAP免疫标记仅在假性神经球内的施旺细胞中观察到,假性神经球内的多条鞘状轴突被NF200免疫标记(下图IJ)。肿瘤细胞缺乏对Periaxin(下图K)和Sox-10(下图L)的免疫反应。与NF200类似,轴突中也检测到Periaxin免疫标记。Sox-10抗体突出显示了假性轴突球内的施旺细胞。
| 病例2 | |
|---|---|
 | 品种:拉布拉多犬 |
| 年龄:10.7岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:硬膜内神经束膜瘤 | |
04 主诉及病史
两周前出现后肢无力。
05 检查及预后
MRI显示脊髓内有一个强对比度增强的肿块,沿脊髓右侧从C6-T1延伸到相关神经根。由于长期预后不良,患者被实施了安乐死,并进行了尸检。
06 尸检
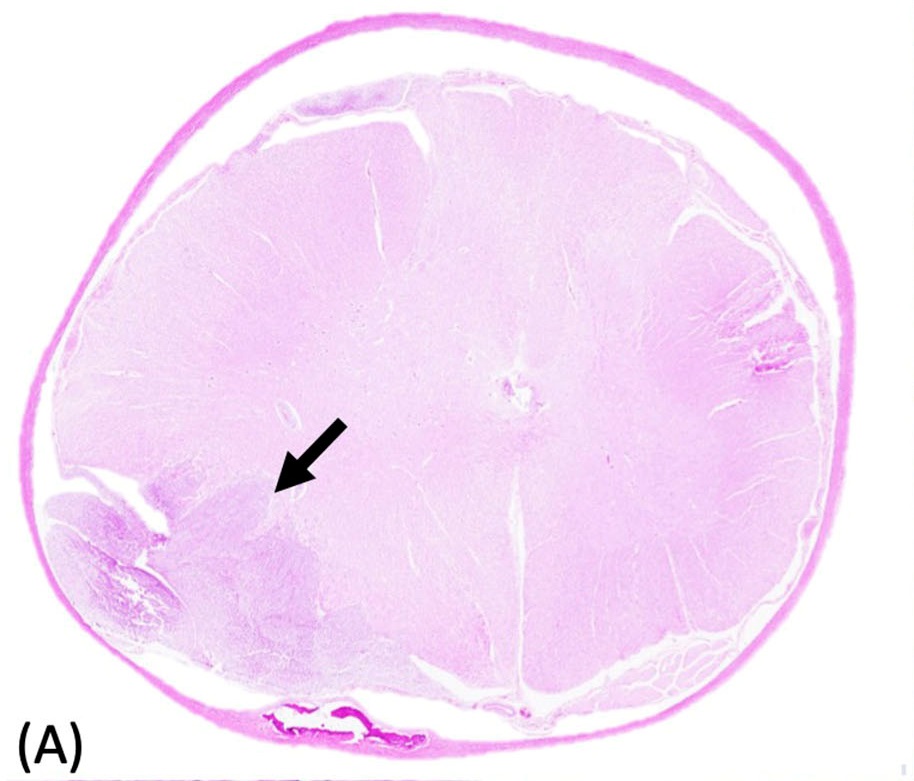
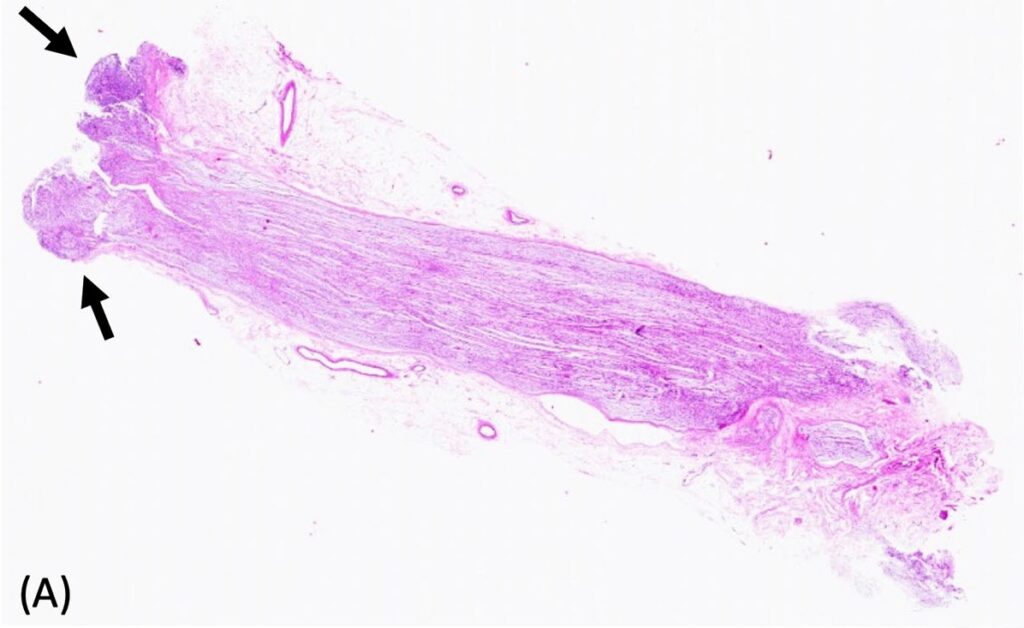
尸检发现一个直径约0.7 cm肿块侵蚀了脊髓右侧。从组织学角度看,在C6-T1右侧脊髓的外侧至前漏斗水平,观察到一个无包膜、界限清楚、细胞密集的肿瘤,肿瘤多处压迫并侵犯邻近的脊髓(下图)。
肿瘤中含有许多假性神经球结构,与第一个病例中观察到的结构相似(下图BC)。
免疫组化显示,约90%的肿瘤性神经束膜细胞被Vimentin(下图D)和Laminin(下图E)免疫标记。与病例1类似,约20%的肿瘤性神经束膜细胞显示出对Claudin-1的点状免疫标记模式(下图F)。多个假性神经球包含位于中心的NF200免疫标记轴突,轴突被GFAP和S-100阳性的施旺细胞包绕(下图G-I)。在肿瘤性神经束膜细胞中未观察到Periaxin(下图J)和Sox-10(下图K)免疫标记,但多个假性神经球的中心位置含有Periaxin免疫标记。
| 病例3 | |
|---|---|
 | 品种:拉布拉多犬 |
| 年龄:10岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:硬膜内神经束膜瘤 | |
07 主诉及病史
四个月前出现左前肢跛行和瘸腿症状。
08 检查及治疗
MRI显示左侧C7-C8神经根和右侧C8神经根肿大。手术切除了左侧C7脊神经根,以进行组织病理学评估。
09 病理
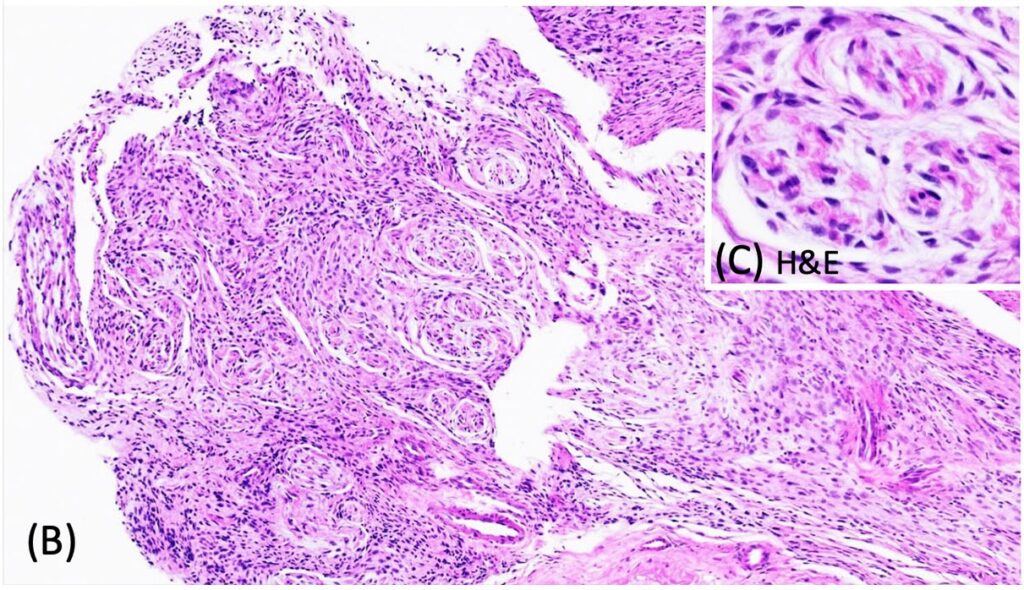
从组织学角度看,C7脊神经根轻度膨出,有一个直径约0.3 cm无包膜、细胞密集的肿块,局限于神经根周围(下图)。
该肿块中的纺锤形细胞呈短小、紧密、杂乱无章的条状、束状和轮状排列在原有基质上(下图)。
约90%的神经束膜肿瘤细胞具有Vimentin(下图D)和Laminin(下图E)免疫标记。约30-60%的肿瘤性神经束膜细胞显示出与病例1相同的Claudin-1细小点状免疫标记(下图F)。约90%肿瘤性神经束膜细胞表达S100(下图G)。多个假性神经球含有NF200免疫标记的轴突,其边缘通常有GFAP标记的施旺细胞(下图HI)。与病例1和2相似,肿瘤细胞的Periaxin(下图J)和 Sox-10(下图K)免疫标记为阴性。
10 讨论
世界卫生组织(WHO)对周围神经肿瘤的分类包括神经鞘瘤、神经纤维瘤、神经束膜瘤(perineurioma)和恶性周围神经鞘瘤[1]。其中,神经束膜瘤在人类中鲜有报道,在兽医学中的病例也很有限[2-8]。
神经束膜瘤是一种生长缓慢的良性肿瘤,完全由神经束膜细胞组成[9,10]。在人类医学中,神经束膜瘤有两种变体:硬膜外软组织肿瘤和硬膜内变体[1]。硬膜外软组织肿瘤通常是界限清楚、无包膜的肿块,最常见于四肢或躯干的皮下组织,很少累及神经[1,11]。相反,硬膜内神经束膜瘤通常为单发结节性肿块,常累及周围神经或颈椎和腰椎的神经根[1,11]。
尽管受累部位不同,但两种变体都具有肿瘤性神经束膜细胞的免疫组化和超微结构特征[1,10]。从组织学角度看,神经束膜瘤包含特征性的”假性神经球”结构,由同心层神经束膜细胞组成,围绕着有髓鞘或无髓鞘的轴突或神经束膜毛细血管[1]。
肿瘤性神经束膜细胞呈纺锤形,细胞核呈纺锤形或细长形,有少量嗜酸性细胞质,组织形态类似成纤维细胞。通过电子显微镜可将肿瘤性神经束膜细胞与成纤维细胞区分开来。从超微结构上看,正常和肿瘤性神经束膜细胞都有细长、薄而重叠的胞质突起、不连续的基底膜和针胞囊[9]。一些重叠的过程由形态不佳的脱膜体连接复合体连接[5,6,9,12]。
在兽医学中,由于具有相似的形态特征,诊断各种亚型的周围神经肿瘤非常具有挑战性。神经鞘瘤是一种良性、圆形的肿瘤,由肿瘤性施旺细胞组成,呈交织束状、流状、人字形、轮状或韦罗凯体等多种形态排列。相比之下,神经纤维瘤则由肿瘤性施旺细胞、神经周围细胞和成纤维细胞混合组成,中间有大量胶原分隔。如前所述[7],膜内神经束膜瘤通常表现为假性神经元球结构中的神经束膜细胞。
为了区分不同亚型的周围神经瘤,人们研究了各种免疫标记物。例如,层粘连蛋白Laminin通常用于诊断周围神经鞘瘤,尽管它在肿瘤性施旺细胞和神经束膜细胞中都有表达。在施旺细胞中高表达的 Sox-10在神经鞘瘤中表现出强烈的弥漫性免疫反应[14]。NF200和Periaxin是两种免疫标记物,可用于突出显示神经束膜瘤假性神经球中被的轴突[7,14]。
在人类医学中,上皮膜抗原(EMA)是一种广泛用于鉴别神经束膜瘤的免疫组化标记物[9,10,12,13],但它在小动物中的适用性有限。此外,Claudin-1和GLUT-1也是神经束膜瘤的常规辅助标记物[10]。
本研究介绍了3例涉及犬硬膜内神经束膜瘤的病例。记录了这些病例的临床病史以及详细的病理和免疫组化结果。此外,在数据库中进行了搜索,发现了3例之前报道过的犬硬膜内神经束膜瘤病例。综合来看,硬膜内神经束膜瘤通常发生在成年犬身上,小型犬和大型犬的年龄一般在3-10岁之间。大多数犬神经束膜瘤发生在雄性犬身上(6/6)。与硬膜内神经束膜瘤相关的临床表现包括脊柱疼痛、跛行和瘫痪等症状,这是因为脊神经根或周围神经受累所致。
在所有病例中,MRI均显示椎管或椎弓根内有巨大肿块,常见的大体检查结果包括存在与神经束相关的圆柱形肿块。从组织学角度看,大多数神经束膜瘤的肿瘤性神经束膜细胞排列成特征性的假性神经节球状结构或轮状结构。
在人类和兽医领域,有几种免疫标记物经常被用来鉴别神经束膜瘤并将其与其他神经鞘瘤区分开来。可以使用多种免疫标记物,包括Claudin-1、胶原蛋白IV、EMA、GFAP、GLUT-1、NF200、神经丝、Periaxin-1、Sox-10和S-100抗体。
在本病例系列中,肿瘤性神经束膜细胞均被Vimentin、Laminin和Claudin-1免疫标记。在3个病例中,NF200和Periaxin始终突出显示中央轴突。只有病例2的肿瘤性神经束膜细胞有S-100标记。与已发表的病例相似,Vimentin(2/2 例)、Laminin(5/5 例)和Claudin-1(1/1 例)也经常标记肿瘤性神经束膜细胞。Sisó等人[14]曾在犬神经束膜瘤中发现S-100、GFAP、Periaxin和Sox-10的阳性表达。
总之,尽管在兽医学中报告的病例很少,但神经束膜瘤应被视为与周围神经相关肿块的潜在鉴别诊断。对于疑似犬硬膜内神经束膜瘤的病例,可通过鉴别组织学上特征性的假性神经束膜球结构和观察神经束膜细胞中Laminin和Claudin-1的阳性免疫标记来确诊。神经束膜瘤特殊的组织形态学一般可将其与其他神经鞘瘤区分开来。虽然神经束膜瘤和神经鞘瘤都有Laminin蛋白表达,但应用Claudin-1和Sox-10可能有助于增加识别细胞来源的特异性。
参考文献
1. Kleihues P, Louis DN, Scheithauer BW, Rorke LB, Reifenberger G, Burger PC, et al.. The WHO classification of tumors of the nervous system. J Neuropathol Exp Neurol. (2002) 61:215–25.
2. Toyoda T, Ochiai K, Ohashi K, Tomioka Y, Kimura T, Umemura T. Multiple perineuriomas in chicken (Gallus gallus domesticus). Vet Pathol. (2005) 42:176–83.
3. Ochi A, Ochiai K, Hatai H, Umemura T. Naturally occurring multiple perineuriomas in a chicken (Gallus domesticus). Vet Pathol. (2008) 45:685–9.
4. Cusack L, Blas-Machado U, Mayer J. Spontaneous spinal plexiform perineurioma in a juvenile chicken (Gallus domesticus). J Vet Diagn Invest. (2017) 29:557–60.
5. Cornelis I, Chiers K, Maes S, Kramer M, Ducatelle R, De Decker S, et al.. Claudin-1 and glucose transporter 1 immunolabelling in a canine intraneural perineurioma. J Comp Pathol. (2012) 147:186–90.
6. Higgins RJ, Dickinson PJ, Jimenez DF, Bollen AW, Lecouteur RA. Canine intraneural perineurioma. Vet Pathol. (2006) 43:50–4.
7. Lanigan LG, Russell DS, Woolard KD, Pardo ID, Godfrey V, Jortner BS, et al.. Comparative pathology of the peripheral nervous system. Vet Pathol. (2021) 58:10–33.
8. Martins TB, Ramos AT. Viott AdM, Adeodato AG, Graça DL. Canine intraneural perineurioma Brazilian. J Vet Pathol. (2010) 3:66–9.
9. Boyanton Jr BL, Jones JK, Shenaq SM, Hicks MJ, Bhattacharjee MB. Intraneural perineurioma: a systematic review with illustrative cases. Arch Pathol Lab Med. (2007) 131:1382–92.
10. Rodriguez FJ, Folpe AL, Giannini C, Perry A. Pathology of peripheral nerve sheath tumors: diagnostic overview and update on selected diagnostic problems. Acta Neuropathol. (2012) 123:295–319.
11. Sachanandani NS, Brown JM, Zaidman C, Brown SS, Mackinnon SE. Intraneural perineurioma of the median nerve: case report and literature review. Hand. (2010) 5:286–93.
12. Emory TS, Scheithauer BW, Hirose T, Wood M, Onofrio BM, Jenkins RB. Intraneural perineurioma. a clonal neoplasm associated with abnormalities of chromosome 22. Am J Clin Pathol. (1995) 103:696–704.
13. Theaker JM, Gatter KC, Puddle J. Epithelial membrane antigen expression by the perineurium of peripheral nerve and in peripheral nerve tumours. Histopathology. (1988) 13:171–9.
14. Sisó S, Marco-Salazar P, Roccabianca P, Avallone G, Higgins RJ, Affolter VK. Nerve fiber immunohistochemical panel discriminates between nerve sheath and perivascular wall tumors. Vet Sci. (2022) 10:1.