
| 一般情况 | |
|---|---|
 | 品种:马尔济斯犬 |
| 年龄:11岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:药物不良反应 | |
01 主诉及病史
一周前出现厌食、抑郁、震颤、呕吐和腹泻。
患者因长期口服糖皮质激素(泼尼松龙)治疗反复发作的免疫介导性溶血性贫血(IMHA)而出现严重的皮肤钙盐沉积,在发病前一个月停止了糖皮质激素的使用。
过去18个月中,曾3次发作IMHA,每次都使用泼尼松龙,每次1-2 mg/kg,每隔1-4周减量一次,总共使用了10个月的泼尼松龙。
患者的基础疾病是胃肠炎、慢性胰腺炎和慢性肾脏病,慢性肾脏病为IRIS 2 期,无贫血。正在服用霉酚酸酯(3 mg/kg bid)、环孢素(5 mg/kg bid)、法莫替丁(0.5 mg/kg bid)、水飞蓟素(20 mg/kg bid)、熊去氧胆酸(20 mg/kg bid)和Zentonil(100 mg/犬 sid)。
02 检查
嗜睡,身体状况评分5/9,脱水率7%,头部至肛周无肿大淋巴结和肿块,全身皮肤钙盐沉积,直肠温度39.1°C。
血液分析显示中性粒细胞增多(20320/μL [<5200]),肝酶轻度升高(ALT 126 U/L [5.8-83.3];ALP 206 U/L [0-97.9]),轻度氮质血症(BUN 43. 9 mg/dL [9.6-31.4];Cr 1.78 mg/dL [0.4-1.3]),高钙血症(总钙 15.7 mg/dL [9-11.9];离子钙 2.5 mmol/L [1.12-1.4];基础皮质醇水平正常(6.55 μg/dL [1-6]);甲状旁腺激素降低(2 pg/mL [20-130])。
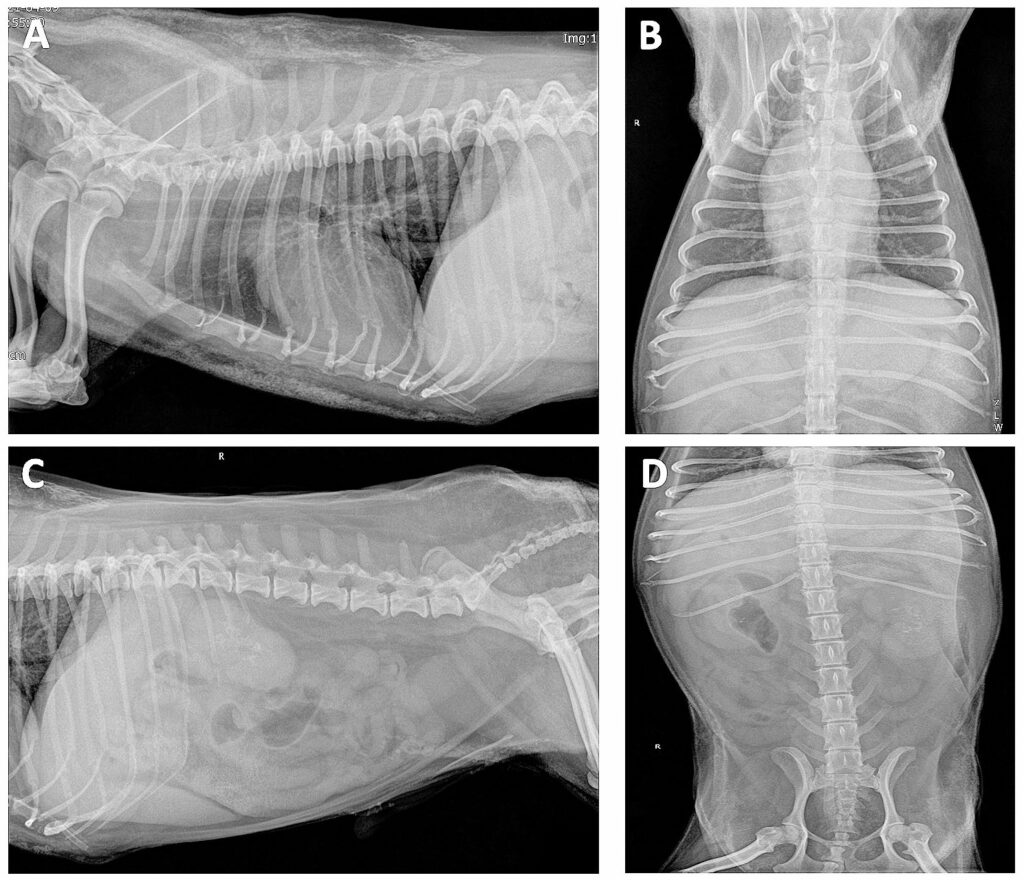
胸部和腹部X线检查显示皮下和脾脏普遍钙化(下图)。
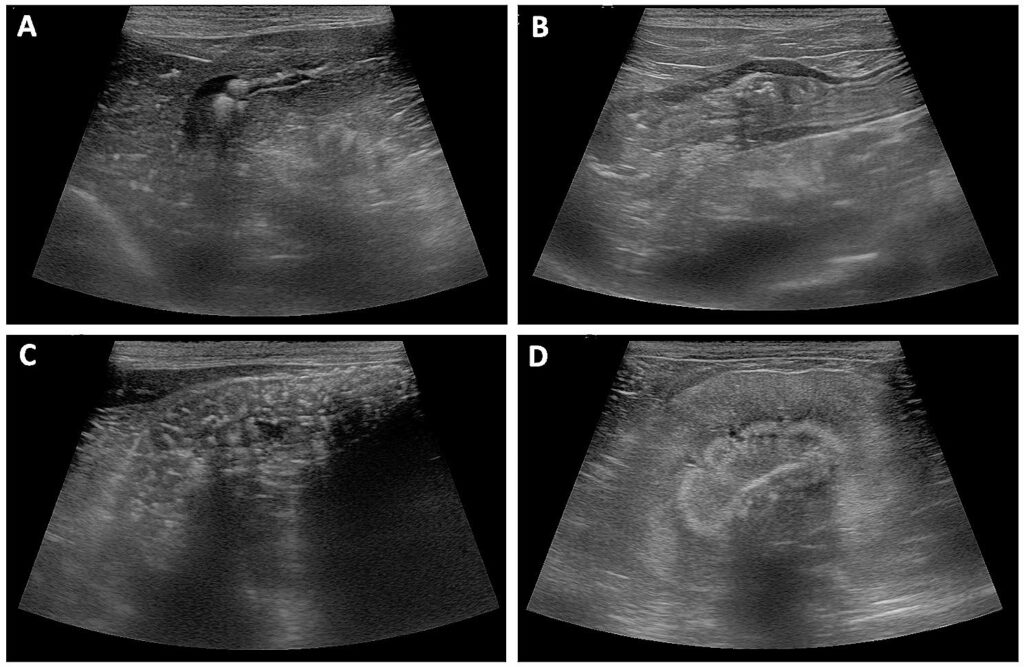
腹部超声显示胆囊壁、肝脏、胃、脾脏和肾脏等多处出现萎缩性钙化(下图)。
严重的高钙血症被认为是导致临床症状的原因,在高钙血症治疗期间对离子钙水平进行了连续测量。
03 治疗
接受了液体疗法(0.9%生理盐水)、呋塞米、帕米膦酸钠(2 mg/kg加入100 ml 0.9%生理盐水)2小时恒速输注和碳酸氢钠(4 mEq/kg缓慢静脉注射)。
5小时后,出现全身性高血压(>200 mmHg),在静脉注射肼屈嗪(0.5 mg/kg)和硝普钠(0.5 µg/kg/min)后,继续监测。治疗期间出现间歇性震颤。
04 预后
治疗第1天,离子钙在早晨降至1.75 mmol/L [1.12-1.4],然后夜间升至2.24 mmol/L。由于高血压仍在继续,因此增加了氨氯地平(0.2 mg/kg bid)。随着氮质血症的恶化和高磷血症的出现,开始使用氢氧化铝(30 mg/kg bid)、碳酸镧(30 mg/kg bid)和盐酸司维拉姆(30 mg/kg bid)。
治疗第3天,加入降钙素(4 IU/kg sc bid)以降低离子钙水平(1.98 mmol/L [1.12-1.4])。为防止氰化物中毒,停止了硝普钠。
治疗第7天,由于氮质血症和高磷血症未见好转,停用了呋塞米。
治疗第8天,停用呋塞米后,高钙血症略有恶化,因此降钙素剂量增至6 IU/kg tid。
治疗第10天,高钙血症仍未改善,但在主人要求下出院。出院后继续口服环孢素(5 mg/kg bid)、氨氯地平(0.4 mg/kg bid)、法莫替丁(1 mg/kg bid)、马洛比坦(1 mg/kg sid)、曲马多(4 mg/kg bid)、水飞蓟素(20 mg/kg bid)、熊去氧胆酸(20 mg/kg bid)、Zentonil(100 mg/犬 sid)、氢氧化铝(30 mg/kg bid)、碳酸镧(30 mg/kg bid)和盐酸司维拉姆(30 mg/kg bid)。
治疗第14天,仍有厌食和抑郁,但血钙正常,皮肤钙沉积略有改善。但氮质血症恶化,达到IRIS 4期。主人拒绝重症监护,希望使用注射疗法进行家庭护理。IMHA没有复发,因此环孢素剂量减至2 mg/kg bid。由于血压正常,氨氯地平减量至0.2 mg/kg bid。其他治疗方法保持不变。
治疗第20天,出现持续性厌食和嗜睡,没有其他症状。皮肤钙沉积在5天前已有所改善,但仍出现低钙血症(0.83 mmol/L [1.12-1.4])。主人拒绝额外治疗,但希望继续对其进行监测。因此没有开始补钙。血压正常,氨氯地平的减量至0.1 mg/kg bid。
治疗第27天,临床症状相似,离子钙水平仍低(0.85 mmol/L [1.12-1.4])。氮质血症略有改善,血压正常,停用氨氯地平。
治疗第42天,出现侧卧和呼吸困难。由于慢性肾病导致了非再生性贫血加重(PCV 26.4% [37.1-57];网织红细胞10/µL [0-60];MCV 60.3 fl [58.8-71.2];MCH 20.4 pg [20.5-24.2];MCHC 33.8 g/dl [31-36.2]),氮质血症恶化。离子钙水平进一步下降(0.62 mmol/L [1.12-1.4]),因此下颌张力增加,前肢僵硬。虽然进行了10%葡萄糖酸钙恒速输注(1.2-1.5 ml/kg/h),但还是发生了心肺骤停。虽然经心肺复苏后抢救了过来,但生命体征仍不稳定,神志不清,没有明显好转。最后在主人要求下实施了安乐死。
05 讨论
血钙浓度由激素控制,包括甲状旁腺激素(PTH)、骨化三醇(1,25-二羟维生素D)、24,25-二羟维生素D和降钙素[1,2]。在犬中,高钙血症最常见的病因是肿瘤、原发性甲状旁腺功能亢进、慢性肾脏疾病和肾上腺皮质功能减退[2]。
高钙血症可分为甲状旁腺依赖型(原发性甲状旁腺功能亢进)和甲状旁腺非依赖型(甲状旁腺功能正常)两种[3]。在甲状旁腺依赖型高钙血症中,正常的甲状旁腺在对高钙血症做出正常反应时会抑制PTH的产生,PTH通常检测不到或极低[3-5]。
甲状旁腺依赖型高钙血症的病因包括特发性高钙血症、恶性肿瘤、维生素D过多、慢性炎症、急性肾功能衰竭和骨骼病变[1,2]。一般来说,当血清离子钙水平超过2.2 mmol/L,患者就会病危[2]。高钙血症的治疗方法包括液体疗法和使用呋塞米、泼尼松龙、降钙素和双膦酸盐的药物治疗[2]。
双膦酸盐与骨表面的矿物质结合,抑制破骨细胞的功能,从而减少骨吸收,进而降低血钙[1,6]。在犬中,含氮双膦酸盐(如阿仑膦酸盐、帕米膦酸盐和唑来膦酸盐)主要用于治疗高钙血症[7]。含氮的双膦酸盐能在纳摩尔浓度下抑制甲羟戊酸代谢途径,从而干扰细胞质内正常信号转导所需的蛋白质前酰化[7,8],这一过程对骨吸收至关重要。
在犬中,帕米膦酸钠主要用于控制癌症相关的骨痛,也可用于治疗高钙血症,但不良反应仍不清楚[9-16]。与人类一样,犬的不良反应发生率应该也很低[6]。不良反应包括低钙血症、电解质失衡和肾功能衰竭,在人类[17]和狗[9,10]中都很罕见。
帕米膦酸钠的急性期不良反应在用药后28-36小时达到高峰,一般在2-3天内自行缓解[18]。与口服双膦酸盐相比,静脉注射双膦酸盐(如帕米膦酸盐)更容易诱发低钙血症,而且低钙血症通常发生在用药后几天内。
在人体中,帕米膦酸钠诱发的低钙血症主要发生在原有维生素D过低、甲状旁腺功能减退和低镁血症的患者身上[19]。为预防帕米膦酸钠诱发的低钙血症,应在服用帕米膦酸钠前2周开始补充维生素D和钙[18]。
严重肾毒性是静脉注射帕米膦酸钠的另一个不良反应[17]。在人体中,已发现了导致肾功能下降的危险因素,包括慢性肾功能衰竭、高钙血症、高血压、高龄、化疗药物、既往双膦酸盐治疗和多发性骨髓瘤[17]。然而,很少有研究对兽医学中的这一主题进行评估。
在本病例中,患者在外源性糖皮质激素治疗IMHA期间出现了库欣综合征,通过减少糖皮质激素得到了控制。3周后,患者出现厌食,后被诊断为高钙血症。患者接受了一次帕米膦酸钠治疗,并接受了其他支持性治疗以治疗高钙血症。然而,患者随后出现了严重且不可逆转的低钙血症和慢性肾功能衰竭,最终导致死亡。
尽管糖皮质激素停药导致高钙血症的机制仍不清楚,但高钙血症的发生可能是由于肾上腺功能不全导致骨吸收增加和肾脏排钙减少[20-22]。糖皮质激素诱导的肾上腺功能不全和糖皮质激素戒断综合征的诊断和治疗已在人类中确立[23]。这两种情况都可归因于长期使用糖皮质激素后的停药。然而,肾上腺功能不全会带来肾上腺危象的风险,而糖皮质激素戒断综合征则不会。
由于糖皮质激素戒断综合征患者的下丘脑-垂体肾上腺功能正常,他们的基础皮质醇水平也正常。本患者在长期使用糖皮质激素后出现了高钙血症,且没有应激性白细胞检查,因此该患者可能患有类似于糖皮质激素诱发的肾上腺功能不全。
该患者在出现高钙血症时,没有观察到典型的低Na:K比。这提示了糖皮质激素用药导致的糖皮质激素缺乏性继发性肾上腺功能不全的可能性。虽然没有进行肾上腺皮质激素刺激试验,但基础皮质醇水平是正常的。此外,典型肾上腺功能不全的诊断也很困难。
一名库欣综合征患者在肾上腺切除术后出现肾上腺功能不全,随后继发高钙血症[21]。该患者最初表现为厌食、肾上腺皮质激素水平低和血清皮质醇水平正常,但随后出现了高钙血症。由于本患者在症状出现一周后才到医院就诊,并被诊断为高钙血症,此时的血清皮质醇水平可能与上述人类病例一样是正常的。
总之,该犬患有库欣综合征,在停用糖皮质激素后出现了严重的高钙血症。使用帕米膦酸钠治疗高钙血症又导致了低钙血症和慢性肾脏病的迅速恶化。虽然低钙血症是双膦酸盐治疗的罕见副作用,但帕米膦酸盐可能会导致潜在的生命危险。
因此,在使用帕米膦酸钠治疗高钙血症之前,有必要对高钙血症的病因进行全面诊断,尤其是对已停用糖皮质激素的犬,应慎重考虑使用帕米膦酸钠,并根据基础疾病确定高钙血症的适当治疗方法。
文献来源:Oh YI, An JH, Lim GH, Park SM, Kim TH, Seo KW, Youn HY. Pamidronate-induced irreversible symptomatic hypocalcemia in a dog with hypercalcemia after glucocorticoid withdrawal: a case report. BMC Vet Res. 2024 May 24;20(1):227.
参考文献
1. Hardy BT, de Brito Galvao JF, Green TA, Braudaway SR, DiBartola SP, Lord L, Chew DJ. Treatment of ionized hypercalcemia in 12 cats (2006–2008) using PO-administered alendronate. J Vet Intern Med. 2015;29:200–6.
2. de Brito Galvão JF, Schenck PA, Chew DJ. A quick reference on hypercalcemia. Vet Clin North Am Small Anim Pract. 2017;47:241–8.
3. de Brito Galvão JF, Parker V, Schenck PA, Chew DJ. Update on feline ionized hypercalcemia. Vet Clin North Am Small Anim Pract. 2017;47:273–92.
4. Midkiff AM, Chew DJ, Randolph JF, Center SA, DiBartola SP. Idiopathic hypercalcemia in cats. J Vet Intern Med. 2000;14:619–26.
5. Schenck P, Chew D, Refsal K, Nachreiner R, Rick M. Calcium metabolic hormones in feline idiopathic hypercalcemia. J Vet Intern Med. 2004;18:442.
6. Fan TM. Intravenous aminobisphosphonates for managing complications of malignant osteolysis in companion animals. Top Companion Anim Med. 2009;24:151–6.
7. Suva LJ, Cooper A, Watts AE, Ebetino FH, Price J, Gaddy D. Bisphosphonates in veterinary medicine: the new horizon for use. Bone. 2021;142:115711.
8. Rogers MJ, Mönkkönen J, Munoz MA. Molecular mechanisms of action of bisphosphonates and new insights into their effects outside the skeleton. Bone. 2020;139:115493.
9. Fan TM, de Lorimier LP, Charney SC, Hintermeister JG. Evaluation of intravenous pamidronate administration in 33 cancer-bearing dogs with primary or secondary bone involvement. J Vet Intern Med. 2005;19:74–80.
10. Fan TM, de Lorimier LP, O’Dell-Anderson K, Lacoste HI, Charney SC. Single‐agent pamidronate for palliative therapy of canine appendicular osteosarcoma bone pain. J Vet Intern Med. 2007;21:431–9.
11. Treggiari E, Elliott JW. Malignant pilomatricoma in a dog with local and distant metastases treated with chemotherapy and bisphosphonates. Open Vet J. 2017;7:208–13.
12. Pagano C, Boudreaux B, Shiomitsu K. Safety and toxicity of an accelerated coarsely fractionated radiation protocol for treatment of appendicular osteosarcoma in 14 dogs: 10 gy× 2 fractions. Vet Radiol Ultrasound. 2016;57:551–6.
13. Oblak ML, Boston SE, Higginson G, Patten SG, Monteith GJ, Woods JP. The impact of pamidronate and chemotherapy on survival times in dogs with appendicular primary bone tumors treated with palliative radiation therapy. Vet Surg. 2012;41:430–5.
14. Kozicki AR, Robat C, Chun R, Kurzman ID. Adjuvant therapy with carboplatin and pamidronate for canine appendicular osteosarcoma. Vet Comp Oncol. 2015;13:229–36.
15. Hostutler RA, Chew DJ, Jaeger JQ, Klein S, Henderson D, DiBartola SP. Uses and effectiveness of pamidronate disodium for treatment of dogs and cats with hypercalcemia. J Vet Intern Med. 2005;19:29–33.
16. Fan TM, Charney SC, De Lorimier LP, Garrett LD, Griffon DJ, Gordon-Evans WJ, Wypij JM. Double‐blind placebo‐controlled trial of adjuvant pamidronate with palliative radiotherapy and intravenous doxorubicin for canine appendicular osteosarcoma bone pain. J Vet Intern Med. 2009;23:152–60.
17. Ballard T, Chargui S. Pamidronate. https://pubmed.ncbi.nlm.nih.gov/31869137/.
18. Papapetrou PD. Bisphosphonate-associated adverse events. Horm (Athens) 2009;8:96–110.
19. Tanvetyanon T, Stiff PJ. Management of the adverse effects associated with intravenous bisphosphonates. Ann Oncol. 2006;17:897–907.
20. Oyama Y, Iwafuchi Y, Narita I. A case of hypercalcemia because of adrenal insufficiency induced by glucocorticoid withdrawal in a patient undergoing hemodialysis. CEN Case Rep. 2022;11:73–8.
21. Katahira M, Yamada T, Kawai M. A case of Cushing syndrome with both secondary hypothyroidism and hypercalcemia due to postoperative adrenal insufficiency. Endocr J. 2004;51:105–13.
22. Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ (2021) 374n1380.
23. Baker EH. Is there a safe and effective way to wean patients off long-term glucocorticoids? Br J Clin Pharmacol. 2020;87:12–22.