
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:4岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:右眼急性角膜水肿 | |
01 主诉及病史
1天前出现结膜发红、眼分泌物增多和右眼(OD)间歇性斜视。
一年前曾因淋巴细胞浆细胞性牙龈炎和口炎而连续口服全身性皮质类固醇(泼尼松龙1 mg/kg/天)。
02 检查
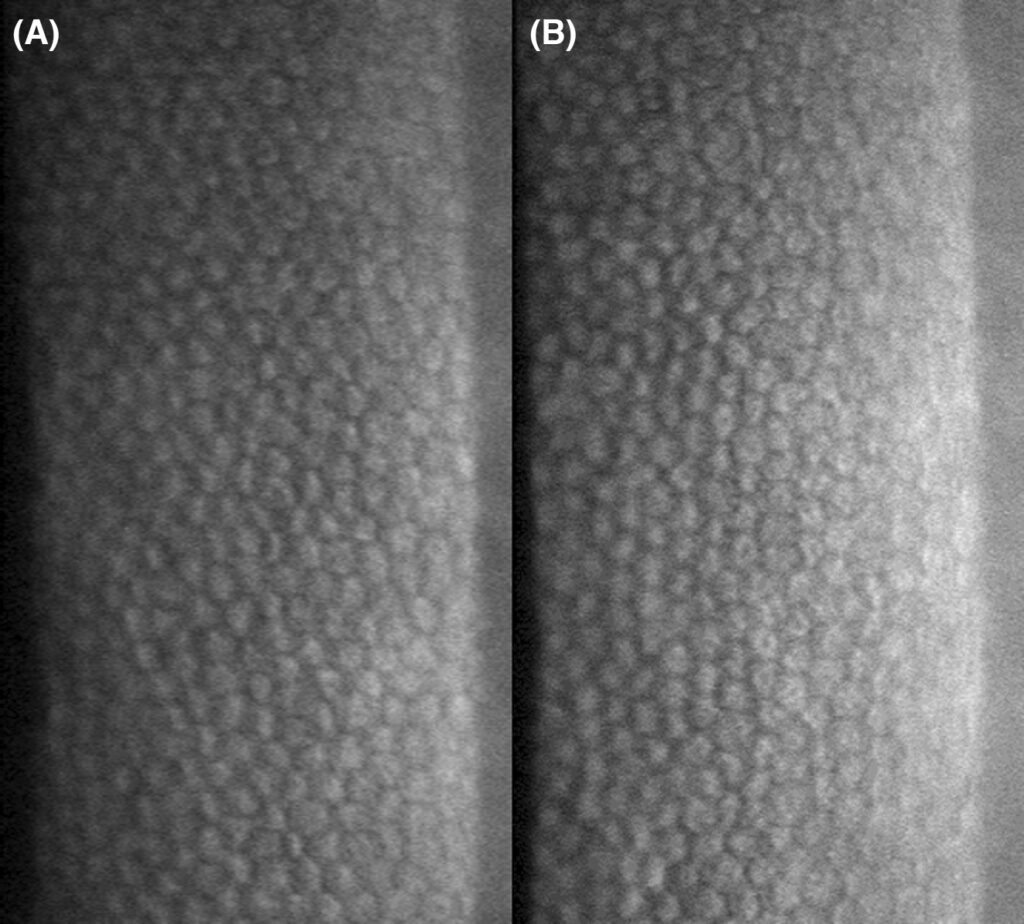
左眼(OS)未发现异常。右眼轻微疼痛、畏光和眼睑痉挛。荧光素染色显示角膜上皮无缺损。OD眼压为12 mmHg。角膜内皮形态和细胞密度正常,双眼角膜中央区域的内皮细胞存在多形性(下图)。
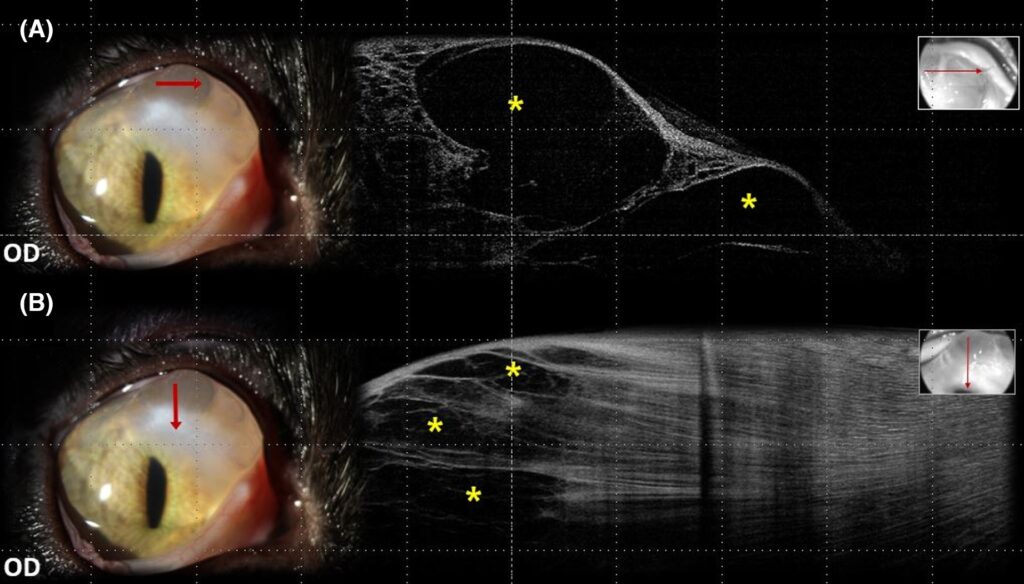
裂隙灯检查发现在角膜背内侧区域有较大的基质内液滴,符合猫急性角膜水肿(FACH)(下图)。双眼间接眼底镜检查未发现眼底异常。建议进行手术治疗,但主人拒绝。
03 治疗
采用局部治疗,0.3%氧氟沙星(q6h)、透明质酸(q6h)和5%氯化钠(q4h)滴眼液。
04 预后
7天后与最初症状相比,角膜的大液滴明显扩大。30天后OD基质内液滴已基本消退,但背侧角膜周围仍存在轻度角膜混浊和新生血管(下图)。
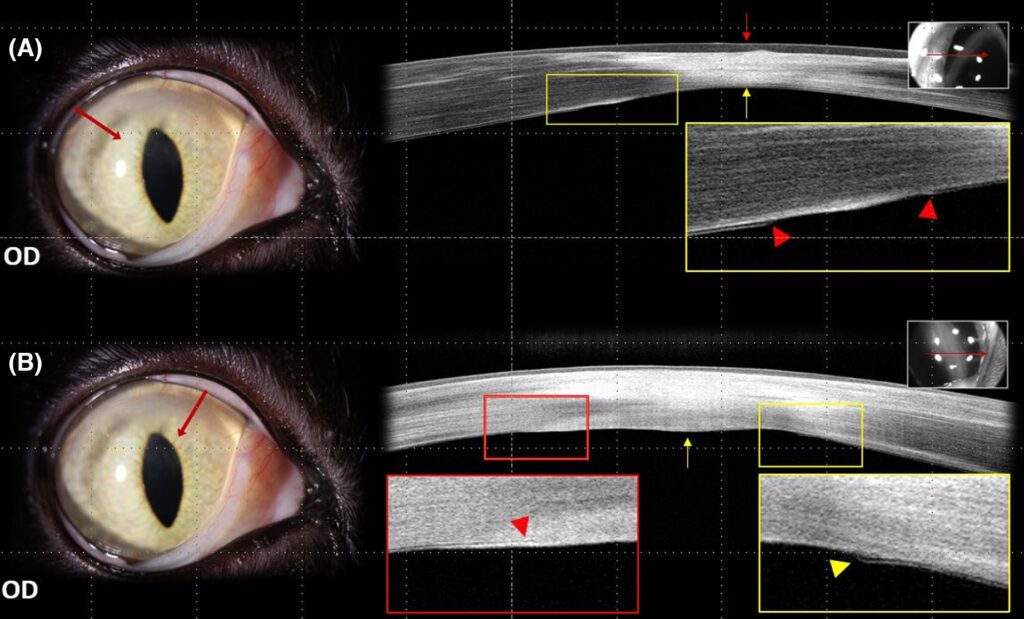
接下来的20天里外用滴眼液逐渐减少。初次发病4个月后,OS角膜背内侧区域出现了与OD相同的状况(下图)。
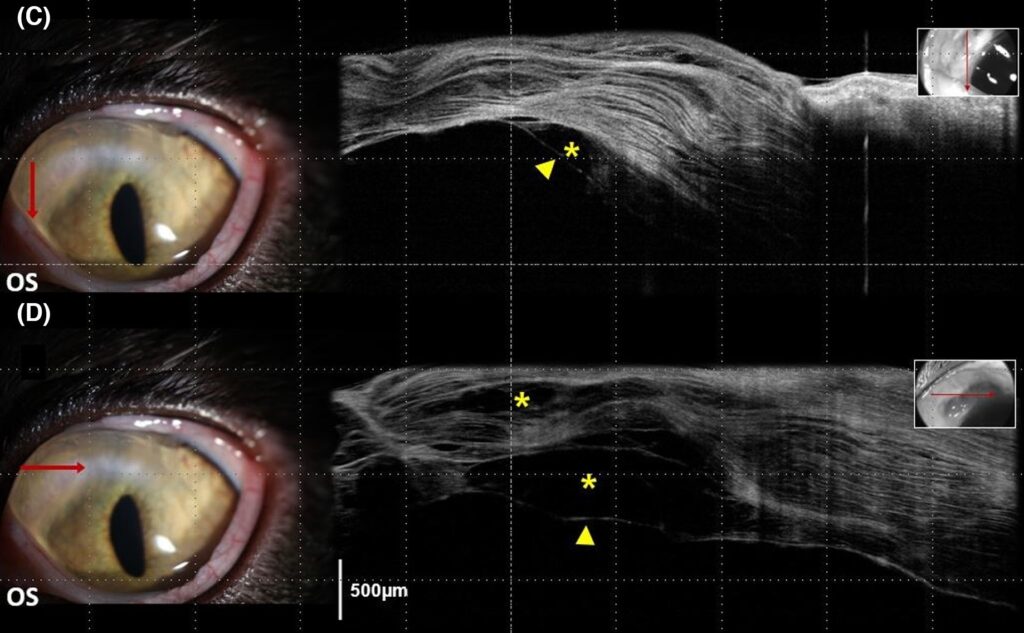
据主人报告,在OS病变发生前的两周内,该猫接受了更大剂量的全身类固醇治疗(泼尼松龙 2 mg/kg/天)以控制原有牙龈炎和口炎的恶化。给予OS相同的治疗方案,9天后OS角膜背内侧的水肿有所减轻,但基质内的液滴明显扩大,与OD的进展相似。1个月后,OS背侧角膜周围出现了非常轻微的不透明角膜病变(下图)。
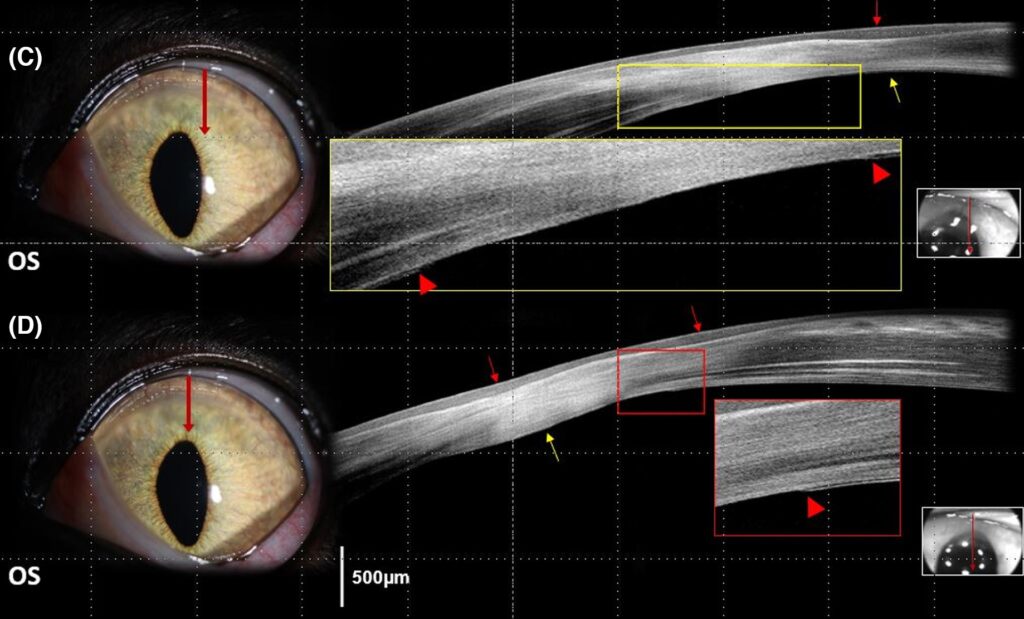
05 讨论
猫急性角膜水肿(Feline acute corneal hydrops,FACH)是一种快速进展性角膜病,多见于年轻的成年猫,其特征是角膜基质内突然形成大的液滴[1,2]。这种疾病通常是双眼发病,且不对称。
FACH的根本原因尚不清楚,但有几种病因和风险因素,包括角膜后弹力层(狄氏膜,Descemet’s membrane,DM)脱离或破裂、长期使用免疫调节剂、葡萄膜炎和感染性病原体[1,3-6]。轻度至中度的FACH对药物治疗反应良好,但较严重的病例通常需要手术治疗[3,5,6]。
眼前节光学相干断层扫描(OCT)通常用于诊断和监测各种角膜疾病[6-9]。人急性角膜水肿与FACH在临床上相似,是由于DM脱离或破裂引起的[7,8]。在最近的一份猫病例报告中,病因不明的右眼FACH经手术治疗后成功消退。在未受影响的对侧眼中,通过OCT发现了单个DM-内皮复合体的混浊病变,因此怀疑FACH可能是由DM脱落引起的[6]。本病例报告的目的是使用眼前节OCT在一只患有FACH的猫的双眼中识别DM脱落和潜在的DM断裂。
在本病例中,角膜上皮增厚通常发生在基质变薄的区域。众所周知,这种增厚是维持角膜整体厚度的一种补偿机制[12]。角膜硬度的增加,尤其是角膜前基质硬度的增加,可归因于基质厚度的增加,从而有助于角膜曲率的保持[13]。
在使用OCT对角膜塑形镜进行的人体研究中发现,角膜上皮有能力抵消因角膜基质大幅变薄而产生的不规则现象。此外,在共聚焦显微镜下观察到,急性角膜水肿患者的上皮细胞呈明显的拉长形态,OCT观察到上皮细胞增厚[14]。
本病例的OCT结果观察到了多个充满液体的巨大基质内液滴和严重的基质片状分离。这与之前描述猫和人类急性角膜水肿患者OCT图像的研究结果一致[7,11,15]。
在带有大液滴的角膜基质的临床愈合过程中,OCT显示局灶性高反射区增厚,基质变薄或增厚并伴有全基质高反射。前者与既往报道的一只FACH猫的OCT图像相同[6]。因此,从OCT图像的相似性可以看出,前驱病变有可能发展为FACH。此外,后者与人类因DM破裂引起急性角膜水肿的OCT图像相似[7,8,11]。
在本病例中,对FACH进行治疗后,OCT图像显示了DM破裂的两个潜在指标:卷曲末端和扁平末端破裂以及DM脱落。本报告中的OCT发现似乎与人类急性角膜水肿的组织病理学图像一致,尤其是DM的卷曲和扁平末端破裂。
在最初的检查中,使用OCT很难发现DM有任何明显的破裂。不过,这些破裂有可能随着FACH病情的发展而发生。本病例两只眼睛的FACH在病情发展的最初7-9天内都会恶化,这也证明了这一点。因此,大量基质液滴的存在可能会妨碍使用OCT观察破裂的DM。
FACH有多种可能的病因。兽医文献中提到的导致FACH的原因包括感染性病原体、原有葡萄膜炎、长期使用全身性环孢素和泼尼松龙以及DM脱落或破裂[1,3-6]。之前的一项研究报告称,用于免疫抑制治疗的全身性环孢素是导致FACH发生的一个潜在危险因素[5]。
一些临床报告表明,长期全身性皮质类固醇治疗也可能导致猫患FACH[1,4,5]。在本病例中,猫在服用全身性类固醇超过1年后,因病情恶化而增加剂量,导致双眼出现FACH。考虑到主人的报告和之前的研究结果,长期服用皮质类固醇可能也是导致该患者发生FACH的原因之一。
本病例报告展示了在FACH病例中观察到的眼前节OCT特征。具体来说,OCT在一只患有FACH猫的双眼中发现了两种假定的DM破裂类型:卷曲末端和扁平末端,以及DM脱离。这些结果有力地证明了猫的DM脱落或破裂与FACH的发生之间存在关联。
参考文献
1. Pickett JP. Cornea and sclera. In: Martin CL, Pickett JP, Spiess BM, eds. In: Ophthalmic Diseases in Veterinary Medicine. 2nd ed. CRC Press; 2010:242-288.
2. Moore PA. Feline corneal disease. Clin Tech Small Anim Pract. 2005;20(2):83-93.
3. Pattullo K. Acute bullous keratopathy in a domestic shorthair. Can Vet J. 2008;49(2):187-189.
4. Pederson SL, Pizzirani S, Andrew SE, Pate DO, Stine JM, Michau TM. Use of a nictitating membrane flap for treatment of feline acute corneal hydrops-21 eyes. Vet Ophthalmol. 2016;19(Suppl 1):61-68.
5. Pierce KE Jr, Wilkie DA, Gemensky-Metzler AJ, et al. An association between systemic cyclosporine administration and development of acute bullous keratopathy in cats. Vet Ophthalmol. 2016;19(Suppl 1):77-85.
6. Schlesener BN, Scott EM, Vallone LV. An unusual case of feline acute corneal hydrops: atypical disease presentation and possible in vivo detection of Descemet’s membrane detachment in the cat’s unaffected eye. Vet Ophthalmol. 2018;21(4):426-431.
7. Basu S, Vaddavalli PK, Vemuganti GK, Ali MH, Murthy SI. Anterior segment optical coherence tomography features of acute corneal hydrops. Cornea. 2012;31(5):479-485.
8. Fan Gaskin JC, Patel DV, McGhee CN. Acute corneal hydrops in keratoconus – new perspectives. Am J Ophthalmol. 2014;157(5):921-928.
9. Cho H, Jeong M, Yoo S. A case of Candida albicans-induced fungal keratitis in a Chihuahua dog – with a focus on optical coherence tomographic features. J Vet Sci. 2023;24(2):e30.
10. Franzen AA, Pigatto JA, Abib FC, Albuquerque L, Laus JL. Use of specular microscopy to determine corneal endothelial cell morphology and morphometry in enucleated cat eyes. Vet Ophthalmol. 2010;13(4):222-226.
11. Sandali O, El Sanharawi M, Temstet C, et al. Fourier-domain optical coherence tomography imaging in keratoconus: a corneal structural classification. Ophthalmology. 2013;120(12):2403-2412.
12. Reinstein DZ, Archer TJ, Gobbe M. Corneal epithelial thickness profile in the diagnosis of keratoconus. J Refract Surg. 2009;25(7):604-610.
13. Müller LJ, Pels E, Vrensen GF. The specific architecture of the anterior stroma accounts for maintenance of corneal curvature. Br J Ophthalmol. 2001;85(4):437-443.
14. Efron N, Hollingsworth JG. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 2008;91(1):34-55.
15. Famose F. Assessment of the use of spectral domain optical coherence tomography (SD-OCT) for evaluation of the healthy and pathological cornea in dogs and cats. Vet Ophthalmol. 2014;17(1):12-22.
16. Dubielzig RR, Ketring KL, McLellan GJ, Albert DM. Veterinary Ocular Pathology; A Comparative Review. Elsevier Saunders; 2010:211-213.
17. Whitley RD, Hamor RE. Diseases and surgery of the canine cornea and sclera. In: Gelatt KN, Ben-Schlomo G, Gilger CG, Hendrix DH, Kern TJ, Plummer CE, eds. Veterinary Ophthalmology. 6th ed. Wiley-Blackwell; 2021:1082-1172.
18. Stone DL, Kenyon KR, Stark WJ. Ultrastructure of keratoconus with healed hydrops. Am J Ophthalmol. 1976;82(3):450-458.
19. Lockington D, Fan Gaskin JC, McGhee CNJ, Patel DV. A prospective study of acute corneal hydrops by in vivo confocal microscopy in a New Zealand population with keratoconus. Br J Ophthalmol. 2014;98(9):1296-1302.