
| 一般情况 | |
|---|---|
 | 品种:混种犬 |
| 年龄:6岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肺血栓栓塞 | |
01 主诉及病史
3个月前体检发现心脏杂音,X线发现心脏肿大,无临床症状。
约2个月前曾出现过一次呼吸困难,表现为明显的呼气用力,但呼吸频率正常(32次/分),2小时内缓解,未治疗。
该犬在约2年前作为成年犬被收养,之前病史不详。被收养时,心丝虫、伯氏疏螺旋体、犬埃立克体检测呈阳性。曾接受过一次心丝虫治疗,此后检测结果呈阴性。还使用过多西环素以治疗伯氏疏螺旋体和犬埃立克体感染。
02 检查
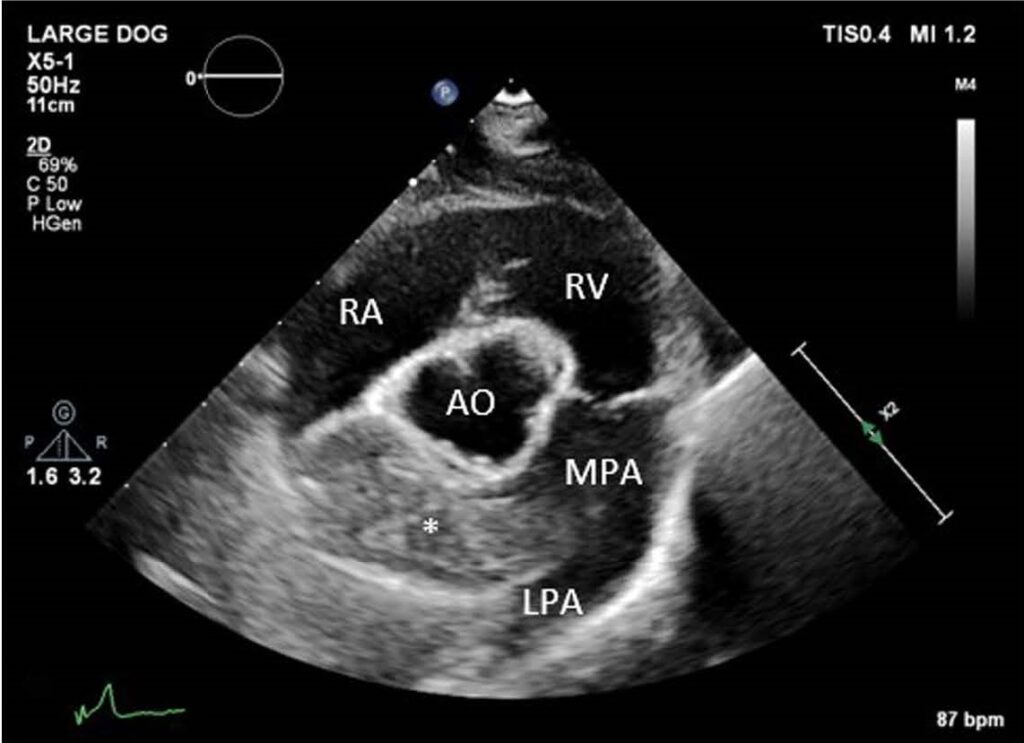
胸骨右侧收缩期心脏杂音为II-III/VI级。超声心动图显示右心室中度扩大、三尖瓣中度反流(TR)和中度肺动脉高压(TR,压力梯度约为60 mmHg)。最重要的发现是主肺动脉远端和右支肺动脉内有一个约1.5×5.5 cm高回声结构(下图)。
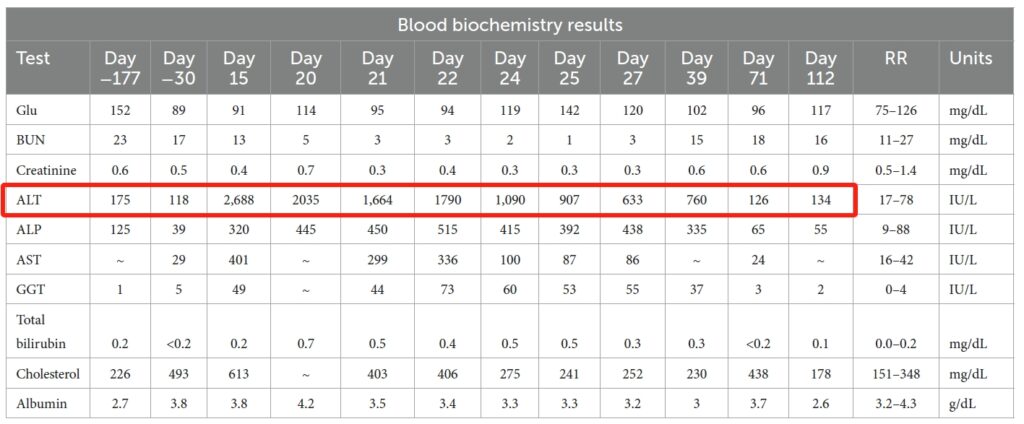
实验室检查的异常结果包括ALT轻度升高(118 IU/L,参考值17-78)、轻度蛋白尿和轻度高胆固醇血症(498 mg/dL,参考值151-348)。伯氏疏螺旋体、犬埃立克体抗体持续呈阳性,而心丝虫抗体呈阴性。
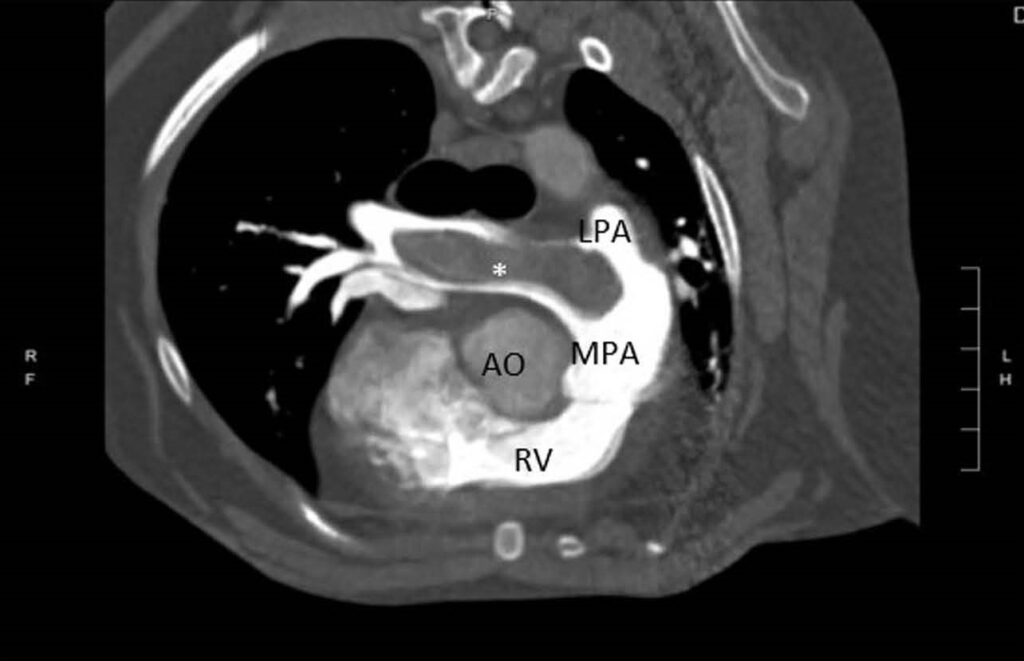
CT发现右肺动脉血栓广泛矿化,右中动脉、右尾动脉和左尾叶动脉内有部分闭塞性血栓(下图)。怀疑这些血栓继发于之前诊断的心丝虫病。
03 治疗
考虑到目前的肺血栓栓塞(PTE),并为了预防发生更多血栓,口服氯吡格雷(1.8 mg/kg,q24h)及利伐沙班(0.5 mg/kg,q12h)。
04 预后
在服用氯吡格雷三天后出现了严重的持续腹泻,清淡饮食和益生菌治疗无效。总共服用了7次氯吡格雷后停药,停药约36小时后腹泻症状明显好转。
7天后试用减量的氯吡格雷(0.9 mg/kg,q24h),但4天后再次出现严重腹泻。随后永久停用氯吡格雷。由于主人迟迟未收到利伐沙班,直到就诊30天后(最后一次服用氯吡格雷7天后)才开始口服第一剂利伐沙班(0.5 mg/kg,q12 h)。
服用利伐沙班5天后复查,在家中表现良好,没有反复出现呼吸道症状,腹泻也已缓解,也没有发现不良反应。超声心动图显示的结果与上次复查的结果相似(右肺动脉血栓的大小保持不变)。建议继续服用利伐沙班,并安排2个月后复查。
服用利伐沙班15天后,出现厌食和嗜睡症状。这些症状大约出现在第9天,当时总共服用了19次利伐沙班。实验室检查显示有严重的肝细胞性肝病,主要表现为ALT严重升高,达到2688 IU/L(17-78)。腹部超声未发现异常。由于担心利伐沙班会诱发肝毒性,改为口服马罗匹坦(2 mg/kg,q24 h),并停用利伐沙班。
该犬在家中一直厌食,在上次就诊5天后(D20)再次就诊。实验室检查显示出现肝病(ALT 2035 IU/L;总胆红素0.7 mg/dL)。随后住院7天(D21-27)。
住院期间的检查显示轻度血小板减少,血液无高凝迹象。餐前胆汁酸和氨均在正常范围内。腹部超声检查显示肝脏无明显变化。胆汁样本在细胞学上无异常。肝脏细胞学检查显示肝细胞不典型性伴有糖原空泡变化,符合毒素损伤。
住院期间每天静脉注射50 mL/kg 0.45%氯化钠和氯化钾。接受了昂丹司琼(0.5 mg/kg静脉注射,q8h)、马罗匹坦(1 mg/kg静脉注射,q24h)和卡泊洛林(3 mg/kg静脉注射,q24h)治疗。还使用N-乙酰半胱氨酸(起始剂量140 mg/kg静脉注射,70 mg/kg维持,q6h)和乌索地尔(5 mg/kg口服,q12h)以支持肝脏。
在获得肝脏和胆汁细胞学结果后,还分别在住院第4天和第5天(D24和D25)使用恩诺沙星(10 mg/kg静脉注射,q24h)和氨苄西林/舒巴坦(30 mg/kg静脉注射,q8h)。由于在接受抗恶心治疗后仍持续厌食,增加了昂丹司琼的剂量(1 mg/kg静脉注射,q8h),并使用甲氧氯普胺CRI(起始剂量1 mg/kg静脉注射,2 mg/kg/天维持)。
随着时间的推移,肝脏数值有所改善,但仍然厌食。插上鼻饲管喂养后食欲慢慢好转,出院时已经能吃少量食物。出院时肝脏数值明显好转(ALT 600;总胆红素0.3)。出院时服用了曲唑酮、加巴喷丁、昂丹司琼、地那米林、米氮平和阿莫西林/克拉维酸。
回家后食欲开始好转,但主人无法给它服用处方药。出院后一周复查结果显示其各项数值轻微改善(D39)。
第71天复查食欲明显好转,其他方面也表现良好。肝脏数值明显改善。超声心动图与之前相比没有变化。
第112天复查肝脏数值已恢复到基线水平(下图)。然而该犬因进行性肺动脉高压导致右侧充血性心力衰竭,目前正在接受呋塞米、匹莫溴丹和螺内酯等药物治疗。
05 讨论
利伐沙班是一种人体特异性Xa因子抑制剂,用于预防和治疗血栓形成[1,2]。Xa因子抑制剂针对凝血级联的内在和外在途径,从而减少凝血酶并最终减少血栓形成[3]。利伐沙班可竞争性抑制游离的和与血凝块结合的Xa因子,并抑制凝血酶酶原活性,因此是一种强效的口服抗凝剂[4]。
在人体中,利伐沙班和其他Xa因子抑制剂有许多已获批准的适应症,包括减少房颤患者的中风、治疗深静脉血栓和肺栓塞以及术后预防[5]。虽然利伐沙班是一种有效的抗凝剂,但在人体中也出现过明显的不良反应,包括出血、腹部不适、背痛、厌食、发热和肝功能衰竭[3,6-9]。
在兽医领域,利伐沙班被用于犬和猫的抗凝治疗[1,10]。血栓形成风险较高的患者包括患有免疫介导性溶血性贫血、蛋白丢失性肾病或心丝虫病的犬以及患有心肌病的猫。然而,还有许多其他疾病也需要使用抗凝药物[10-12]。
虽然兽医学中使用的抗凝药物很多,但缺乏有关具体治疗方案的循证建议[13]。目前,犬口服利伐沙班的推荐剂量为1-2 mg/kg/天[13]。利伐沙班对犬安全且耐受性良好,仅有轻微出血和呕吐的不良反应报告[1,14,15]。
不过应该指出的是,与人类相比,兽医患者总体安全性和耐受性的证据仍相当有限,因为这些研究数量有限且样本量较小。与人类不同,以往还没有关于犬服用利伐沙班会出现肝毒性的报道。
尽管有人提出了直接毒性、特异性和免疫学机制[6,9,20],但目前尚不清楚利伐沙班治疗后损伤的确切机制。在急性利伐沙班肝毒性患者中,肝细胞性肝病最为常见,但也有胆汁淤积性和混合性肝病的报道[6,7,21]。
在一项研究中,高达55%的Xa因子诱导的肝毒性病例被定性为肝细胞性肝炎[7]。本报告中的狗出现了严重的肝细胞性肝病,细胞学检查结果符合中毒性损伤。在人类研究中,利伐沙班引起的肝毒性病例中也经常出现血清总胆红素升高的现象[7,21,22]。虽然本病例的总胆红素轻度升高,但随着肝病的发生,总胆红素也轻度升高,停用利伐沙班后情况有所改善。
本报告中的犬在开始服用利伐沙班15天后首次在实验室检查中发现肝病。厌食和嗜睡的临床症状大约始于第9天。Licata等人[7]报告称,从开始治疗到肝损伤发生的时间为2-180天,中位数约为15天,这与本病例相符。
利伐沙班用药导致肝病的最特异性指标是停药后病情好转[6,23,24]。虽然有关异常的实验室检查结果缓解时间的前瞻性数据有限,但多份病例报告指出,停用利伐沙班2-4周后,肝酶明显改善[6,22-25]。
在本报告的犬中,肝病在利伐沙班停药8周后完全缓解。但在停药4周后也有明显好转的记录。不能完全排除已有的亚临床肝病改变了这种药物的代谢和排出过程,导致肝毒性倾向增加的可能性。
虽然所有Xa因子抑制剂都与肝毒性病例有关,但根据最近的研究[6,18,19,21,22,26],利伐沙班可能是最常见的一种。一份病例报告指出,在停用利伐沙班并开始使用类似的Xa因子抑制剂阿哌沙班后,严重肝病得到了改善[22]。
另一份报告显示,患者从利伐沙班转用亭扎肝素后也有类似的结果[27]。由于缺乏有关在兽医中使用Xa因子抑制剂的总体数据,因此尚不确定利伐沙班诱发肝毒性的患者是否能够耐受该类药物中的另一种药物。
改用另一种Xa因子抑制剂可能是一种有效的替代治疗方案。在本病例中,在与主人讨论后,考虑到没有诊断证据表明该犬目前处于高凝状态,而且主人担心会出现潜在的不良反应,因此决定不采用其他抗血栓治疗方法。
总之,这是首例疑似利伐沙班诱发犬肝中毒的病例报告。本病例为提倡对接受Xa因子抑制剂治疗的犬进行更好、更密切的监测提供了先例。应监测服用利伐沙班的犬是否出现与肝毒性相符的临床症状和实验室检查变化。在没有其他可确定原因的疑似肝中毒病例中,应进行风险效益分析,并考虑停止使用利伐沙班或使用替代抗血栓药物。
参考文献
1. Conversy, B, Blais, MC, Dunn, M, Gara-Boivin, C, and Del Castillo, JRE. Anticoagulant activity of oral rivaroxaban in healthy dogs. Vet J. (2017) 223:5–11.
2. Kvasnicka, T, Malikova, I, Zenahlikova, Z, Kettnerova, K, Brzezkova, R, Zima, T, et al. Rivaroxaban—metabolism, pharmacologic properties and drug interactions. Curr Drug Metab. (2017) 18:636–42.
3. Turpie, AG. Oral, direct factor Xa inhibitors in development for the prevention and treatment of thromboembolic diseases. Arterioscler Thromb Vasc Biol. (2007) 27:1238–47.
4. Samama, MM. The mechanism of action of rivaroxaban–an oral, direct factor Xa inhibitor–compared with other anticoagulants. Thromb Res. (2011) 127:497–504.
5. McCarty, D, and Robinson, A. Factor Xa inhibitors: a novel therapeutic class for the treatment of nonvalvular atrial fibrillation. Ther Adv Cardiovasc Dis. (2016) 10:37–49.
6. Liakoni, E, Rätz Bravo, AE, and Krähenbühl, S. Hepatotoxicity of new Oral anticoagulants (NOACs). Drug Saf. (2015) 38:711–20.
7. Licata, A, Puccia, F, Lombardo, V, Serruto, A, Minissale, MG, Morreale, I, et al. Rivaroxaban-induced hepatotoxicity: review of the literature and report of new cases. Eur J Gastroenterol Hepatol. (2018) 30:226–32.
8. Caldeira, D, Barra, M, Santos, AT, de Abreu, D, Pinto, FJ, Ferreira, JJ, et al. Risk of drug-induced liver injury with the new oral anticoagulants: systematic review and meta-analysis. Heart. (2014) 100:550–6.
9. LiverTox (2012). Clinical and research information on drug-induced liver injury. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases.
10. deLaforcade, A, Bacek, L, Blais, MC, Goggs, R, Lynch, A, and Rozanski, E. Consensus on the rational use of Antithrombotics in veterinary critical care (CURATIVE): domain 1-defining populations at risk. J Vet Emerg Crit Care. (2019) 29:37–48.
11. deLaforcade, A, Bacek, L, Blais, MC, Boyd, C, Brainard, BM, Chan, DL, et al. 2022 update of the consensus on the rational use of Antithrombotics and Thrombolytics in veterinary critical care (CURATIVE) domain 1-defining populations at risk. J Vet Emerg Crit Care. (2022) 32:289–314.
12. Goggs, R, Bacek, L, Bianco, D, Koenigshof, A, and Li, RHL. Consensus on the rational use of Antithrombotics in veterinary critical care (CURATIVE): domain 2-defining rational therapeutic usage. J Vet Emerg Crit Care. (2019) 29:49–59.
13. Blais, MC, Bianco, D, Goggs, R, Lynch, AM, Palmer, L, Ralph, A, et al. Consensus on the rational use of Antithrombotics in veterinary critical care (CURATIVE): domain 3-defining antithrombotic protocols. J Vet Emerg Crit Care. (2019) 29:60–74.
14. Sharp, CR, deLaforcade, AM, Koenigshof, AM, Lynch, AM, and Thomason, JM. Consensus on the rational use of Antithrombotics in veterinary critical care (CURATIVE): domain 4-refining and monitoring antithrombotic therapies. J Vet Emerg Crit Care. (2019) 29:75–87.
15. Evans, LA, Tansey, C, Wiebe, M, Sloan, CQ, Patlogar, JE, Northcutt, S, et al. A prospective evaluation of rivaroxaban on haemostatic parameters in apparently healthy dogs. Vet Med Sci. (2019) 5:317–24.
16. Tracy, AL, Goggs, R, Brooks, MB, and Lynch, AM. Clinical features and posttreatment monitoring of dogs administered rivaroxaban (2018-2020): 19 cases. J Vet Emerg Crit Care. (2022) 32:629–36.
17. Russmann, S, Niedrig, DF, Budmiger, M, Schmidt, C, Stieger, B, Hürlimann, S, et al. Rivaroxaban postmarketing risk of liver injury. J Hepatol. (2014) 61:293–300.
18. Björnsson, HK, Gudmundsson, DO, and Björnsson, ES. Liver injury caused by oral anticoagulants: a population-based retrospective cohort study. Liver Int. (2020) 40:1895–900.
19. Raschi, E, Poluzzi, E, Koci, A, Salvo, F, Pariente, A, Biselli, M, et al. Liver injury with novel oral anticoagulants: assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system. Br J Clin Pharmacol. (2015) 80:285–93.
20. Peverelle, M, Asadi, K, and Sinclair, M. Drug-induced liver failure due to rivaroxaban. Ann Hematol. (2018) 97:2267–8.
21. Watkins, PB, Desai, M, Berkowitz, SD, Peters, G, Horsmans, Y, Larrey, D, et al. Evaluation of drug-induced serious hepatotoxicity (eDISH): application of this data organization approach to phase III clinical trials of rivaroxaban after total hip or knee replacement surgery. Drug Saf. (2011) 34:243–52.
22. Anastasia, EJ, Rosenstein, RS, Bergsman, JA, and Parra, D. Use of apixaban after development of suspected rivaroxaban-induced hepatic steatosis; a case report. Blood Coagul Fibrinolysis. (2015) 26:699–702.
23. Lambert, A, Cordeanu, M, Gaertner, S, Nouri, S, Alt, M, and Stephan, D. Rivaroxaban-induced liver injury: results from a venous thromboembolism registry. Int J Cardiol. (2015) 191:265–6.
24. Liakoni, E, Rätz Bravo, AE, Terracciano, L, Heim, M, and Krähenbühl, S. Symptomatic hepatocellular liver injury with hyperbilirubinemia in two patients treated with rivaroxaban. JAMA Intern Med. (2014) 174:1683–6.
25. Barrett, P, Vuppalanchi, R, Masuoka, H, and Chalasani, N. Severe drug-induced skin and liver injury from rivaroxaban. Dig Dis Sci. (2015) 60:1856–8.
26. Alonso, A, MacLehose, RF, Chen, LY, Bengtson, LG, Chamberlain, AM, Norby, FL, et al. Prospective study of oral anticoagulants and risk of liver injury in patients with atrial fibrillation. Heart. (2017) 103:834–9.
27. Marrinan, A, Shackleton, L, Kelly, C, Lavin, M, Glavey, S, Murphy, P, et al. Liver injury during rivaroxaban treatment in a patient with AL amyloidosis. Eur J Clin Pharmacol. (2021) 77:1073–6.
28. Georgiev, KD, Hvarchanova, N, Stoychev, E, and Kanazirev, B. Prevalence of polypharmacy and risk of potential drug-drug interactions among hospitalized patients with emphasis on the pharmacokinetics. Sci Prog. (2022) 105:003685042110701.
29. McCormack, R, Olley, L, Glanemann, B, and Swann, JW. Prospective observational study of the use of omeprazole and maropitant citrate in veterinary specialist care. Sci Rep. (2020) 10:15727.