
| 一般情况 | |
|---|---|
 | 品种:德国牧羊犬 |
| 年龄:3岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:神经念珠菌病 | |
01 主诉及病史
3天前出现精神异常、颈部疼痛和共济失调。
2个月前曾因子宫蓄脓进行了卵巢切除术。没有对子宫进行组织病理学检查或培养。该犬长期以来一直有零星呕吐或腹泻病史,怀疑与食物不耐受有关,但并未进行相关检查。
02 检查
皮肤粘膜呈粉红色,毛细血管再充盈时间正常,呼吸频率正常,股动脉脉搏强度正常,体温正常。腹部触诊无异常,淋巴结大小正常。心率为100 bpm,但听诊时偶尔会发现不规则的心跳。该犬身体状况评分较低(1/9)。
经神经专科医师检查后发现,该犬精神萎靡,右侧转头,四肢瘫痪,四肢姿势反应减弱,颈部疼痛,其余部位无异常。精神异常和转头提示大脑或脑干受累,颈部疼痛和不能行走提示C1-C5脊髓节段受累。根据病史和神经系统检查,怀疑炎症性、感染性或肿瘤性病因的可能性最大。
除轻度淋巴细胞减少和中度血小板减少外,血液学检查正常,但细胞学检查可见血小板结块,因此血小板数量可能充足。血生化异常包括球蛋白轻度升高、轻度高钠血症、轻度高磷血症、轻度尿毒症、肝酶活性轻度升高、胆固醇和甘油三酯轻度降低。
测量钴胺素和叶酸的原因是该犬有胃肠道疾病史且身体状况评分较低。钴胺素和叶酸的值均在参考区间内。第1天测量的基础皮质醇为384 nmol/L [<125],排除了肾上腺皮质功能减退的可能。
超声心动图显示轻度收缩功能障碍,舒张期心室尺寸轻度增大,左心房尺寸正常,二尖瓣和三尖瓣功能不全。心电图显示阵发性室性心动过速。血液中的心肌肌钙蛋白浓度升高(13.3 ng/mL [<0.15])。
胸片检查正常。腹部超声显示脾脏外观斑驳,与髓外造血或结节性增生最为吻合。双侧髂内侧淋巴结肿大,很可能是继发于近期子宫蓄脓和卵巢切除术的反应性淋巴结增生。
尿液分析显示尿液比重为1.011,尿蛋白与肌酐的比值升高(1.4 [<0.2])。尿沉渣分析未发现异常。尿培养呈阴性。
MRI检查结果显示其前脑内有多灶、小而圆的轴内病变。病变在T2W和FLAIR图像上呈高密度。在T1W图像上呈等密度,对比度均匀增强(下图)。没有肿块效应。
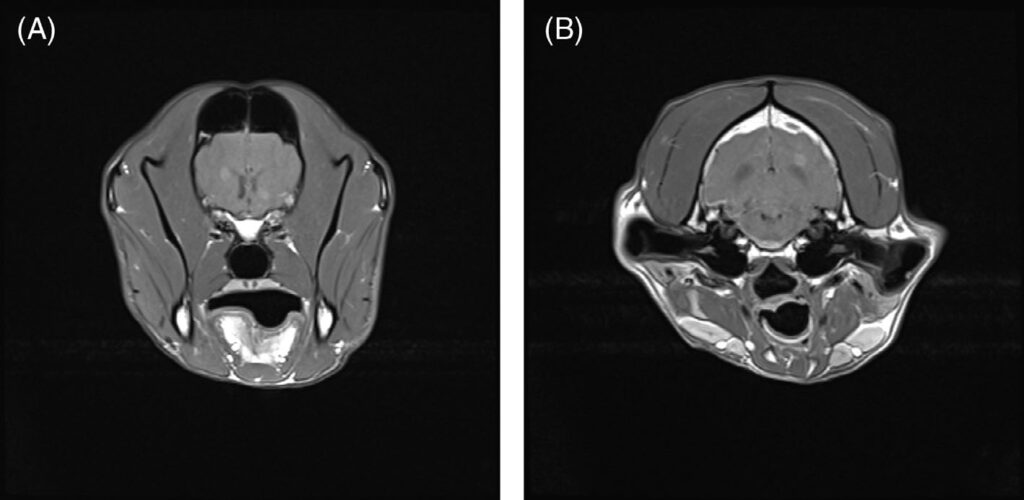
颈部MRI成像显示,从C2的尾部到C4的颅部存在髓内T2W高密度。病灶在T1W图像上呈等密度。从小脑髓质贮水池采集了脑脊液样本,分析表明样本中存在严重的多细胞现象(有核细胞9200个细胞/μL [<5]),总蛋白增加(671 mg/dL [<30])。
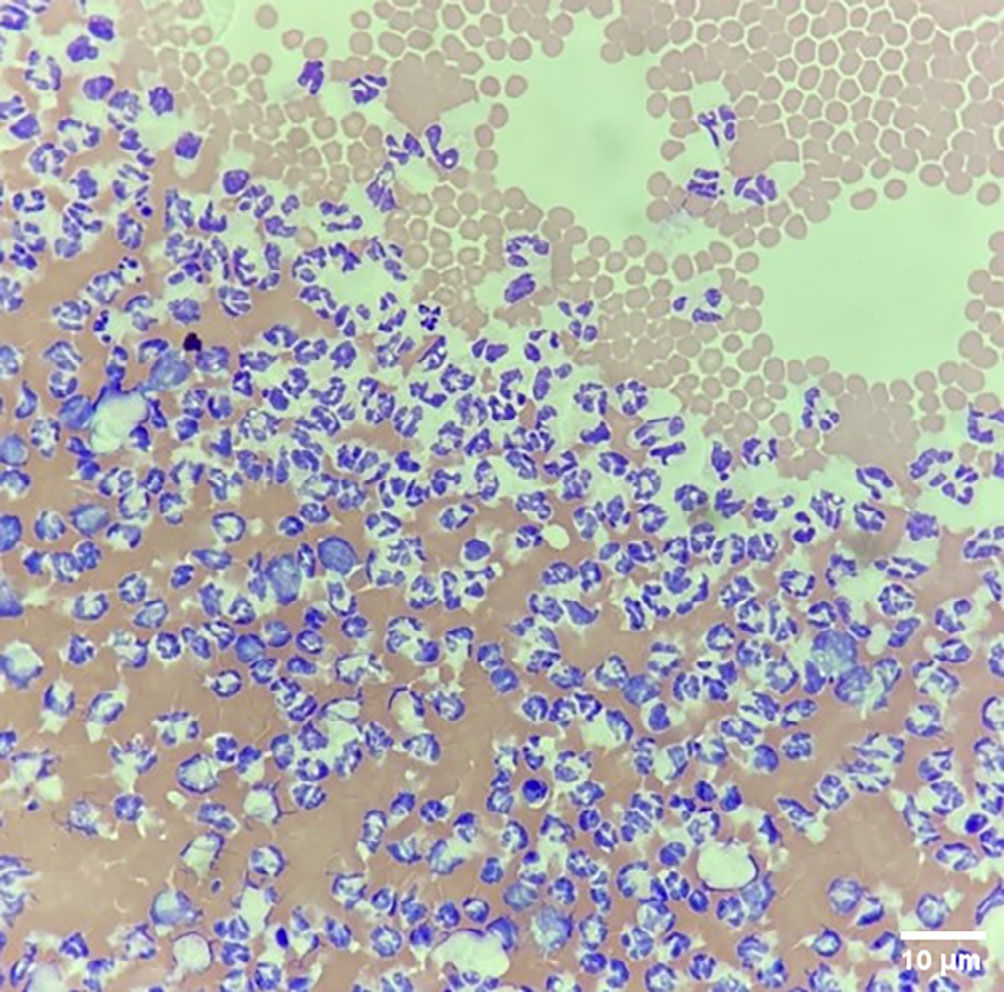
脑脊液细胞学检查显示,炎症细胞主要为非变性中性粒细胞(95%),混有少量淋巴细胞和少量大单核细胞。少量中性粒细胞含有被吞噬的浅黄色结晶物质(类血红蛋白)。背景呈浅粉色,含有大量红细胞和少量浅黄色结晶物质。未发现感染性生物(下图)。脑脊液的需氧、厌氧和霉菌培养均为阴性。
为排除感染性疾病,还进行了进一步检测,包括曲霉菌、黄曲霉、黑曲霉、赤曲霉、利什曼原虫、弓形虫IgM、弓形虫IgG、犬新孢子虫、钩端螺旋体、阿那普拉斯原虫、鲍氏杆菌和犬埃希菌的血清学抗体检测,结果均为阴性。巴顿氏菌和SARS-COV-2的PCR检测呈阴性。胰蛋白酶样免疫反应、维生素B12和叶酸浓度均在正常范围内。
03 治疗
根据检测结果,怀疑是免疫介导的脑脊髓炎和心肌炎。MRI后立即接受了泼尼松龙(2 mg/kg PO q24h)、匹莫溴丹(0.3 mg/kg PO q12h)、美西雷定(4 mg/kg PO q8h)、索他洛尔2 mg/kg PO q12h)、美沙酮(0.1-0.2 mg/kg q6h)以及输液治疗。
在开始治疗后的48小时内,临床症状有所改善,可以行走,颈部疼痛也有所缓解。但该犬仍处于萎靡状态,心律失常有所改善,但并未缓解。
04 复查
第7天、第9天和第13天再次进行血液化验、生化检查和心肌肌钙蛋白检测。主要结果是氮质血症、白细胞增多(中性粒细胞增多)和心肌肌钙蛋白浓度逐渐恶化。第12天,神经症状明显恶化,再次无法行走,并出现静止性眼球震颤。
第13天再次进行超声心动图检查,发现少量心包积液,室间隔增厚,呈异质低回声灶,提示局部浸润性疾病。
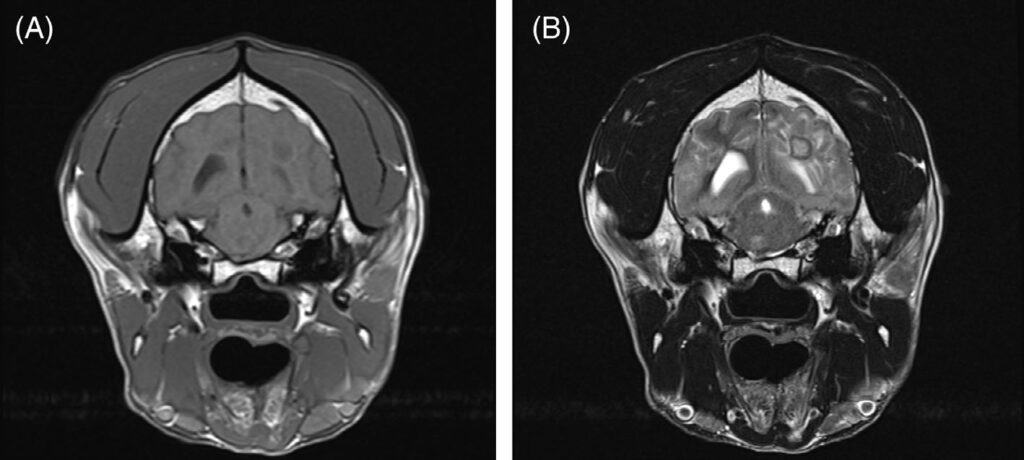
第二次脑部MRI发现轴内多发、靶样结节性病变散布在整个脑实质内。这些病灶的外观各不相同。一些病灶的外缘为T2W/FLAIR高密度,中心为低密度,而另一些病灶的中心为T2W/FLAIR高密度,外缘为低密度(下图)。在T1W预对比图像上,这些病灶呈弥漫性低密度,并伴有模糊的高密度边缘。右侧和左侧嗅叶的T2*出现多灶性磁感伪影。颞肌内有多灶性T2W、FLAIR、T1W高强结节。
第二次的脑脊液分析显示有严重的多细胞现象(有核细胞1120个/μL [<5]),总蛋白增加(1058 mg/dL [<30])。细胞学检查结果显示,炎症细胞主要为非变性中性粒细胞(75%)、空泡化巨噬细胞(21%)和小的成熟淋巴细胞(4%)。大多数巨噬细胞表现为红细胞吞噬,并含有适量的蓝黑色色素(血色素)和黄色斜方形结晶(类血色素)。未发现感染性病原体。脑脊液的需氧、厌氧和霉菌培养均为阴性。
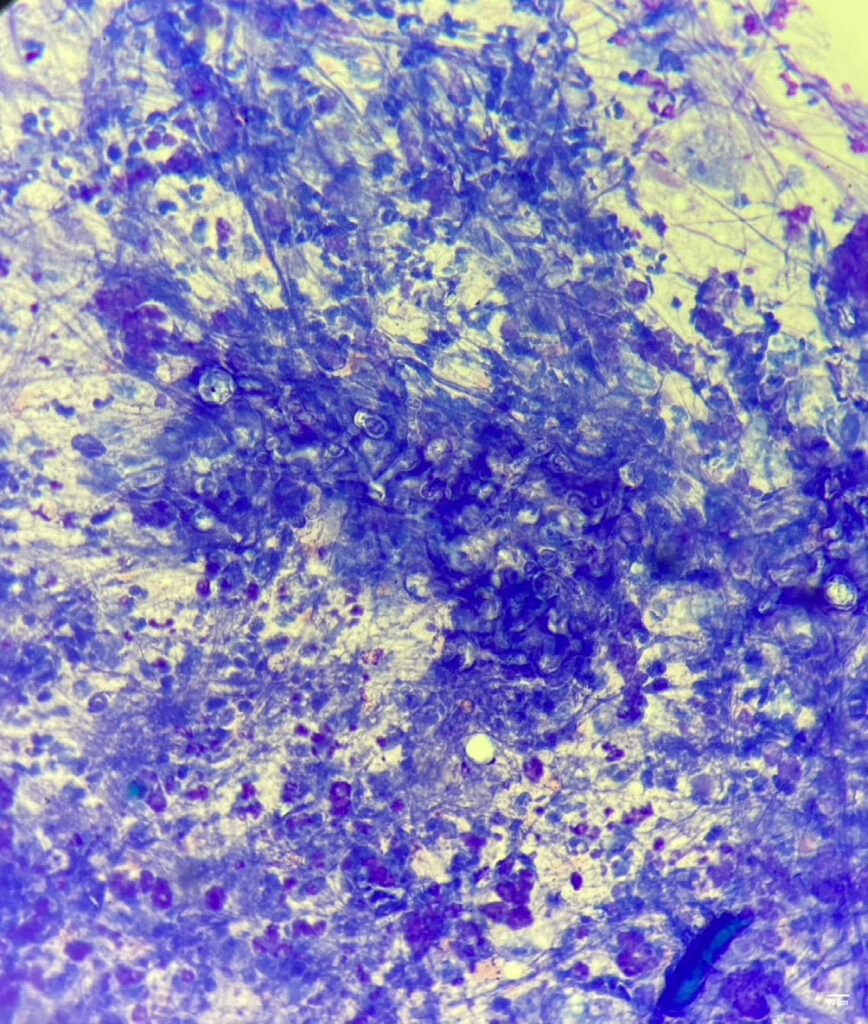
从颞肌结节中抽取的细针吸出物细胞学检查显示,中性粒细胞炎症伴有透明丝孢霉病(下图)。
根据这一检测结果,怀疑是全身真菌感染。在这一阶段,基于对预后的担忧,主人选择了安乐死。
05 尸检
该犬患有严重的全身性化脓性至肉芽肿性和坏死性炎症,影响脾脏、肾脏、肾上腺和淋巴结、心脏、胰腺和大脑皮质(下图)。

这些变化伴随着严重的血管炎和大量的腔内真菌菌丝(下图)。符合严重的全身性真菌感染。
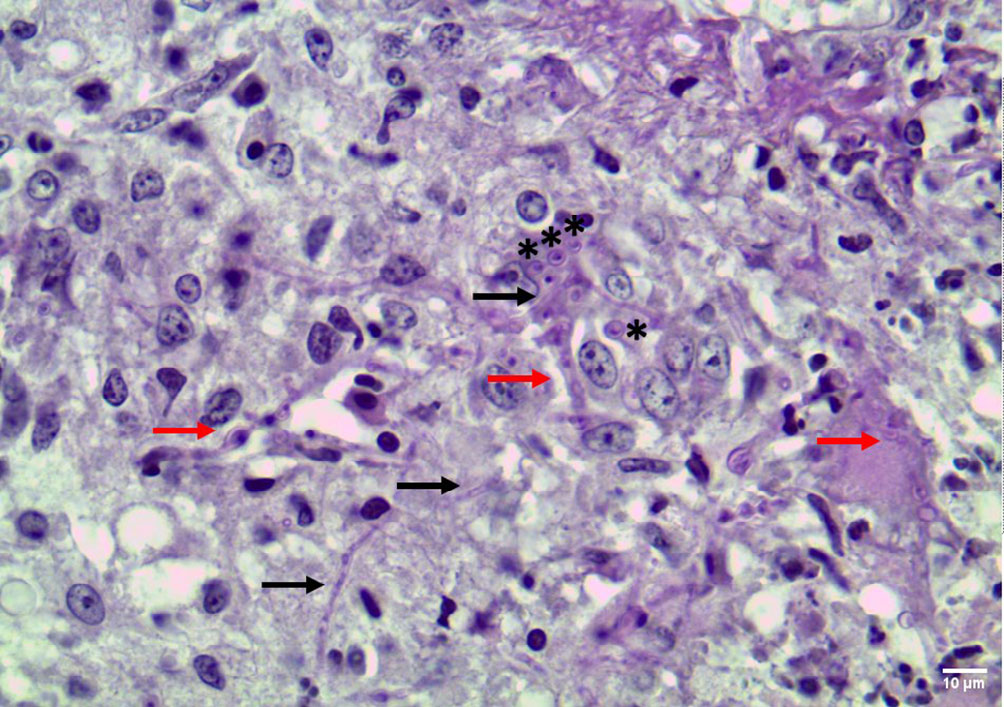
脑、肾和心脏组织分离出了白色念珠菌(Candida albicans)。
06 讨论
犬的全身性念珠菌病非常罕见,兽医文献中仅有零星病例报道[1-8]。既往报告描述了两只患有神经念珠菌病的狗[9],神经念珠菌病是指中枢神经系统受累的全身性念珠菌病。在这两只狗中,脑组织病理学病变的特点是肉芽肿性或脓毒血症性坏死性脑膜脑炎,并伴有区域内真菌[9]。本病例报告描述了一只患有神经念珠菌病的3岁德国牧羊犬的临床表现和诊断结果。
据报道,人类神经念珠菌病的发病有多种危险因素,如免疫抑制性疾病[10]、曾接受抗生素或皮质类固醇治疗[11,12]、存在血管内导管[12]、近期腹部手术[12,13]、早产新生儿[14]、近期神经外科手术[15]和静脉注射药物[16]。
迄今为止,除1只狗[8]外,所有患有全身性念珠菌病的狗都有易感因素。诱发因素包括犬细小病毒[1]、肾上腺皮质功能亢进合并糖尿病[2]、抗生素治疗[3,4]、腹膜炎[8,10]和肠系膜肥大细胞瘤转移[5]。
免疫抑制是之前报道的两只患有神经念珠菌病[9]的狗的致病因素。本病例报告中的犬可能的诱发因素包括近期因子宫蓄脓进行腹部手术、使用抗生素或潜在的免疫缺陷,如之前在德国牧羊犬中的报道[17-21]。
除部分大肠正常外,未对消化道进行组织病理学检查。由于胃肠道的组织学检查结果有限,因此无法确定导致该犬胃肠道症状的根本原因。胆固醇和甘油三酯浓度下降很可能是消化道吸收不良或全身炎症造成的。
该病例一开始的确诊相当困难,因为在第一次评估时细胞学检查和脑脊液培养均未检测到微生物。细菌培养阴性并不能排除细菌性脑膜脑炎,因为超过62%的病例会出现假阴性[36]。
第二次MRI扫描时在颞肌上看到的病变细胞学结果让人怀疑是全身性真菌病。念珠菌病的明确诊断需要通过细胞学或组织病理学检查发现病原体,并通过培养加以确认[37]。该犬在尸检时从不同器官中采集的组织均培养出了白色念珠菌。
中枢神经系统受累的全身性真菌病是一个重要的鉴别依据,因为德国牧羊犬易患真菌病[25]。这种易感性可能是由潜在的遗传性免疫缺陷引起的[17-21,25,38]。影响德国牧羊犬中枢神经系统的真菌病有多种类型[39],其中曲霉菌病最常见[25]。但即使曲霉菌病的血清学检测结果为阴性也不能排除全身性曲霉菌病的可能性[38]。由于本病例的尿液和脑脊液的真菌培养均为阴性,因此认为不太可能是全身性真菌病。本病例报告的局限性在于没有进行真菌血液培养。
神经念珠菌病在犬中是一种罕见疾病,对本病例报告中的犬进行明确诊断具有挑战性。在人类中也有类似的挑战。提高人们对这种疾病的认识有望早诊断和早治疗。
文献来源:Royaux E, Corbetta D, Czerwiñska M, Gosling F, Genain MA. Clinicopathological and diagnostic imaging findings in a dog with neurocandidiasis. J Vet Intern Med. 2024 May 20.
参考文献
1. Rodríguez F, Fernández A, Espinosa de los Monteros A, Wohlsein P, Jensen HE. Acute disseminated candidiasis in a puppy associated with parvoviral infection. Vet Rec. 1998; 142(16): 434-436.
2. Heseltine JC, Panciera DL, Saunders GK. Systemic candidiasis in a dog. J Am Vet Med Assoc. 2003; 223(6): 821-824.
3. Brown MR, Thompson CA, Mohamed FM. Systemic candidiasis in an apparently immunocompetent dog. J Vet Diagn Invest. 2005; 17(3): 272-276.
4. Kuwamura M, Ide M, Yamate J, Shiraishi Y, Kotani T. Systemic candidiasis in a dog, developing spondylitis. J Vet Med Sci. 2006; 68(10): 1117-1119.
5. Matsuda K, Sakaguchi K, Kobayashi S, et al. Systemic candidiasis and mesenteric mast cell tumor with multiple metastases in a dog. J Vet Med Sci. 2009; 71(2): 229-232.
6. Rogers CL, Gibson C, Mitchell SL, Keating JH, Rozanski EA. Disseminated candidiasis secondary to fungal and bacterial peritonitis in a young dog. J Vet Emerg Crit Care. 2009; 19(7): 193-198.
7. Ong RKC, Raisis AL, Swindells KL. Candida albicans peritonitis in a dog. J Vet Emerg Crit Care. 2010; 20(1): 143-147.
8. Willems N, Houwers DJ, Schlotter YM, Theelen B, Boekhout T. Disseminated candidiasis in a young, previously healthy, dog and review of literature. Mycopathologia. 2017; 182(5-6): 591-596.
9. de Souto EPF, Frades MTS, Borges IL, et al. Cerebral Candida albicans infection in two dogs. Acta Sci Vet. 2018; 46: 6.
10. DeVita VT, Utz JP, Williams T, Carbone PP. Candida meningitis. Arch Intern Med. 1966; 117(4): 527-535.
11. Bayer AS, Edwards JE, Seidel JS, Guze LB. Candida meningitis. Report of seven cases and review of the english literature. Medicine (Baltimore). 1976; 55(6): 477-486.
12. Parker JC, McCloskey JJ, Lee RS. Human cerebral candidosis—a postmortem evaluation of 19 patients. Hum Pathol. 1981; 12(1): 23-28.
13. Walsh TJ, Hier DB, Caplan LR. Fungal infections of the central nervous system: comparative analysis of risk factors and clinical signs in 57 patients. Neurology. 1985; 35(11): 1654-1657.
14. Faix RG. Systemic Candida infections in infants in intensive care nurseries: high incidence of central nervous system involvement. J Pediatr. 1984; 105(4): 616-622.
15. Nguyen MH, Yu VL. Meningitis caused by Candida species: an emerging problem in neurosurgical patients. Clin Infect Dis. 1995; 21(2): 323-327.
16. Kantor HL, Emsellem HA, Hogg JE, Simon GL. Candida albicans meningitis in a parenteral drug abuser. South Med J. 1984; 77(3): 404-405.
17. Day MJ, Eger CE, Shaw SE, Penhale WJ. Immunologic study of systemic aspergillosis in German shepherd dogs. Vet Immunol Immunopathol. 1985; 9(4): 335-347.
18. Day MJ, Penhale WJ, Kabay MJ, et al. Disseminated aspergillosis in dogs. Aust Vet J. 1986; 63(2): 55-59.
19. Day MJ, Penhale WJ. Humoral immunity in disseminated Aspergillus terreus infection in the dog. Vet Microbiol. 1988; 16(3): 283-294.
20. Day MJ, Penhale WJ. Serum immunoglobulin a concentrations in normal and diseased dogs. Res Vet Sci. 1988; 45(3): 360-363.
21. Day MJ, Penhale WJ. An immunohistochemical study of canine disseminated aspergillosis. Aust Vet J. 1991; 68(12): 383-386.
22. Sánchez-Portocarrero J, Pérez-Cecilia E, Corral O, Romero-Vivas J, Picazo JJ. The central nervous system and infection by Candida species. Diagn Microbiol Infect Dis. 2000; 37(3): 169-179.
23. Lipton SA, Hickey WF, Morris JH, Loscalzo J. Candidal infection in the central nervous system. Am J Med. 1984; 76(1): 101-108.
24. Lai PH, Lin SM, Pan HB, Yang CF. Disseminated miliary cerebral candidiasis. AJNR Am J Neuroradiol. 1997; 18(7): 1303-1306.
25. Taylor AR, Young BD, Levine GJ, et al. Clinical features and magnetic resonance imaging findings in 7 dogs with central nervous system aspergillosis. J Vet Intern Med. 2015; 29(6): 1556-1563.
26. Tolbert A, Weyna A, Sakamoto K, Perlini M, Platt S. Magnetic resonance imaging and pathological characteristics of Cladophialophora encephalitis in a young dog. Vet Rec Case Rep. 2022; 11(1): 520.
27. Kelley A, Stainback L, Knowles K, Moore T, Plummer S, Shoup O. Clinical characteristics, magnetic resonance imaging features, treatment, and outcome for presumed intracranial coccidioimycosis in 45 dogs (2009-2019). J Vet Intern Med. 2021; 35(5): 2222-2231.
28. Diangelo L, Cohen-Gadol A, Gan Heng H, et al. Glioma mimics: magnetic resonance imaging characteristics of granulomas in dogs. Front Vet Sci. 2019; 6: 286.
29. Pendlebury WW, Perl DP, Munoz DG. Multiple microabscesses in the central nervous system: a clinicopathologic study. J Neuropathol Exp Neurol. 1989; 48(3): 290-300.
30. Baley JE, Kliegman RM, Fanaroff AA. Disseminated fungal infections in very low-birth-weight infants: clinical manifestations and epidemiology. Pediatrics. 1984; 73(2): 144-152.
31. Chaabane M, Krifa H, Ladeb MF, et al. Cerebral candidiasis. Computed tomography appearance. Pediatr Radiol. 1989; 19(6–7): 436.
32. Ikeda K, Yamashita J, Fujisawa H, Fujita S. Cerebral granuloma and meningitis caused by Candida albicans: useful monitoring of mannan antigen in cerebrospinal fluid. Neurosurgery. 1990; 26(5): 860-863.
33. Voice RA, Bradley SF, Sangeorzan JA, Kauffman CA. Chronic candidal meningitis: an uncommon manifestation of candidiasis. Clin Infect Dis. 1994; 19(1): 60-66.
34. Tipold A, Schatzberg SJ. An update on steroid responsive meningitis-arteritis. J Small Anim Pract. 2010; 51(3): 150-154.
35. Gonçalves R, De Decker S, Walmsley G, Butterfield S, Maddox TW. Inflammatory disease affecting the central nervous system in dogs: a retrospective study in England (2010-2019). Front Vet Sci. 2021; 8:819945.
36. Rawson F, Foreman M, Mignan T, Galer J, Fraser A, Crawford A. Clinical presentation, treatment, and outcome of 24 dogs with bacterial meningitis or meningoencephalitis without empyema (2010-2020). J Vet Intern Med. 2023; 37(1): 223-229.
37. Greene CE, Chandler FW. Candidiasis and rhodotorulosis. In: CE Greene, FW Chandler, eds. Infectious diseases of the dog and the cat. WB Saunders; 2006: 627-632.
38. Schultz RM, Johnson EG, Wisner ER, Brown NA, Byrne BA, Sykes JE. Clinicopathologic and diagnostic imaging characteristics of systemic aspergillosis in 30 dogs. J Vet Intern Med. 2008; 22(4): 851-859.
39. Lavely J, Lipsitz D. Fungal infections of the central nervous system in the dog and cat. Clin Tech Small Anim Pract. 2005; 20(4): 212-219.