
| 一般情况 | |
|---|---|
 | 品种:夏特尔蓝猫 |
| 年龄:1岁 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:发育性肺病 | |
01 主诉及病史
运动不耐受、张口呼吸和心脏杂音。
该猫在8周大时从饲养者处购买,饲养于单猫家庭,室内活动。
02 治疗
体格检查显示,该猫有IV/VI级左基底全收缩期杂音,心率和肺部听诊正常。
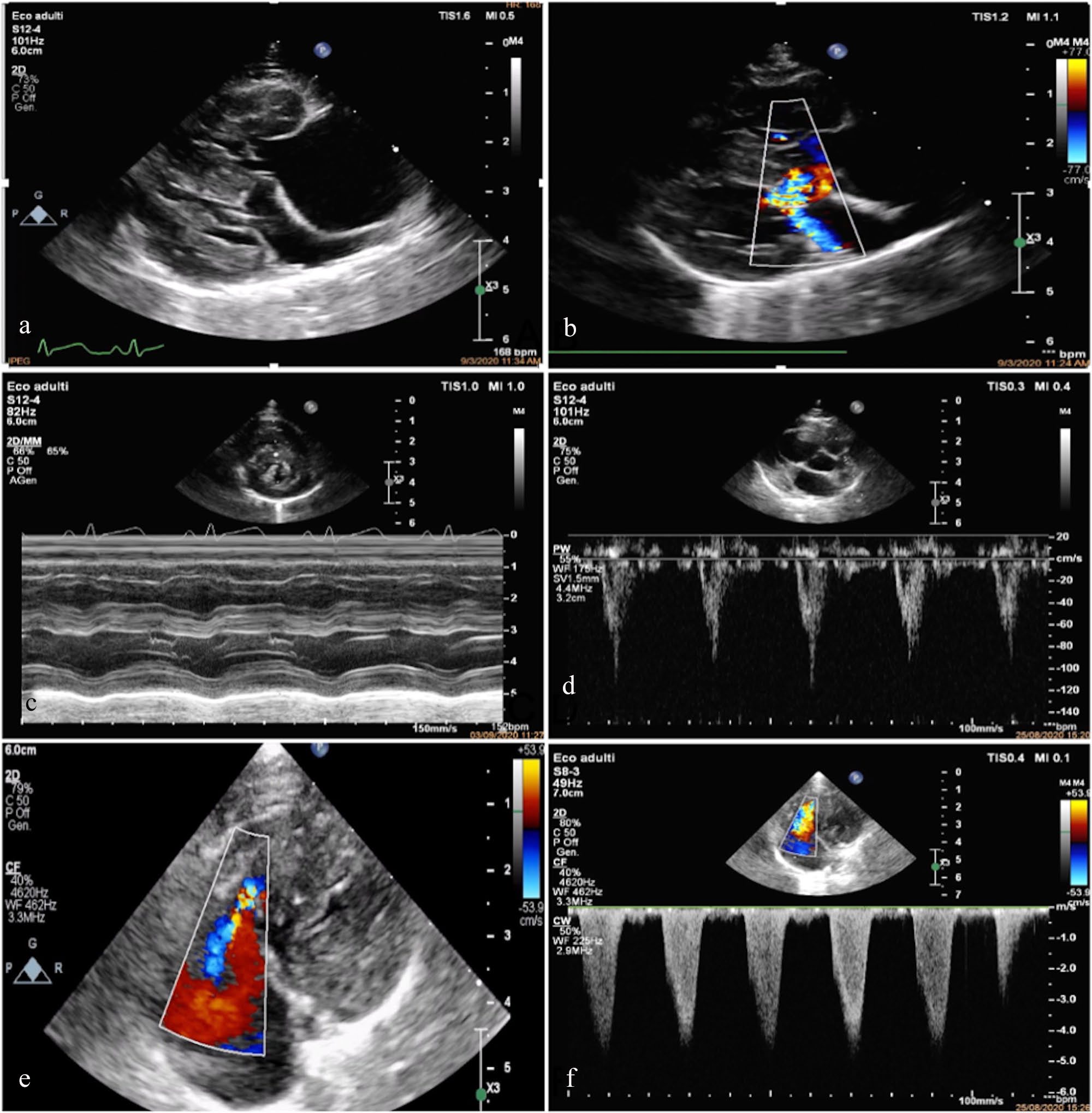
超声心动图显示,右心室严重同心性肥大,右心房中度增大,没有右室间或心底梗阻的迹象,肺动脉瓣解剖结构和肺血流(0.61 m/s)正常,三尖瓣结构性变化极小(瓣叶轻度增厚和拉长,没有明显的弦肌或乳头肌异常),三尖瓣反流速度高(4.5 m/s)。左心室充盈不足,左心室壁厚度不均(舒张末期最大室壁厚度:室间隔5.6 mm,游离壁5.8 mm),室间隔运动矛盾。左心房正常。二尖瓣收缩期前移,主动脉血流呈高速湍急的弯刀状,并伴有高速的二尖瓣反流。未发现心内分流(下图)。这些结果提示重度肺动脉高压。
血生化检查中唯一与临床相关的异常是丙氨酸转氨酶(ALT 241 U/L [16-111])和天冬氨酸转氨酶(AST 62 U/L [9-28])轻度升高。对三份新鲜粪便样本进行了粪便浮选、Baermann试验和血清抗体检测,结果均为阴性。
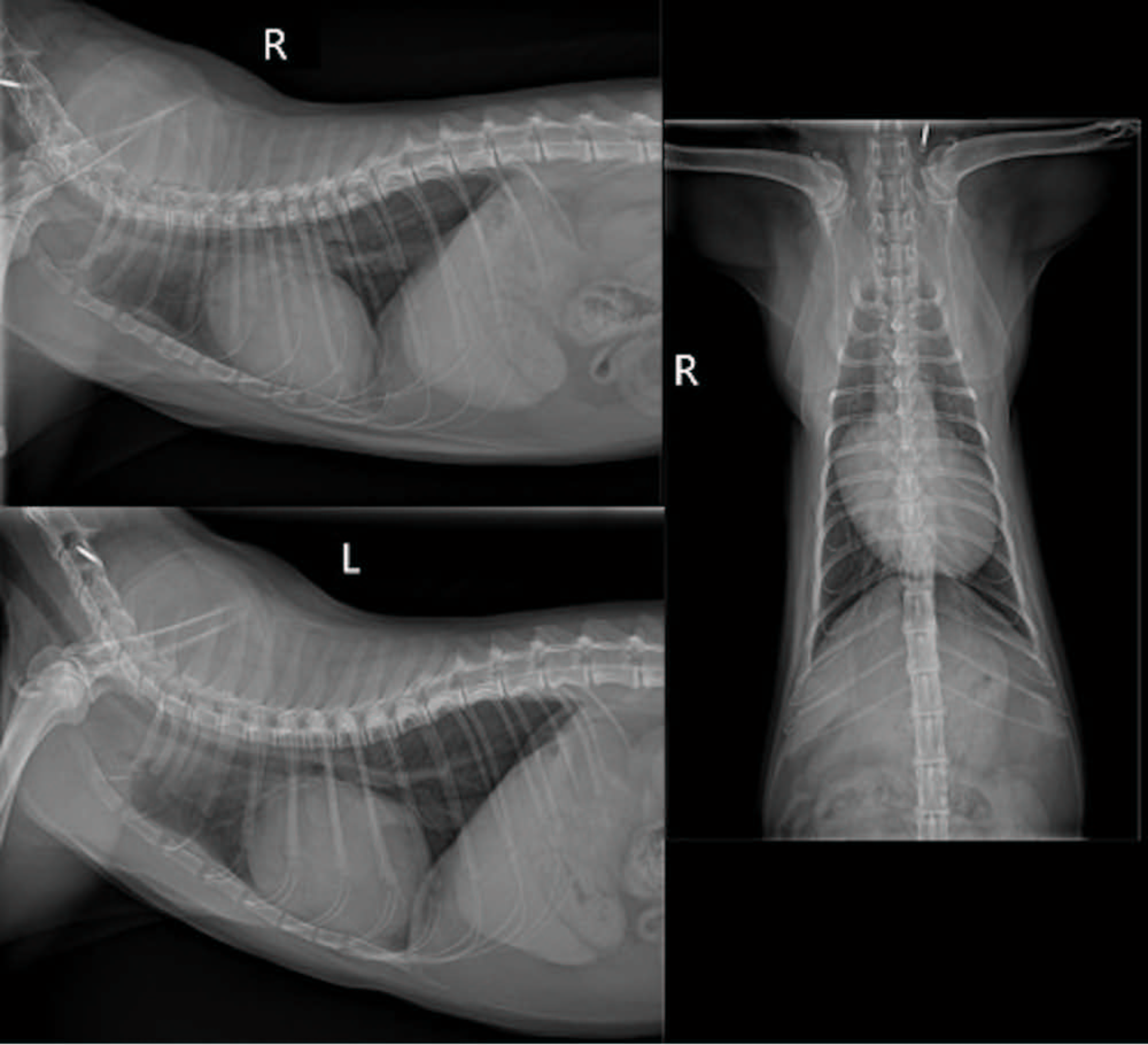
胸片显示肺野正常扩张,肺实质未见异常。观察到心脏轮廓严重增大,但没有明显的肺血管病变(下图)。
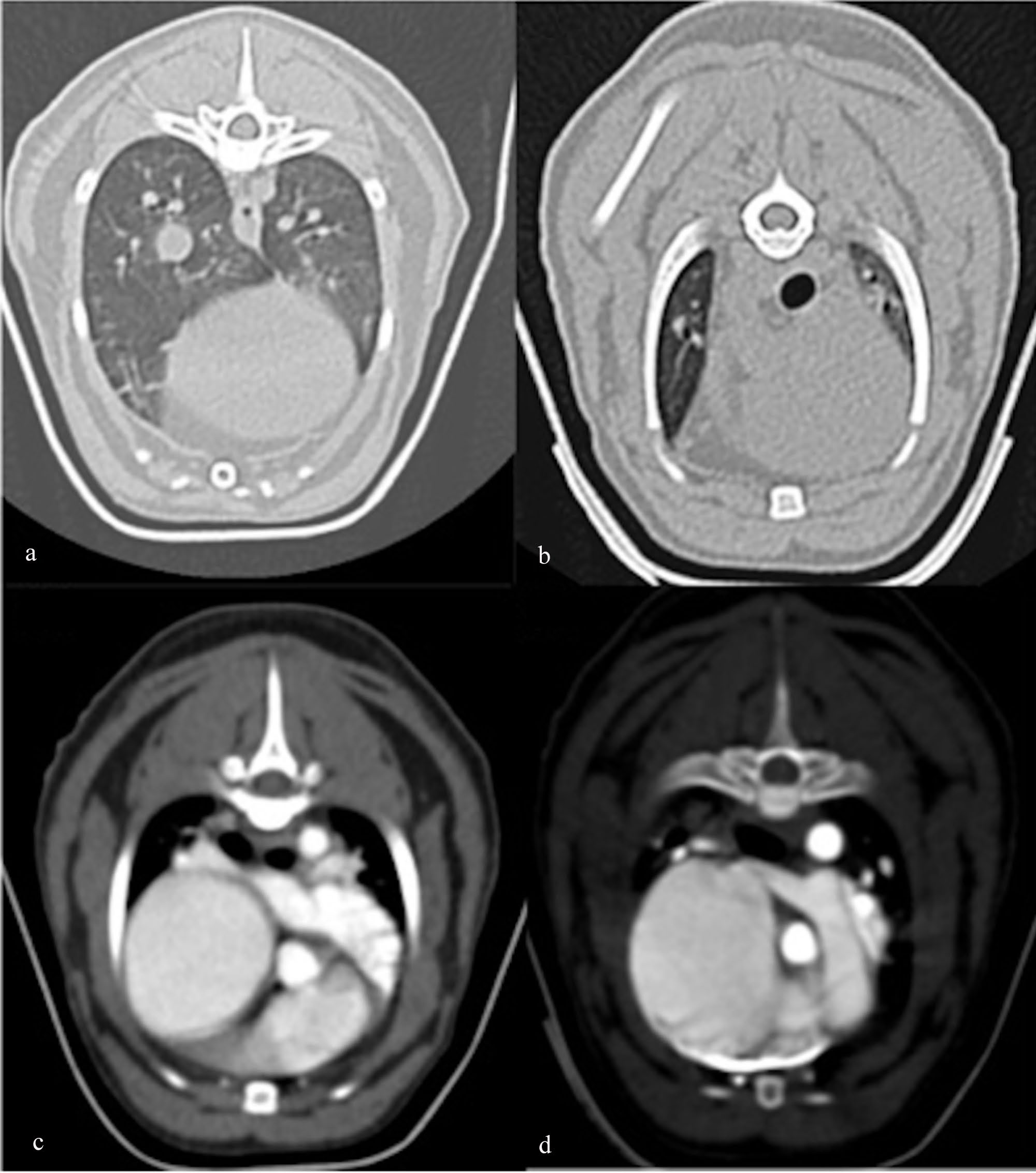
全麻下进行了CT血管造影检查。主要发现是严重的全心肿大(主要影响右心室)、肺实质弥漫性磨玻璃影、一些实质带和胸膜下间质增厚,并伴有轻度支气管扩张(下图)。
由于CT显示的病变具有弥漫性,因此采用小胸腔切开术对右肺中叶进行了肺活检。组织病理学结果显示肺实质发育异常。
03 预后
8个月后,患者出现呼吸困难。超声显示胸腔积液,引流了约150 mL血清样积液,积液中淋巴细胞丰富(总蛋白2.8 g/dl),主要为小淋巴细胞(总有核细胞数15000个/µl)。由于极有可能出现了严重的肺动脉高压和右心室重塑,因此推测为右心衰。以2 mg/kg静脉注射呋塞米,一般状况明显改善。
在随后的4个月中,不断增加口服呋塞米的剂量,以控制充血性心力衰竭。遗憾的是,患者对口服药物的依从性很差,无法增加额外的疗法。
由于患者的生活质量下降,主人在12个月后选择了安乐死。
04 尸检
病理检查证实了右侧心肌肥大,右心房明显增大,右心室轻度扩张和轻度肥厚,右心室和肺动脉干没有任何狭窄。发现广泛的心肌细胞变性。
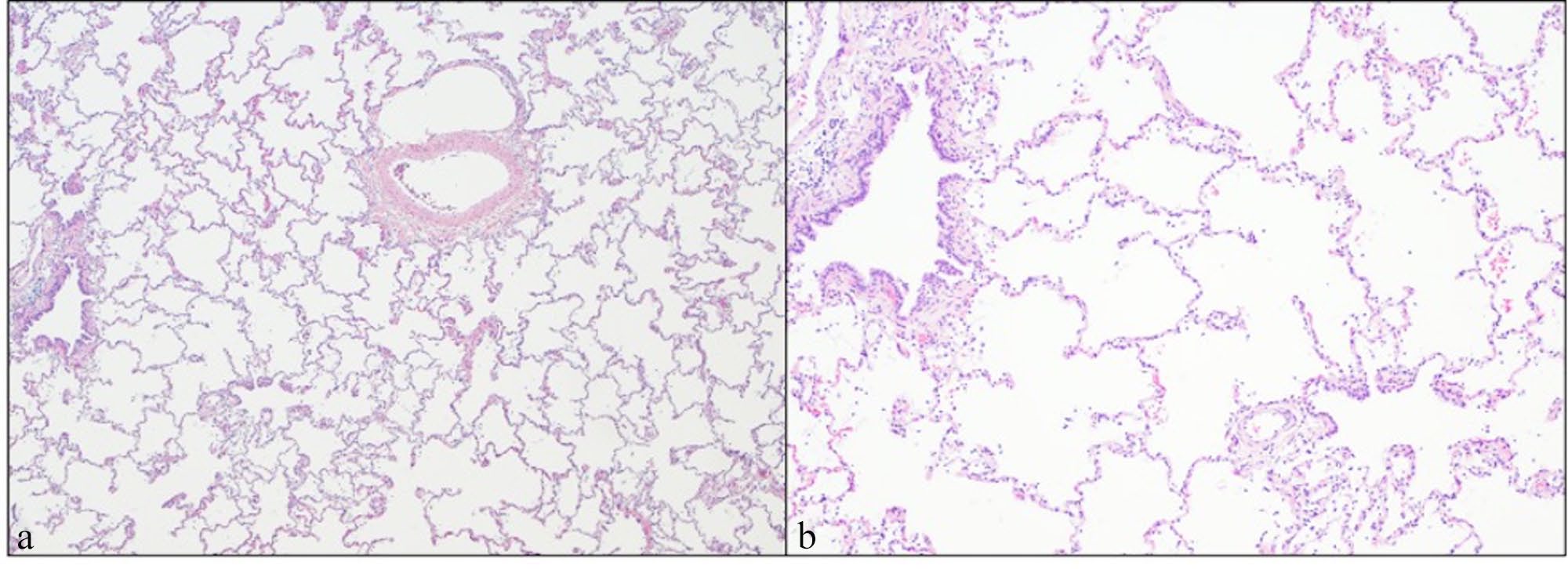
肝脏表面出现囊性新生血管灶和纤维蛋白沉积,支持右心功能不全。肺部出现弥漫性病变(下图)。
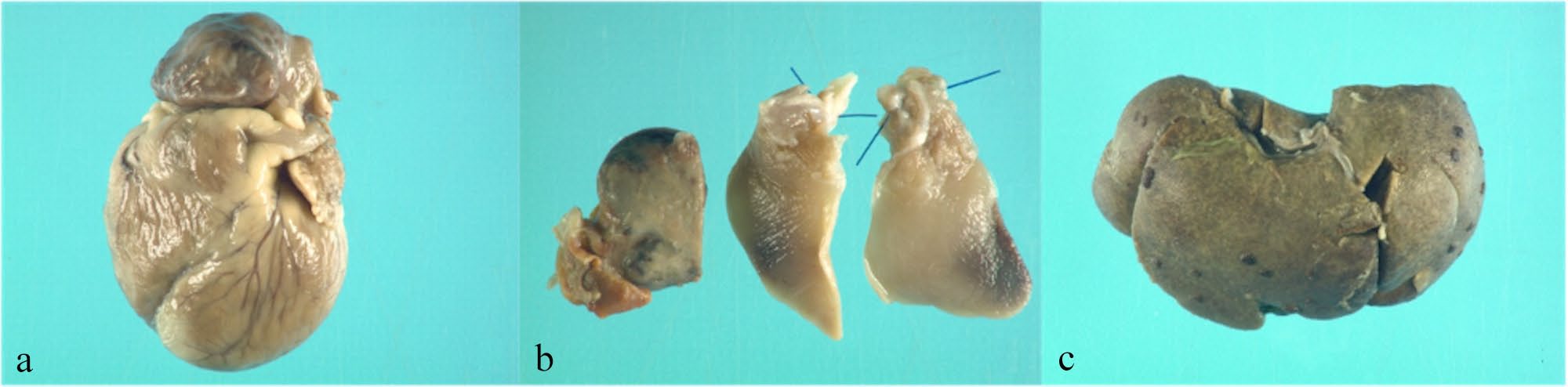
所有肺叶的特点都是肺泡空间明显扩大,气道异常,反映出气管和肺泡发育异常(下图)。
提取了血和肾组织中的DNA进行基因检测,检测FOXF1基因是否存在变异。结果发现,检测到的唯一变异是在甘氨酸密码子(GGC)的串联重复中,本猫是杂合子,有9-10个甘氨酸重复。然而,这种框架内插入-缺失变异在猫基因组测序数据库中很常见,因此,预计该变异不会对该猫产生致病性。
05 讨论
儿童发育性肺病(developmental lung disease,DLD)属于弥漫性肺病的大类,包括一组异质性疾病,其特征是气体交换受损和影像学上的弥漫性浸润[1-3]。猫的这种疾病尚未得到彻底描述和分类[4-7]。儿童DLD中的一部分会导致肺动脉高压,可导致预后不良和存活率降低[8-10]。
遗传变异可能与某些儿童弥漫性DLD相关,包括FOXF1基因的基因组改变,FOXF1是对胚胎肺发育至关重要的转录因子[11-15]。
本病例报告重点介绍了一只经组织病理学诊断为DLD的猫的临床表现、诊断和自然病史,该病例极有可能伴有严重的肺动脉高压。
关于猫先天性肺部疾病的病例报道很少[4-7],迄今为止没有一例伴有肺动脉高压。在猫中,DLD很可能未得到充分认识,因为需要进行大量诊断检查以排除其他病因,最终需要肺组织检测才能确诊。
虽然根据患者的体征和临床表现,先天性或后天性心脏病的可能性更大,但其他先天性肺部疾病,如DLD,仍可能符合具有严重呼吸道症状和相关心脏杂音的幼猫的临床表现。
与某些肺实质疾病和肺血管疾病一样,胸片和CT成像虽然有助于排除其他疾病,但缺乏特定疾病的病理特征[18]。超声心动图在确认肺动脉高压以及排除可能导致肺动脉高压的先天性或后天性心脏疾病方面起着关键作用[19-22]。
本病例中,肺动脉高压是主要的超声心动图检查结果,很可能是最初主诉的原因,也是随后临床恶化和死亡的原因。猫出现肺动脉高压并不常见,关于非心脏原因的信息也很少[23]。由于缺乏猫肺动脉高压的诊断和管理指南,兽医对可能导致肺动脉高压的心脏、血管和肺部原因进行了调查[22-26]。
由于缺乏左心房增大或严重肥厚、三尖瓣反流速度的大小以及缺乏典型的肥厚性心肌病的组织病理学改变,左心室肥大和收缩期前移被认为是肺动脉高压的后果而非主要原因。虽然没有关于猫的具体报道,但有报道称患有肺动脉高压或脱水的狗会出现二尖瓣收缩期前移[27,28]。要明确诊断,必须在死前通过肺活检对肺实质进行组织学鉴定[18,29-32]。
在患有DLD的婴儿中发现了一些基因变异,包括FOXF1基因的变异,该变异与肺泡毛细血管发育不良和肺静脉错位有关[9]。在这只猫中,基因组分析并未发现FOXF1基因存在致病变异。
总之,DLD是一种新发现的引起家猫肺动脉高压的病因。死前确诊需要进行肺活检。肺动脉高压弥漫性疾病的总体预后较差,但在发生充血性心衰之前,其生活质量尚可接受。可以进行额外的基因分析,如全基因组或外显子组测序,以确定疾病的潜在遗传原因。
文献来源:Nebel Y, Williams K, Lyons LA, Reinero C, Ferriani R, Toschi Corneliani R, Spalla I. Developmental lung disease in a cat associated with high probability of severe pulmonary hypertension: natural history, histopathology and genetic analysis. JFMS Open Rep. 2024 May 30;10(1):20551169241249003.
参考文献
1. Deutsch GH, Young LR, Deterding RR, et al. Diffuse lung disease in young children: application of a novel classification scheme. Am J Respir Crit Care Med 2007; 176: 1120–1128.
2. Fan LL, Deterding RR, Langston C. Pediatric interstitial lung disease revisited. Pediatr Pulmonol 2004; 38: 369–378.
3. Pike D, Mohan S, Ma W, et al. Pulmonary imaging abnormalities in an adult case of congenital lobar emphysema. J Radiol Case Rep 2015; 9: 9–15.
4. Milne ME, McCowan C, Landon BP. Spontaneous feline pneumothorax caused by ruptured pulmonary bullae associated with possible bronchopulmonary dysplasia. J Am Anim Hosp Assoc 2010; 46: 138–142.
5. Blonk M, Van de Maele I, Combes A, et al. Congenital lobar emphysema in a kitten. J Small Anim Pract 2017; 58: 659–663.
6. Del Magno S, Zanardi S, Foglia A, et al. Congenital lobar emphysema in a kitten with concomitant hiatal hernia and nutritional secondary hyperparathyroidism. J Am Anim Hosp Assoc 2022; 58: 141–145.
7. Warwick H, Guillem J, Batchelor D, et al. Imaging findings in 14 dogs and 3 cats with lobar emphysema. J Vet Intern Med 2021; 35: 1935–1942.
8. Lee EY. Pediatric interstitial (diffuse) lung disease. In: Cleveland R, Lee E. (eds). Imaging in pediatric pulmonology. New York: Springer International Publishing, 2020, pp 145–197.
9. Slot E, Edel G, Cutz E, et al. Alveolar capillary dysplasia with misalignment of the pulmonary veins: clinical, histological, and genetic aspects. Pulm Circ 2018; 8.
10. Dishop MK. Diagnostic pathology of diffuse lung disease in children. Pediatr Allergy Immunol Pulmonol 2010; 23: 69–85.
11. Dharmadhikari AV, Szafranski P, Kalinichenko VV, et al. Genomic and epigenetic complexity of the FOXF1 locus in 16q24.1: implications for development and disease. Curr Genomics 2015; 16: 107–116.
12. Peterson RS, Lim L, Ye H, et al. The winged helix transcriptional activator HFH-8 is expressed in the mesoderm of the primitive streak stage of mouse embryos and its cellular derivatives. Mech Dev 1997; 69: 53–69.
13. Mahlapuu M, Ormestad M, Enerbäck S, et al. The forkhead transcription factor Foxf1 is required for differentiation of extra-embryonic and lateral plate mesoderm. Development 2001; 128: 155–166.
14. Kalinichenko VV, Lim L, Clark J, et al. Defects in pulmonary vasculature and perinatal lung hemorrhage in mice heterozygous null for the Forkhead Box f1 transcription factor. Dev Biol 2001; 235: 489–506.
15. Pierrou S, Hellqvist M, Samuelsson L, et al. Cloning and characterization of seven human forkhead proteins: binding site specificity and DNA bending. EMBO J 1994; 13: 5002–5012.
16. Shelton GD, Tucciarone F, Guo LT, et al. Precision medicine using whole genome sequencing identifies a novel dystrophin (DMD) variant for X-linked muscular dystrophy in a cat. J Vet Intern Med 2024; 38: 135–144.
17. Lyons LA, Buckley RM, Harvey RJ, et al. Mining the 99 Lives Cat Genome Sequencing Consortium database implicates genes and variants for the Ticked locus in domestic cats (Felis catus). Anim Genet 2021; 52: 321–332.
18. Leslie KO. My approach to interstitial lung disease using clinical, radiological and histopathological patterns. J Clin Pathol 2009; 62: 387–401.
19. Johnson L. Diagnosis of pulmonary hypertension. Clin Tech Small Anim Pract 1999; 14: 231–236.
20. Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2016; 37: 67–119.
21. Kellihan HB, Stepien RL. Pulmonary hypertension in dogs: diagnosis and therapy. Vet Clin North Am Small Anim Pract 2010; 40: 623–641.
22. Reinero C, Visser LC, Kellihan HB, et al. ACVIM consensus statement guidelines for the diagnosis, classification, treatment, and monitoring of pulmonary hypertension in dogs. J Vet Intern Med 2020; 34: 549–573.
23. Rolph KE, Cavanaugh SM. Feline pulmonary hypertension: are we overlooking an important comorbidity? J Feline Med Surg 2022; 24: e636–e646.
24. Crisi PE, Traversa D, di Cesare A, et al. Irreversible pulmonary hypertension associated with Troglostrongylus brevior infection in a kitten. Res Vet Sci 2015; 102: 223–227.
25. Dirven M, Szatmári V, van den Ingh T, et al. Reversible pulmonary hypertension associated with lungworm infection in a young cat. J Vet Cardiol 2012; 14: 465–474.
26. Browne LE, Carter TD, Levy JK, et al. Pulmonary arterial disease in cats seropositive for Dirofilaria immitis but lacking adult heartworms in the heart and lungs. Am J Vet Res 2005; 66: 1544–1549.
27. Paige CF, Abbott JA, Pyle RL. Systolic anterior motion of the mitral valve associated with right ventricular systolic hypertension in 9 dogs. J Vet Cardiol 2007; 9: 9–14.
28. Hammes K, Novo Matos J, Baron Toaldo M, et al. Hypovolemia induced systolic anterior motion of the mitral valve in two dogs. J Vet Cardiol 2016; 18: 367–371.
29. Ergun E, Ates U, Bahadir K, et al. A safe and minimally invasive method for thoracoscopic lung biopsy in interstitial lung disease. Pediatr Allergy Immunol Pulmonol 2019; 32: 117–120.
30. Norris CR, Griffey SM, Walsh P. Use of keyhole lung biopsy for diagnosis of interstitial lung diseases in dogs and cats: 13 cases (1998-2001). J Am Vet Med Assoc 2002; 221: 1453–1459.
31. Reinero C. Interstitial lung diseases in dogs and cats part II: known cause and other discrete forms. Vet J 2019; 243: 55–64.
32. Reinero C. Interstitial lung diseases in dogs and cats part I: the idiopathic interstitial pneumonias. Vet J 2019; 243: 48–54.