
| 一般情况 | |
|---|---|
 | 品种:马尔济斯犬 |
| 年龄:9岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:脊髓胶质瘤 | |
01 主诉及病史
出现脊柱后凸姿势、食欲下降3天。
在当地医院就诊,神经系统检查未发现异常,只有轻微颈部疼痛。医生给它服用了非甾体抗炎药来控制疼痛。但2天后,患者因神经症状恶化和左侧偏瘫再次就诊。
02 检查
体重1.9千克。可以行走,颈部有轻至中度疼痛,左侧肢体本体感觉反应减弱,深部痛觉完好。
体格检查发现二级心脏杂音,无其他异常。除了碱性磷酸酶(405 U/L [47-254])和丙氨酸氨基转移酶(95 U/L [17-78])轻度升高外,实验室检查结果基本正常。
影像学检查显示,第6-7节颈椎有明显的腹侧脊柱畸形,椎间盘间隙变窄,无其他异常。超声心动图和腹部超声显示二尖瓣肌瘤病B1期和双侧肾小结石。
根据临床和神经系统体征,主要的鉴别诊断是颈椎间盘疾病、退行性脊髓病变、肿瘤或炎症、脑部或颈椎血管疾病。因此计划对脑和颈椎脊髓进行MRI检查。但在MRI前2天,患者的症状逐渐恶化,表现为不能行走的四肢瘫痪,四肢深部疼痛反应正常。
MRI结果显示,在T2加权图像上,第二颈椎(C2)脊髓中央至左背侧偏心处发现脊髓内界限不清的异质高强区,导致局灶性脊髓肿胀,在T2加权上显示正常实质结构消失和脑脊液线周向衰减(下图ACD)。病灶在T1加权图像上呈等间高点,在T2加权上呈等间高密度(下图BEF)。
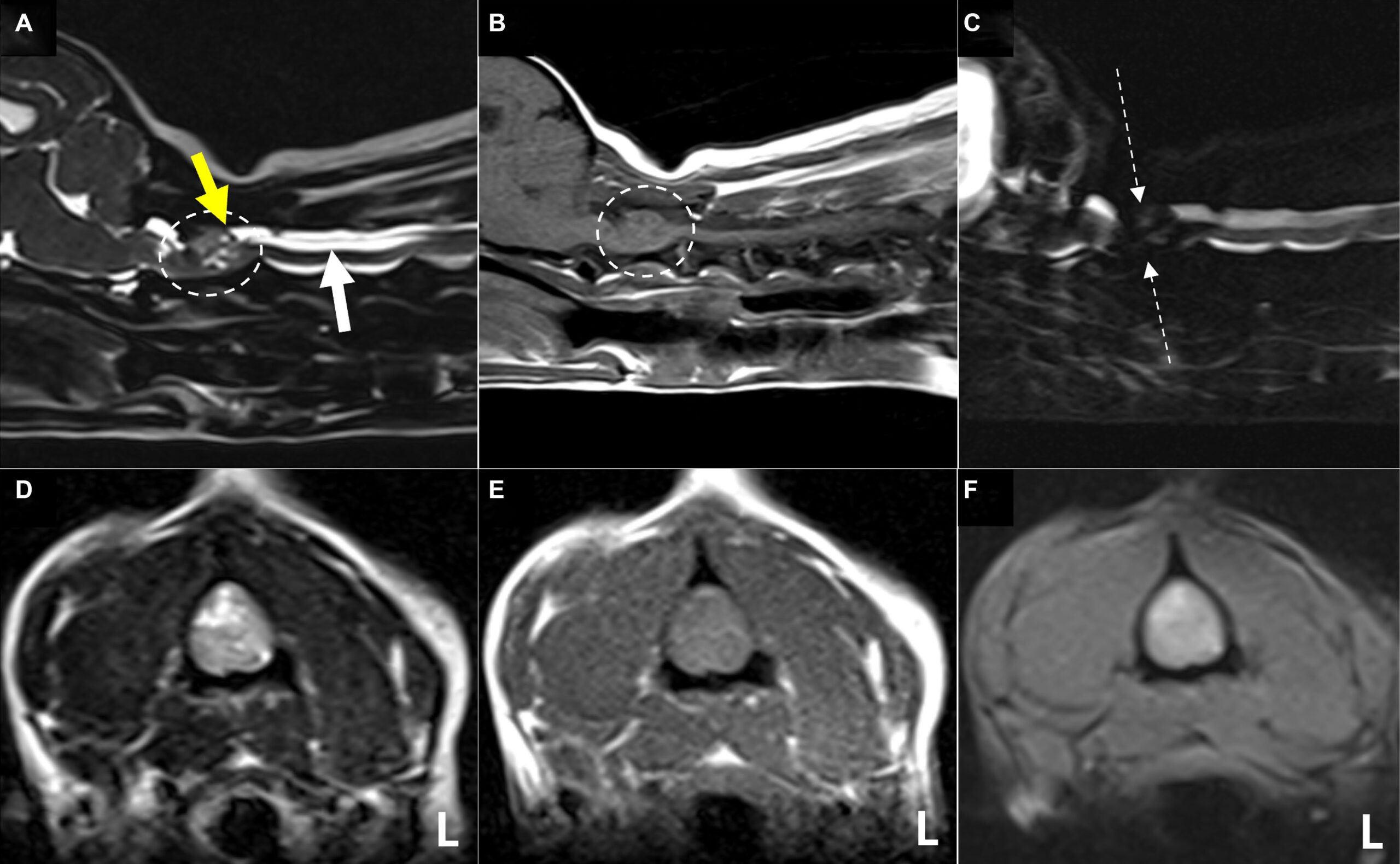
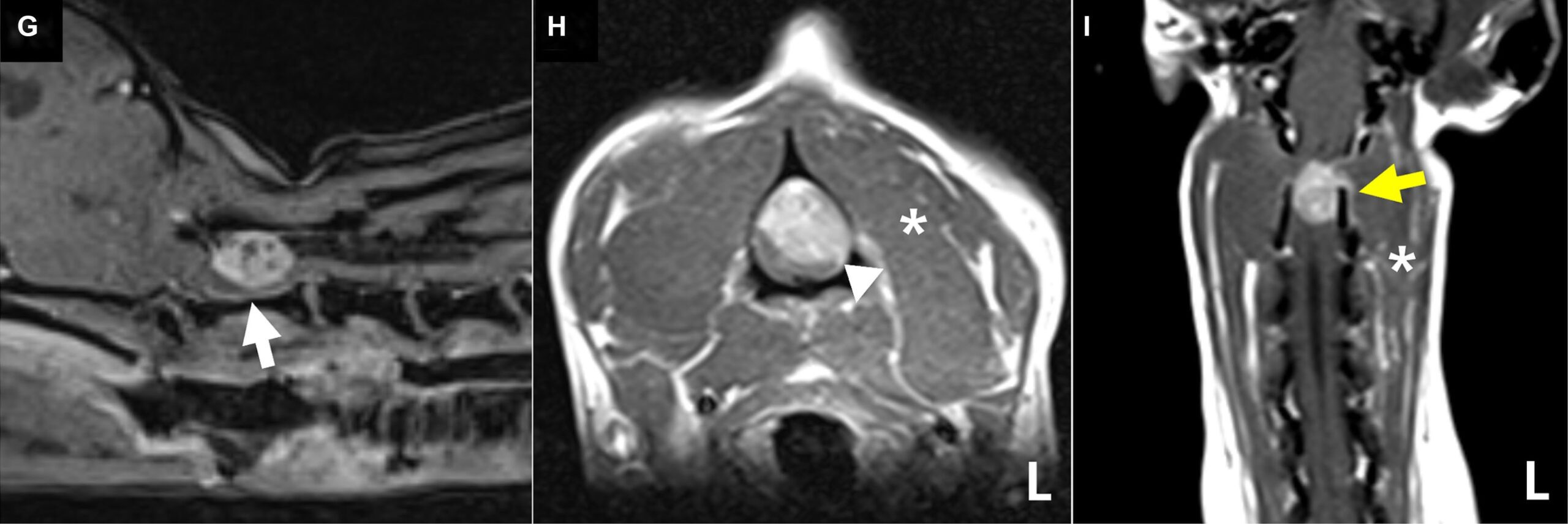
对比后的T1加权图像显示,肿块呈卵圆形,轮廓清晰,对比度均匀增强,大小为10.9×7.2×8.3 mm(下图G-I)。肿块内有多个小腔隙,提示为囊肿或坏死区,导致脊髓左侧严重受压(下图G)。
在C2肿块尾部的背侧蛛网膜下腔,虽然不典型,但发现了类似”高尔夫球”征的结构,这是硬膜外髓内病变和鞘膜积液的特征性表现(上图A)。增厚的C2左神经根附近的脑膜出现类似”硬膜尾征”的外观,对比度增强,病变附近的脊柱旁肌肉轻度萎缩,对比度增强,腹侧脑膜增强(下图HI)。然而,在所有序列中,肿块的硬膜广泛附着都不明显。其他MRI结果包括多发性颈椎间盘变性伴突出、双侧脑室肥大和动静脉畸形。
根据MRI结果,考虑C2椎体肿块是导致患者出现临床症状的原因。考虑到肿块的MRI特征(单发、轮廓清晰、对比度明显增强和肿块效应),强烈怀疑是脊柱肿瘤并发神经胶质病变、左侧神经炎和肌炎,而不是炎症或血管疾病。
然而,由于C2肿块在所有图像中都广泛分布于脊柱实质内,因此无法确定其来源。髓内或髓外肿瘤(如脑膜瘤、神经鞘瘤或肾母细胞瘤)被认为是主要的鉴别诊断,其他可能是髓内肿瘤或髓内髓外肿瘤侵犯。
03 手术
考虑到肿块的边缘清晰、位置、大小以及临床症状的进展,计划通过C2背侧椎板切除术联合硬膜切开术切除肿块。
对C2背弓进行铰链式截骨,涉及C2棘突的头侧75%。在保留的C2棘突头侧与C1背弓的连接处背侧和头侧旋转骨瓣,以观察背侧硬膜。中线硬膜切开术发现了一个囊状肿块。肿瘤的大部分很容易与邻近的脊髓实质分离并切除,但是肿瘤的腹侧部分与邻近左侧神经根的脊髓脑膜局部粘连,并伴有纤维组织(下图)。
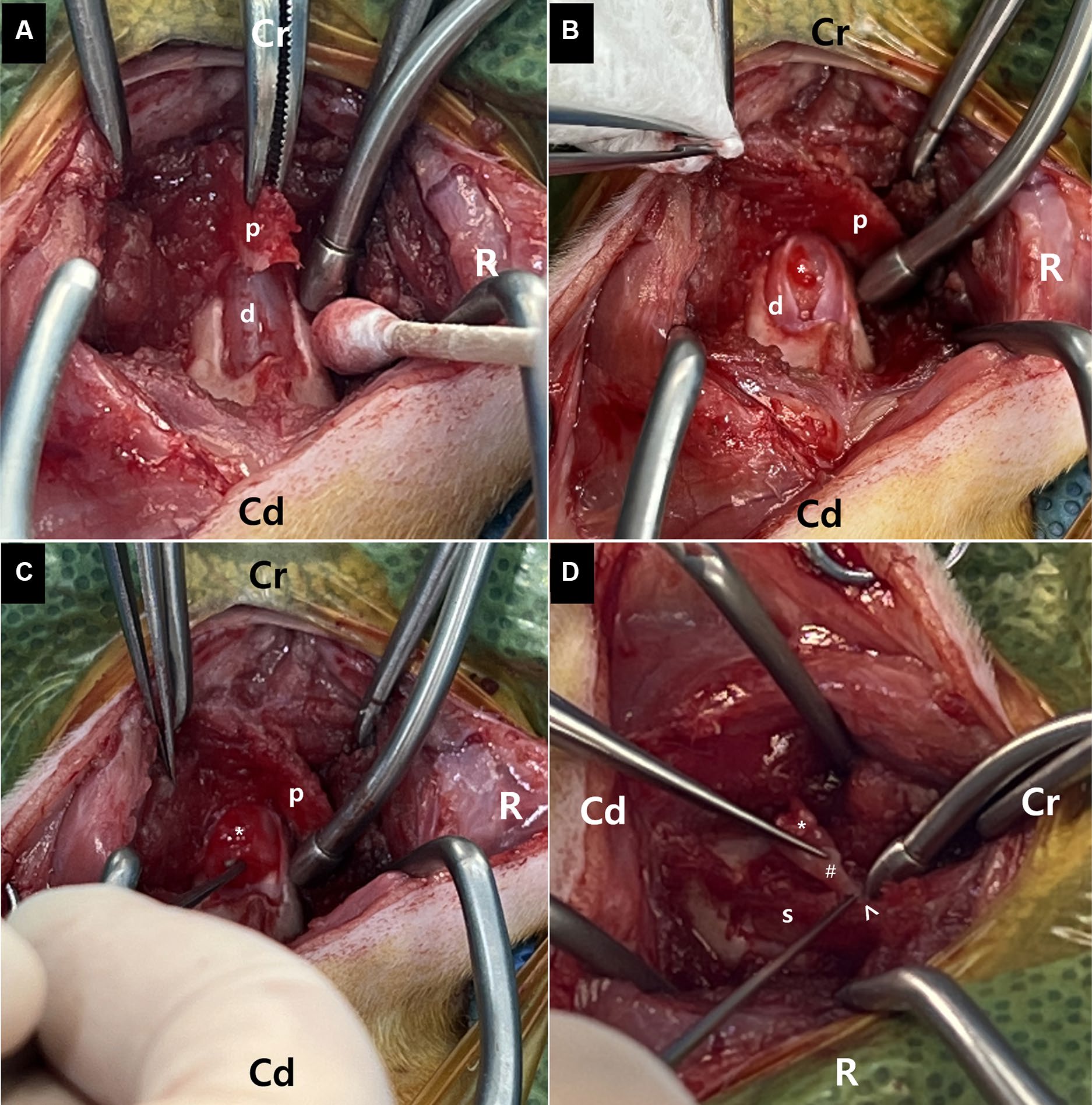
在小心切除这些腹侧肿瘤组织后,出现了轻微出血,但很快得到控制。脊髓未见异常。在脊柱棘突恢复正常位置之前,使用生物可吸收硬脊膜替代物覆盖硬脊膜缺损,并与邻近硬脊膜缝合。随后将背弓旋转回暴露的椎管上,并用2-0非吸收缝线通过一个预先钻好的孔稳定棘突。
切除的肿块呈红色、环形、有弹性(下图),经组织病理学检查,观察到纺锤形圆形至多角形细胞,含有少量至中等量的苍白、嗜酸性、絮状至颗粒状细胞质。细胞核呈异色,有一个或两个不同程度的明显核仁,伴有中度异形细胞增多和异形核分裂。这些结果与胶质瘤最为吻合,其中以少突胶质细胞瘤最为吻合。
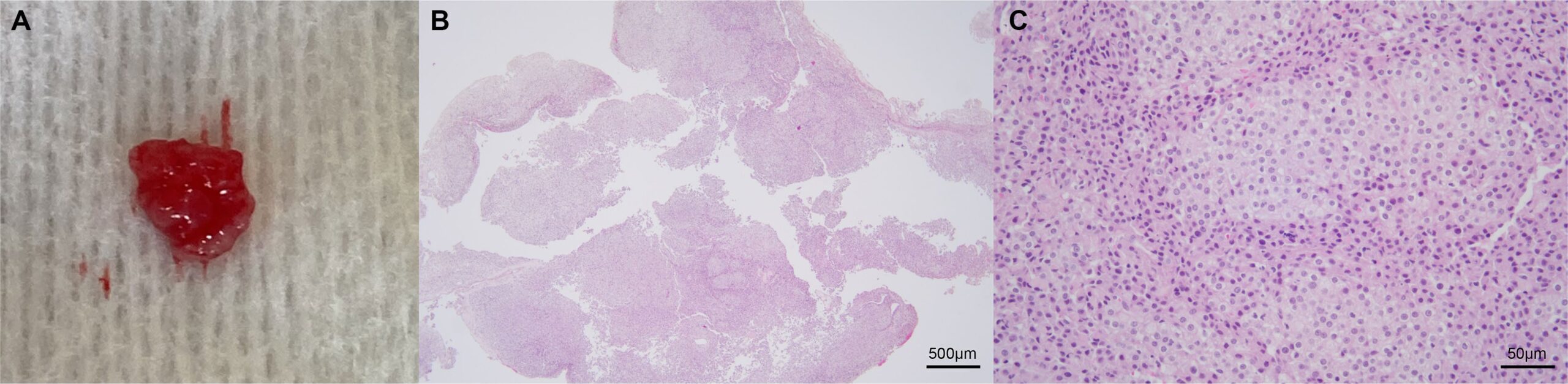
由于主人经济拮据,无法对胶质细胞肿瘤标记物进行免疫组化染色。肿瘤基因组检测数据显示CDKN2N的拷贝数丢失和MYC拷贝数增加,支持犬胶质瘤的诊断。
04 预后
术后3天,可以站起来在笼子里行走,食欲也恢复正常。
术后约2周,所有神经体征恢复正常。虽然建议术后进行MRI和CT检查,以确认胶质瘤的残留组织并评估转移情况,但由于主人经济拮据,只进行了CT扫描。
术后CT显示,C2椎板因手术造成区域性骨缺损。不过全身CT检查未发现明显异常,包括肿瘤转移、淋巴结肿大或手术部位周围的造影剂增强病变。虽然医生建议患者接受化疗,但主人拒绝了这一建议。
出院10个月后,患者的神经症状没有复发。
05 讨论
脊髓肿瘤可导致脊髓功能障碍的临床症状[1]。脊髓肿瘤分为髓内肿瘤(约占此类肿瘤的15%)[1-8]、硬膜外肿瘤(约占 50%)[1,4,5,8]和硬膜外肿瘤(35%)。髓内肿瘤包括星形细胞瘤、少突胶质细胞瘤和上皮瘤[1,5-7]。包括肾母细胞瘤和周围神经鞘瘤在内的一些肿瘤可同时位于髓外和髓内位置[2,5,6]。
MRI具有出色的对比分辨率,是诊断脊髓肿瘤的关键[6,9]。信号强度、对比增强程度以及是否存在充满液体的腔室可用于区分脊髓肿瘤[5]。此外,脊髓肿瘤相对于脑膜的位置也有助于预测组织学类型[1,5]。
然而,髓内脊髓肿瘤给诊断和治疗带来了挑战[9]。脊髓肿瘤可跨区移动,因此即使有先进的成像技术也很难进行术前诊断[8]。虽然有成功手术切除的病例,但髓内脊髓肿瘤一般不适合手术治疗[1,5,8]。
脊柱肿瘤的治疗方法包括手术切除、放疗和化疗[1]。预后取决于肿瘤类型、脊髓浸润程度、术前和术中脊髓损伤、局部切除程度以及外科医生的经验[1,2,5]。肿瘤切除是脊髓肿瘤患者的主要治疗方法,可与放化疗同时使用或不同时使用[1,5]。这种手术通常用于硬膜外和硬膜内髓外肿瘤,但很少用于髓内肿瘤[1,2,5]。这反映了在不造成先天性损伤的情况下切除脊髓内肿瘤所需的专业技术。因此,术前区分硬膜外髓内肿瘤和髓内肿瘤可能是有用的。
虽然MRI具有出色的对比分辨率,但其相对较低的空间分辨率可能会对区分硬膜外髓内肿瘤和髓内肿瘤产生负面影响[5]。之前的一项犬研究报告了一例确诊的髓内颈胶质瘤病例,该病例在MRI上表现出髓外髓内病变的特征。在人类中,磁共振成像诊断髓内髓外肿瘤的敏感性约为83%,187例此类肿瘤中有31例被误诊为髓内肿瘤[5]。
胶质瘤产生于大脑或脊髓的胶质细胞,分为星形胶质细胞瘤、少突胶质细胞瘤和上皮细胞瘤。犬胶质瘤通常发生在年龄较大的个体,尤其是短头犬,主要发生在额叶、顶叶或颞叶端脑叶,较少发生在脑干和脊髓[3,7]。
犬脊髓胶质瘤最常见的类型是上皮瘤,其次是星形细胞瘤、少突胶质细胞瘤、脑胶质瘤病和未分类胶质瘤[3,8]。在最近一份关于7例犬脊髓胶质瘤的报告中,受影响的脊髓节段按频率递减顺序依次为胸段(3例)、腰段(3例)和颈段(1例),最常见的脊髓胶质瘤是少突胶质细胞瘤[3]。
在另一份关于53例犬脊髓髓内肿瘤的报告中,胸腰椎段是最常受累的部位,但在幼犬中,原发性髓内肿瘤更常见于颈部脊髓。此外,所有进行MRI检查的狗都能发现髓内肿块[8]。不过,尽管脊髓髓内病变最初可能是实质内的,但脊髓髓内肿瘤也可能扩展并浸润其他部位[3,8]。
髓内肿瘤的临床诊断和治疗具有挑战性,因为这些肿瘤的临床过程和神经解剖位置进展迅速。在MRI成像上,星形细胞瘤和少突胶质细胞瘤都表现为卵圆形至椭圆形的肿块病变,边缘清楚,位于脊髓偏中心,并伴有不同程度的脊髓扩张。
星形细胞瘤和少突胶质细胞瘤在T1加权图像上呈等至高点强化,在T2加权上呈高强化,并伴有中度对比度增强。相反,上皮瘤表现为局灶性至多节段性、纺锤形、位于中心的病变,在T1加权图像上呈异质等高点强化,在T2加权图像上呈高强化,对比度明显增强[8]。
本报告也存在一些局限性,包括缺乏免疫组化数据、脑脊液分析和各种MRI成像序列。虽然有必要根据组织病理学结果区分胶质瘤类型,但无法进行免疫组化,因此,无法确定胶质瘤的类型。不过,根据MRI特征和组织病理学结果,认为该肿块是少突胶质细胞瘤或星形细胞瘤的可能性较大。
考虑到肿块的大小、分布和明显的对比度增强,该肿块更倾向于高级别肿瘤而非低级别肿瘤,这表明有必要进行持续监测,以发现复发的可能性[16]。缺乏脑脊液分析可能不会对患者的评估和诊断产生实质性影响,因为脊髓胶质瘤没有特定的脑脊液特征[3,7,9,14,22]。对比后脂肪饱和度和弥散张量成像可能会提供更多有关肿块分布和位置的信息,并可能有助于在MRI上确定脊髓肿瘤的类型,供今后参考[23,24]。
尽管有许多报道详细介绍了犬脊柱肿瘤的MRI特征,但本病例表明还存在其他尚未报道的类型。虽然组织病理学检查通常是明确诊断的必要条件,但MRI提供了脊髓病变位置、分布和边缘的详细信息,有助于手术决策。MRI上有关脊髓肿瘤特征的更多信息可能有助于提高诊断的水平。此外,根据MRI结果,脊髓肿瘤被认为是可移动的,手术治疗可能会使患者受益。
文献来源:Kim J, Kim K, Chung DJ, Kim Y, Kim K, Oh D, Lee N, Choi J, Yoon J. Case report: Magnetic resonance imaging features with postoperative improvement of atypical cervical glioma characterized by predominant extramedullary distribution in a dog. Front Vet Sci. 2024 May 22;11:1400139.
参考文献
1. Besalti, O, Caliskan, M, Can, P, Vural, SA, Algin, O, and Ahlat, O. Imaging and surgical outcomes of spinal tumors in 18 dogs and one cat. J Vet Sci. (2016) 17:225–34.
2. Auger, M, Hecht, S, and Springer, CM. Magnetic resonance imaging features of extradural spinal neoplasia in 60 dogs and seven cats. Front Vet Sci. (2021) 7:610490.
3. Rissi, DR, Barber, R, Burnum, A, and Miller, AD. Canine spinal cord glioma: a case series and review of the literature. J Vet Diagn Invest. (2017) 29:126–32.
4. Kutara, K, Maeta, N, Kanda, T, Ohnishi, A, Mitsui, I, Miyabe, M, et al. Magnetic resonance imaging findings of an intradural extramedullary hemangiosarcoma in a dog. J Vet Med Sci. (2019) 81:1527–32.
5. Krasnow, MS, Griffin, JF IV, Levine, JM, Mai, W, Pancotto, TE, Kent, M, et al. Agreement and differentiation of intradural spinal cord lesions in dogs using magnetic resonance imaging. J Vet Intern Med. (2022) 36:171–8.
6. Mai, W. Diagnostic MRI in dogs and cats. 1st ed Broken Sound Parkway NW, Suite: CRC Press (2018).
7. Mamom, T, Meyer-Lindenberg, A, Hewicker-Trautwein, M, and Baumgärtner, W. Oligodendroglioma in the cervical spinal cord of a dog. Vet Pathol. (2004) 41:524–6.
8. Pancotto, TE, Rossmeisl, JH Jr, Zimmerman, K, Robertson, JL, and Werre, SR. Intramedullary spinal cord neoplasia in 53 dogs (1990–2010): distribution, clinicopathologic characteristics, and clinical behavior. J Vet Intern Med. (2013) 27:1500–8.
9. Masciarelli, AE, Griffin, JF, Fosgate, GT, Hecht, S, Mankin, JM, Holmes, SP, et al. Evaluation of magnetic resonance imaging for the differentiation of inflammatory, neoplastic, and vascular intradural spinal cord diseases in the dog. Vet Radiol Ultrasound. (2017) 58:444–53.
10. Kippenes, H, Gavin, PR, Bagley, RS, Silver, GM, Tucker, RL, and Sande, RD. Magnetic resonance imaging features of tumors of the spine and spinal cord in dogs. Vet Radiol Ultrasound. (1999) 40:627–33.
11. Casado, D, Fernandes, R, Lourinho, F, Gonçalves, R, Clark, R, Violini, F, et al. Magnetic resonance imaging features of canine intradural/extramedullary intervertebral disc extrusion in seven cases. Front Vet Sci. (2022) 9:1003042.
12. Bentley, RT, Yanke, AB, Miller, MA, Heng, HG, Cohen-Gadol, A, and Rossmeisl, JH. Cerebrospinal fluid drop metastases of canine glioma: magnetic resonance imaging classification. Front Vet Sci. (2021) 8:650320.
13. Vigeral, M, Bentley, RT, Rancilio, NJ, Miller, MA, and Heng, HG. Imaging diagnosis-antemortem detection of oligodendroglioma “cerebrospinal fluid drop metastases” in a dog by serial magnetic resonance imaging. Vet Radiol Ultrasound. (2018) 59:E32–7.
14. Koch, MW, Sánchez, MD, and Long, S. Multifocal oligodendroglioma in three dogs. J Am Anim Hosp Assoc. (2011) 47:e77–85.
15. Lobacz, MA, Serra, F, Hammond, G, Oevermann, A, and Haley, AC. Imaging diagnosis-magnetic resonance imaging of diffuse leptomeningeal oligodendrogliomatosis in a dog with dural tail sign. Vet Radiol Ultrasound. (2018) 59:E1–6.
16. Schkeeper, AE, Moon, R, Shrader, S, Koehler, JW, Linden, D, and Taylor, AR. Imaging diagnosis-magnetic resonance imaging features of a multifocal oligodendroglioma in the spinal cord and brain of a dog. Vet Radiol Ultrasound. (2017) 58:E49–54.
17. McDonnell, JJ, Tidwell, AS, Faissler, D, and Keating, J. Magnetic resonance imaging features of cervical spinal cord meningiomas. Vet Radiol Ultrasound. (2005) 46:368–74.
18. Petersen, SA, Sturges, BK, Dickinson, PJ, Pollard, RE, Kass, PH, Kent, M, et al. Canine intraspinal meningiomas: imaging features, histopathologic classification, and long-term outcome in 34 dogs. J Vet Intern Med. (2008) 22:946–53.
19. Wang, J, Wang, H, Li, Z, Wu, Q, Lathia, JD, McLendon, RE, et al. C-Myc is required for maintenance of glioma cancer stem cells. PLoS One. (2008) 3:e3769.
20. Lu, VM, O’Connor, KP, Shah, AH, Eichberg, DG, Luther, EM, Komotar, RJ, et al. The prognostic significance of CDKN2A homozygous deletion in IDH-mutant lower-grade glioma and glioblastoma: a systematic review of the contemporary literature. J Neuro-Oncol. (2020) 148:221–9.
21. Giron, C, Paquette, D, Culang, D, Doré, M, and Masseau, I. Diffuse meningeal oligodendrogliomatosis characterized by spinal intra-parenchymal nodules on magnetic resonance imaging in a dog. Can Vet J. (2020) 61:1312–8.
22. Korff, CP, Chu, SA, Percival, AJ, Nelissen, S, Wood, JH, Davies, E, et al. Unique cytologic and imaging features of a lumbosacral oligodendroglioma in a cat. J Vet Diagn Invest. (2023) 35:289–94.
23. Yoon, H, Park, NW, Ha, YM, Kim, J, Moon, WJ, and Eom, K. Diffusion tensor imaging of white and grey matter within the spinal cord of normal beagle dogs: sub-regional differences of the various diffusion parameters. Vet J. (2016) 215:110–7.
24. Allett, B, and Hecht, S. Magnetic resonance imaging findings in the spine of six dogs diagnosed with lymphoma. Vet Radiol Ultrasound. (2016) 57:154–61.