
| 一般情况 | |
|---|---|
 | 品种:布偶猫 |
| 年龄:3个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:室间隔缺损 | |
01 主诉及病史
未观察到明显的心源性临床症状,但在疫苗接种前听诊到心脏杂音,进行了胸部X光检查,发现心脏增大,于是进一步转诊。
02 检查
体重1.98千克(体况评分4/9)。心脏杂音在右心尖处最明显,可听到5/6级收缩期杂音。体温38.2°C,心率138 bpm,呼吸频率48次/分。
胸片显示椎心大小为9.0 v[7.7-10.8 v]。心胸比74.8%[49.2-85.0](下图)。

心电图显示R波增高,但电轴为+80°,窦性心律(180 bpm),未发现心律失常。
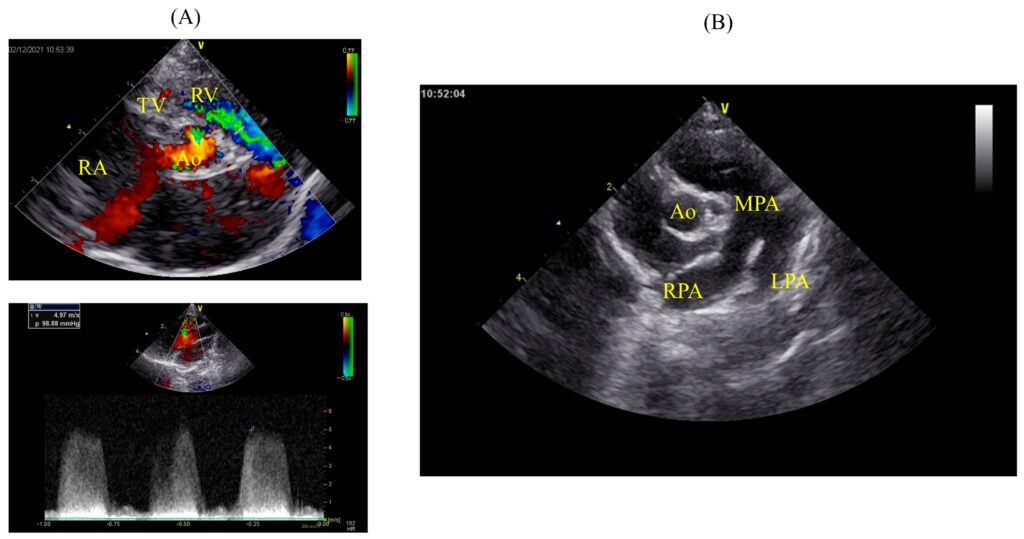
超声心动图在左心室流出道右侧胸骨旁切面上,发现了主动脉瓣下方有一个缺损。在右胸骨旁短轴切面上的主动脉瓣水平,缺损位于肺动脉流出道和三尖瓣之间,根据柯克林分类法诊断为2型和3型室间隔缺损(下图A)。室间隔缺损血流速度4.97 m/s。左心房直径1.45 cm [0.82-1.13],与正常值相比有所增大。左心室舒张末期直径1.94 cm [1.04-1.49]。舒张期室间隔和舒张期左心室游离壁分别为0.38 cm [0.29-0.48]和0.43 cm [0.27-0.48]。收缩期室间隔和收缩期左心室游离壁分别为0.60 cm [0.46-0.77]和0.62 cm [0.27-0.48]。左心室收缩末期直径0.90 cm,分数缩短率为53.57%。肺动脉明显扩张(主肺动脉与主动脉直径比值1.48 [<0.90])(下图B)。肺动脉明显扩张,肺与全身血流比为2.45。
主人表示愿意进行手术治疗,但由于猫体型较小,决定等猫长大后再进行手术治疗。
第383天,猫体重4.44千克(体况评分4/9),无临床症状。超声心动图显示,室间隔缺损的小轴和大轴分别为1.2 mm和8.1 mm(下图A),室间隔缺损/主动脉比值为95.3%。右侧胸骨旁短轴切面主动脉瓣水平显示12点钟位置有分流血流(5.01 m/s)(下图B)。主肺动脉/主动脉比值为1.69 [<1.5],明显增大。左心室舒张末期直径1.8 cm [1.27-1.98]。舒张期室间隔和舒张期左心室游离壁分别为0.40 cm [0.29-0.51]和0.53 cm [0.29-0.50]。收缩期室间隔和收缩期左心室游离壁分别为0.67 cm [0.44-0.87]和0.68 cm [0.44-0.87]。左心室收缩末期直径0.98 cm [0.57-1.30],分数缩短率为45.51% [28-62]。

肺动脉明显扩张,主肺动脉/主动脉1.29 [<0.90](下图)。没有观察到三尖瓣或肺动脉瓣反流,也没有肺动脉高压的迹象。但是,用多普勒计算出的肺血流与全身血流比率为2.96。鉴于左侧心脏增大,建议手术治疗。

03 手术
麻醉前皮下注射阿托品(0.025 mg/kg),静脉注射头孢唑啉(20 mg/kg,术中每隔2小时追加一次),缓慢静脉注射地塞米松(0.2 mg/kg)。用100%氧气供氧5分钟后静脉注射芬太尼(2 μg/kg)。静脉注射阿法沙酮(5 mg/kg),异氟醚(1-2%)维持麻醉。术中使用芬太尼恒速输注(5 μg/kg/h)来控制疼痛。静脉注射罗库溴铵(0.3 mg/kg)以停止呼吸,根据需要每隔40分钟再注射0.1 mg/kg。如果术中血压下降,则停止使用异氟醚,并使用阿伐沙龙(5-8 mg/kg/h)恒速输注维持麻醉。
麻醉后,将猫置于背卧位。通过切口暴露股动脉和静脉后,对动脉压进行有创测量。进行胸骨正中切开术,然后进行心包正中切开术,向两侧牵开心包,通过触诊室间隔缺损发现了右室流出道的缺损,于是通过切开肺动脉接近室间隔缺损部位。
切除主动脉周围的脂肪组织,暴露主动脉,以便在远端放置灌注插管,在近端放置心肌保护液根部插管。在插入灌注插管之前,使用不可吸收的单丝6-0缝线缝合,根部插管的固定也使用了单丝缝线缝合。
为了进行静脉引流,分离了头腔静脉、颧静脉和尾腔静脉,并使用缝线对头腔静脉和尾腔静脉进行了绑扎。在插入静脉引流插管之前,用6-0缝线进行了荷包缝合。在心脏切开过程中向胸腔注入二氧化碳,以防止空气栓塞。
随后以200 IU/kg剂量静脉注射肝素,并确认活化凝血时间超过300秒。然后插入8 Fr动脉灌注插管。将一根8 Fr弯曲静脉回流插管插入颅腔静脉,另一根10 Fr直静脉回流插管插入尾静脉,固定。在左心房置入通气插管,固定。
开始部分旁路灌注,然后横切主动脉。心肌保护液以34 mL/kg剂量通过根部插管缓慢注入,以实现心脏停搏并过渡到全旁路灌注。30分钟后,又注射了15 mL/kg剂量,总计215 mL。最初计划是将颧静脉和颅腔静脉绑在一起。然而由于距离较远,通过右心房切口插入了一个抽吸套管,对从颧静脉灌注的血液进行抽吸静脉引流。
心脏停跳后,切开主肺动脉,在右心室处切开肺动脉瓣,露出室间隔。显示了一个被肌肉组织包围的椭圆形缺损,长9 mm,宽约2-3 mm(下图A)。将直角钳插入缺损处并将其拉向操作者,可观察到缺损的全部范围。缝合缺损边缘。使用补片缝合缺损,补片根据孔的大小量身定制。然后将先前缝在边缘的双臂针依次穿过圆形补片,在确认左心室无血液渗出后完成闭合(下图B)。

从左心房通气插管排出血液,连续缝合肺动脉和右心室。同样连续缝合右心房,松开主动脉交叉钳后,心脏恢复自主跳动。部分心肺旁路一直持续到患者体温恢复到36.5°C。主动脉交叉钳夹总时间为56分钟,心肺旁路持续时间为105分钟。随后放置了胸腔引流管,并关闭胸腔。术后24小时内连续使用芬太尼(2 µg/kg/h)止痛。
04 预后
术后血细胞比容(PCV)降至15.7%,输血49 mL,第二天PCV为24.3%。术后尿量维持在2 mL/kg/h,但随后有所减少,术后第二天出现氮质血症(血尿素氮78.5 mg/dL;肌酐3.6 mg/dL)。血钾水平正常(4.03 mmol/L)。
术后第7天,胸腔积液变成乳白色,每天排出约100 mL。胸腔积液中的甘油三酯和总胆固醇为60.0 mg/dL,血清甘油三酯和总胆固醇分别为59.0和183.0 mg/dL。从术后第8天开始口服芦丁500 mg,每天三次。
持续输液治疗使术后第12天的数值恢复正常(血尿素氮26.0 mg/dL;肌酐:1.2 mg/dL)。在麻醉状态下进行了增强CT,结果显示前胸有明显的侧支发展,造影剂渗入胸膜腔。颅腔静脉内未发现血栓或栓塞物。乳白色渗出物逐渐减少,并在术后第15天消退。因此可以在第二天拔除胸腔引流管,并于术后第17天出院。该病例未进行抗血栓治疗。
术后第490天,患者仍无症状,精神状态良好,乳糜胸没有复发。超声心动图显示室间隔缺损有轻微的残余分流(下图A),但肺动脉已基本恢复正常(主肺动脉/主动脉比值0.93),左心室/主动脉和左心室舒张末期直径在正常范围内,分别为1.41和1.29 cm(下图B)。舒张期室间隔和舒张期左心室游离壁分别为0.54 cm和0.50 cm。室间隔和左心室游离壁分别为0.63 cm和0.72 cm,均在正常范围内。分数缩短率为47.22% [28-62]。患者正在接受疑似肥厚型心肌病的年度检查。

05 讨论
室间隔缺损(Ventricular septal defect,VSD)是一种先天性心脏病,其特征是室间隔未闭导致左向右分流,缺损大和分流量大的患者可导致充血性左心衰竭和肺动脉高压。
先天性心脏病在混种猫中的发病率为0.14%,表明它在猫中非常罕见[1]。然而,在这些先天性心脏病中,VSD占21%。其他临床研究发现,8%患有心脏病的猫患有先天性心脏病,其中50%的病例是由VSD引起的,因此VSD是猫最常见的先天性心脏病[2]。
在猫中,VSD主要表现为膜型或膜周型,约占病例的79%。其他类型包括瓣上型(约占13%)、房室管型和肌肉型(各约占4%)[3]。这些分类通常被称为柯克林分类法,在兽医学中得到广泛应用[4]。
单纯的VSD很少出现临床症状,但是在27只患有VSD的猫中,有6只出现呼吸道症状,其中3只出现充血性左心衰竭[3]。通常情况下,会采用利尿剂等药物治疗,但也有报道称采用肺动脉束带等姑息性手术治疗来限制血流[5]。
在人体中,伴有肺动脉高压或其他临床症状的VSD病例可通过导管介入治疗或在心跳停跳后在心肺旁路下直接关闭血管[6]。既往还没有关于猫VSD手术治疗的报道。因此,本报告介绍了一例不属于柯克林分类法的病例,但根据索托分类法[7],该病例被诊断为肺底肌肉型VSD,并接受了心肺旁路手术矫正。
最初,通过超声心动图检查,该猫被诊断为猫科动物中最常见的VSD类型——膜周型VSD。然而,在打开胸腔并触诊心脏时,肺流出道观察到肺底肌肉型VSD的诊断。在猫科动物中,VSD通常根据柯克林分类法进行分类,其中1型VSD为基底膜上型,2型为膜型或膜周型,3型和4型分别为房室管型和肌肉型,其中79%被诊断为膜型或膜周型[3]。
然而,在本病例中,VSD位于流出隔内,且被肌肉组织包围,因此难以用柯克林分类法进行分类。常用于人类的索托分类法将VSD分为四种类型:(1)位于心内隔的心内膜缺损,其部分通常为半月瓣;(2)以膜隔为中心并延伸至房室或主动脉瓣附近区域的膜缺损;(3)膜部与流入道之间的缺损,与房室间隔缺损中观察到的缺损类似;(4)肌肉缺损,即缺损周围组织完全为肌肉组织[7]。此外,肌肉缺损还可根据其位置细分为:肺底隔、流入道隔和小梁隔。
根据柯克林分类法,位于心室上嵴上方的1型缺损与索托分类法中的主动脉瓣内膜缺损相对应,主动脉瓣可能会偏移。在柯克林分类法中,1型缺损位于心上嵴上方,与索托分类法中的心底缺损相对应。
这些缺损较大,直接发生在肺动脉瓣下方,有可能导致主动脉瓣偏离。然而,在本病例中,虽然缺损靠近室上嵴,但由于与肺动脉的距离较远,并不属于肺底缺损。因此,根据索托分类法,最终将其归类为肌性缺损,并诊断为肺底肌肉型VSD。这种类型的缺损有利于缝合,因为它与膜周VSD不同,附近没有传导系统。
在本病例中,肺动脉正下方没有缺损,且分流的血流来自12点钟方向,这表明它不太可能是肺动脉内膜或膜性缺损。因此,术前诊断为肺底肌肉型VSD是可能的。
总之,这是首次报道在猫体内遇到的肺底肌肉型VSD,并使用心肺旁路方法进行手术关闭的实例。在心肺旁路过程中使用心脏麻痹剂使猫的心脏停止跳动有利于手术操作,但可能会因血液稀释而导致术后贫血。还可能出现一过性乳糜胸。目前已对这种方法进行了改进,不过,对猫进行胸骨正中切开术进行开胸手术似乎是治疗先天性心脏病的可行选择。
文献来源:Aoki T, Terakado T, Jingya Y, Iwasaki K, Shimoda H, Fukamachi N, Miyamoto T. Surgical Correction of Infundibular Muscular Ventricular Septal Defect in a Cat: A Case Report. Animals (Basel). 2024 Jun 8;14(12):1736.
参考文献
1. Schrope D.P. Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J. Vet. Cardiol. 2015;17:192–202.
2. Tidholm A., Ljungvall I., Michal J., Häggström J., Höglund K. Congenital heart defects in cats: A retrospective study of 162 cats (1996–2013) J. Vet. Cardiol. 2015;17:S215–S219.
3. Bomassi E., Misbach C., Tissier R., Gouni V., Trehiou-Sechi E., Petit A.M., Desmyter A., Damoiseaux C., Pouchelon J.L., Chetboul V. Signalment, clinical features, echocardiographic findings, and outcome of dogs and cats with ventricular septal defects: 109 cases (1992–2013) J. Am. Vet. Med. Assoc. 2015;247:166–175.
4. Santamaria H., Soto B., Ceballos R., Bargeron L.M., Coghlan H.C., Kirklin J.W. Angiographic differentiation of types of ventricular septal defects. AJR Am. J. Roentgenol. 1983;141:273–281.
5. Sutherland B.J., Pierce K.V., Gagnon A.L., Scansen B.A., Orton E.C. Dilatable pulmonary artery banding for ventricular septal defect: Surgical technique and case report of three cats. J. Vet. Cardiol. 2019;25:32–40.
6. Lozier J.S., Sati M., Cheifetz I.M., Bocks M.L. Update on percutaneous and perventricular device closure of congenital ventricular septal defect. Expert Rev. Cardiovasc. Ther. 2023;21:337–345.
7. Soto B., Becker A.E., Moulaert A.J., Lie J.T., Anderson R.H. Classification of ventricular septal defects. Br. Heart J. 1980;43:332–343.
8. Gunther-Harrington C.T., Sharpe A.N., Vernau K.M., Ueda Y., Montgomery E.A., Surmick J.D., Fernandez N., Ontiveros E., Walker A.L., Stern J.A. Reference intervals for radiographic, echocardiographic and N-terminal pro B-type natriuretic peptide values in healthy kittens. J. Feline. Med. Surg. 2021;23:293–301.
9. Vezzosi T., Schober K.E. Doppler-derived echocardiographic evidence of pulmonary hypertension in cats with left-sided congestive heart failure. J. Vet. Cardiol. 2019;23:58–68.
10. Serres F., Chetboul V., Tissier R., Gouni V., Desmyter A., Sampedrano C.C., Pouchelon J.L. Quantification of pulmonary to systemic flow ratio by a Doppler echocardiographic method in the normal dog: Repeatability, reproducibility, and reference ranges. J. Vet. Cardiol. 2009;11:23–29.
11. Abbott J.A., MacLean H.N. Two-dimensional echocardiographic assessment of the feline left atrium. J. Vet. Intern. Med. 2006;20:111–119.
12. Häggström J., Andersson Å.O., Falk T., Nilsfors L., OIsson U., Kresken J.G., Höglund K., Rishniw M., Tidholm A., Ljungvall I. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J. Vet. Intern. Med. 2016;30:1601–1611.
13. Rolph K.E., Cavanaugh S.M. Feline pulmonary hypertension: Are we overlooking an important comorbidity? J. Feline Med. Surg. 2022;24:e636–e646.
14. Borenstein N., Gouni V., Behr L., Trehiou-Sechi E., Petit A., Misbach C., Raillard M., Retortillo J.L., Pouchelon J.L., Pierrel A., et al. Surgical treatment of cor triatriatum sinister in a cat under cardiopulmonary bypass. Vet. Surg. 2015;44:964–969.
15. Uechi M., Harada K., Mizukoshi T., Mizuno T., Mizuno M., Ebisawa T., Ohta Y. Surgical closure of an atrial septal defect using cardiopulmonary bypass in a cat. Vet. Surg. 2011;40:413–417.
16. Miller L.R., Nemeth M., Flamm S.D., Sung C., Stainback R.F. Supracristal ventricular septal defect. Tex. Heart Inst. J. 2006;33:96–97.
17. Kardon R.E., Cao Q.L., Masani N., Sugeng L., Supran S., Warner K.G., Pandian N.G., Marx G.R. New insights and observations in three-dimensional echocardiographic visualization of ventricular septal defects: Experimental and clinical studies. Circulation. 1998;98:1307–1314.