
| 病例1 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:7个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:小脑皮质变性 | |
| 病例2 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:6.5个月 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:小脑皮质变性 | |
| 病例3 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:18个月 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:小脑皮质变性 | |
01 主诉及病史
病例1:
因步态异常就诊。它的同窝小猫(病例2)也出现了类似的症状。被领养后就一直生活在户外。主人无法判断临床症状是何时出现的。被领养时身体状况良好,只是有严重的弓形虫感染。由于天气寒冷,猫的耳尖已经脱落。
病例2:
自6周大时被一个农场领养以来,就出现了步态异常和颤抖的症状。同窝的五只小猫中有两只(包括病例1)也有类似症状。在2.5个月大时被兽医发现有轻微的小脑症状。目前主人报告说意向性震颤已经稳定,但步态异常有所恶化。
病例3:
在2个月大时被人从病例1和病例2居住的同一个农场领养。被领养时会斜着行走,但没有明显的震颤,渐渐地失去平衡。4个月大时临床症状变更加明显。震颤明显,在家具上跳跃时开始摔倒。血液检查未发现异常。随后临床症状继续恶化。
约6个月大时只能短距离行走,它表现出中度、相对对称的小脑共济失调,右侧前庭症状更为明显。全身出现意向性震颤。右侧没有威胁反应。医生建议进行MRI检查但遭到拒绝。使用了抗生素(克林霉素)和皮质类固醇进行经验性治疗,由于治疗无效在两周后停药。随后步态继续恶化。
由于震颤持续不断,尤其是在进食时,生活质量明显下降。该猫已经做了绝育手术,并注射了基本疫苗和驱虫药。是一只严格的室内猫,与另一只猫住在一起,另一只猫近期没有健康问题。
02 临床表现
病例1:
FIV/FeLV血清学阴性。在神经系统检查中,小脑共济失调涉及四肢。视力正常,威胁反应左侧消失,右侧减弱。右侧的生理性眼球震颤较慢。在诱发生理性眼球震颤的过程中,该猫采取了一种不正常的姿势,蜷缩起来,疑似前庭姿势。此外,诱发的水平眼震在猫从右侧绕到左侧后会短暂持续。
9个月大时进行了MRI检查,并进行了绝育手术。
10个月大时再次评估,临床症状稳定,可以活动,但有小脑共济失调和偶尔的细微意向性震颤。双侧眼球没有威胁反射。在评估生理性眼球震颤时,头部和颈部有夸张的伸展。
15个月大时,主人报告说神经状况恶化。小脑共济失调症状恶化,经常出现蹒跚和跌倒。猫呈驼背姿势。双侧威胁反应减弱至消失。头部运动后仍有眼球震颤。
16个月大时,再次接受了脑部MRI检查,并进行了安乐死。
病例2:
出现小脑共济失调,四肢肌张力过高和痉挛。跳跃反应迟缓,反应夸张。双侧眼球没有威胁反应。
8个月大时主人报告神经系统状况恶化,经常摔倒,也不再跳到家具上。震颤症状没有改变。主人称猫背部可能有不适感,尾巴也不正常。在神经系统检查中,猫患有中度到重度小脑共济失调,四肢肌张力减退和痉挛。同时还出现意向性震颤。视力正常,双侧没有威胁反应。
2岁时再次进行评估,主人称其步态稳定。和以前一样经常摔倒,而且仍无法爬上家具。此外行动似乎更加缓慢。过去几周一直在猫砂盆外排便,距离猫砂盆约两英尺远。过去一年里曾两次患鼻炎,并接受了抗生素治疗。当时仍与两只猫生活在一起,并且互动良好。在神经系统检查中,猫被抱住时会大声叫。有严重的小脑共济失调和意向性震颤。双侧没有威胁反应。没有生理性眼球震颤。头颈部姿势异常。前肢跳动减少,后肢没有跳动。四肢肌肉张力均有所提高。
3岁时因排尿困难被送到急诊科。诊断结果为猫泌尿系统综合症。在随后的24小时内出现了尿道堵塞,需要进行更多的侵入性手术。考虑到患者的神经系统状况,决定实施安乐死。在征得主人同意后,在安乐死前进行了脑部MRI检查。
病例3:
FIV/FELV血清学阴性。考虑到临床症状的严重性,以及对治疗缺乏反应,决定实施安乐死。在征得主人同意后,进行了死后脑部MRI检查。
三个病例的不同临床表现见下表。
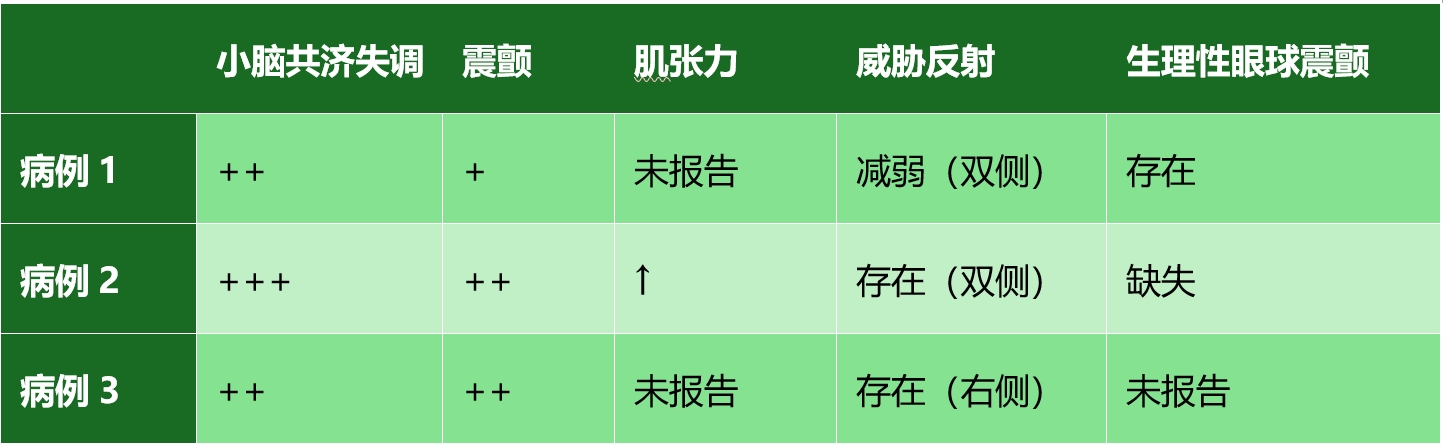
03 MRI结果
所有病例均出现小脑异常,主观感觉小脑体积缩小,小脑叶之间的脑脊液空间明显增大。这些变化与不同程度的第四脑室增大有关。3只猫的MRI图像如下图(A-C)所示,并与一只健康猫(下图D)进行了比较。与病例1相比,病例2和病例3在发病时的MRI结果更明显。
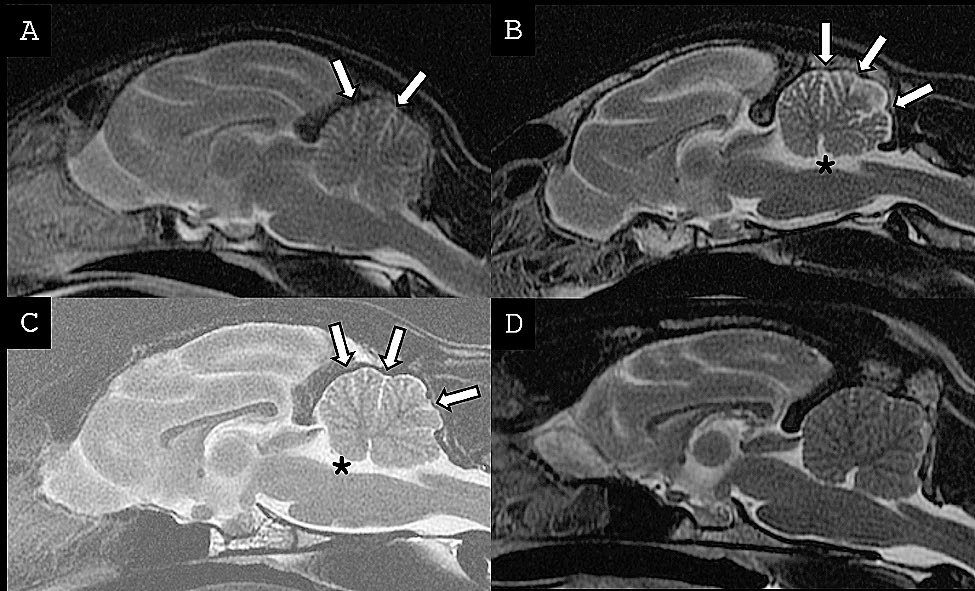
病例1在8个月内进行了两次脑部MRI检查(下图)。两次结果相比,小脑叶之间的脑脊液间隙主观上有所增大,符合小脑皮质进行性变性。3只猫的脑部均未发现其他MRI异常。病例1号和病例2的T1w图像没有发现异常增强的迹象。
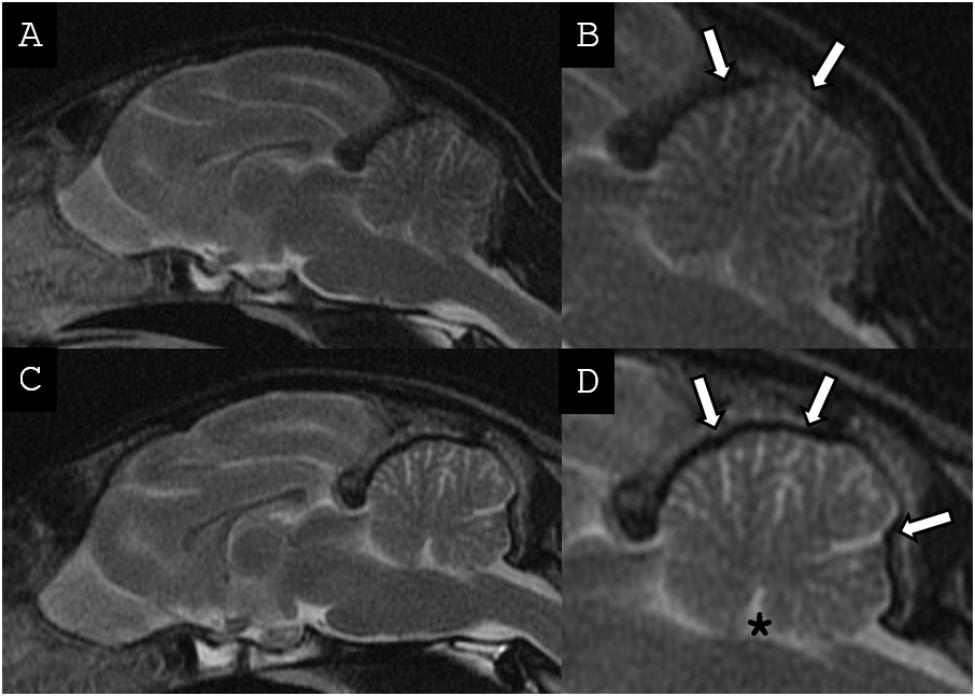
在中矢状面T2w FSE图像上测量了小脑周围的脑脊液空间(下图A)、小脑大小(下图A)、小脑与整个大脑的比例、脑干/小脑比例(下图B)。
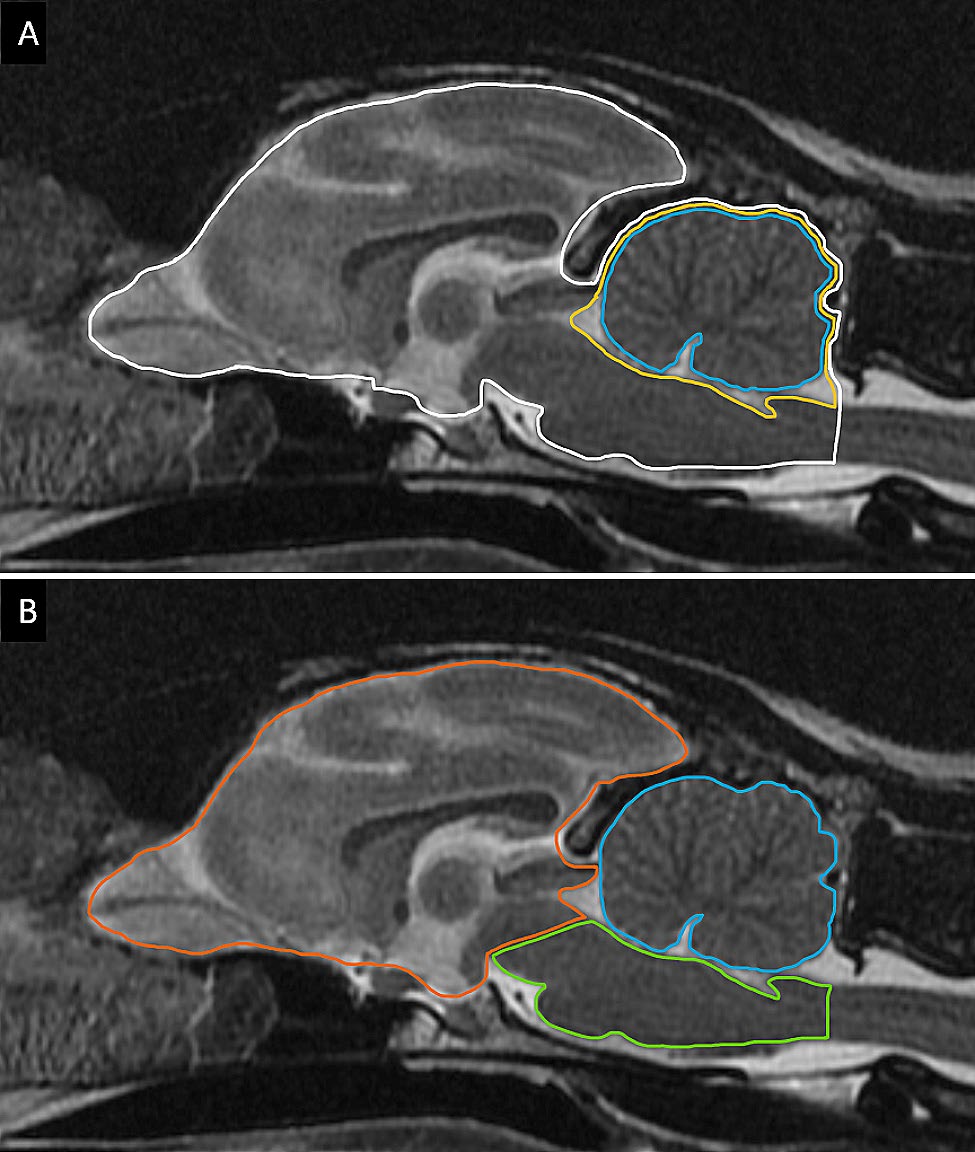
为了进行比较,还对由10只无颅内病变的成年猫(年龄中位数8.4岁)组成的对照组进行了上述测量。下表列出了这些测量值结果。
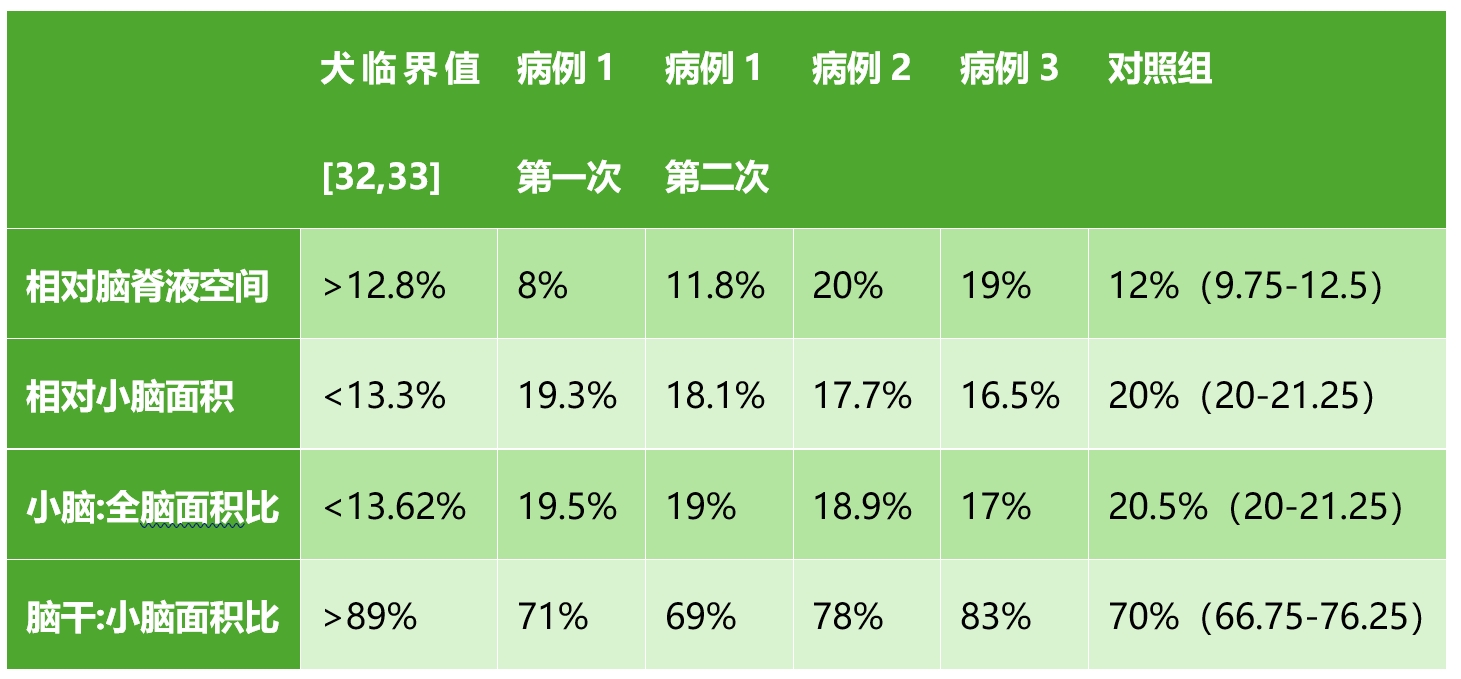
就相对脑脊液空间而言,病例2和病例3的相对空间高于狗的12.8%临界值,也高于对照组所测得的12%中位值。病例2和病例3的结果提示小脑皮质变性。病例1是受影响最小的猫,其相对脑脊液空间低于或在对照组范围内,也低于犬的临界值,但在两次MRI检查之间,相对脑脊液空间在增加。
在小脑相对大小和小脑:全脑面积比方面,所有猫患者的结果均小于对照组,但高于犬的临界值。
在脑干:小脑面积比方面,病例2和病例3的比率高于对照组。受影响最小的病例1的比率与对照组数值相当。所有猫患者和对照组的比值都小于狗的临界值。
04 病理结果
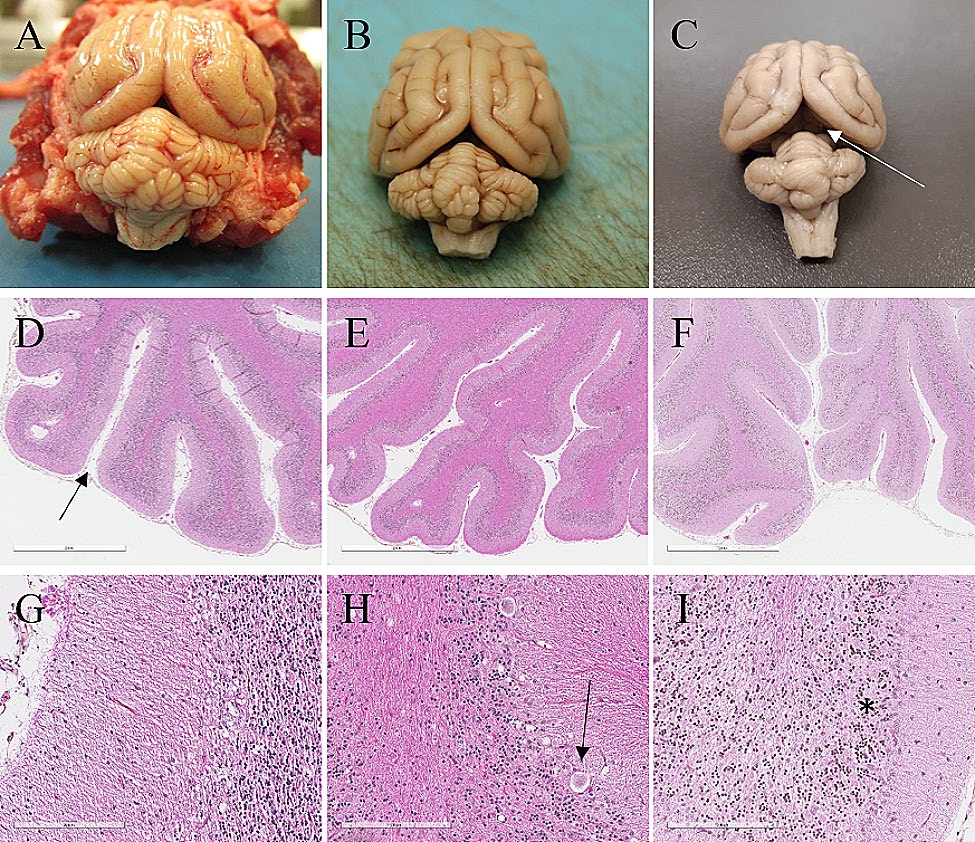
3个病例的小脑体积都有不同程度的缩小,表现为大脑和小脑之间的空间增大。病例3的裂隙尤为明显(下图ABC)。小脑沟变宽,颗粒层的细胞密度不同程度地降低(下图DEF)。最突出和一致的特征是浦肯野细胞明显丧失,导致不同程度的空泡化(下图GHI)。
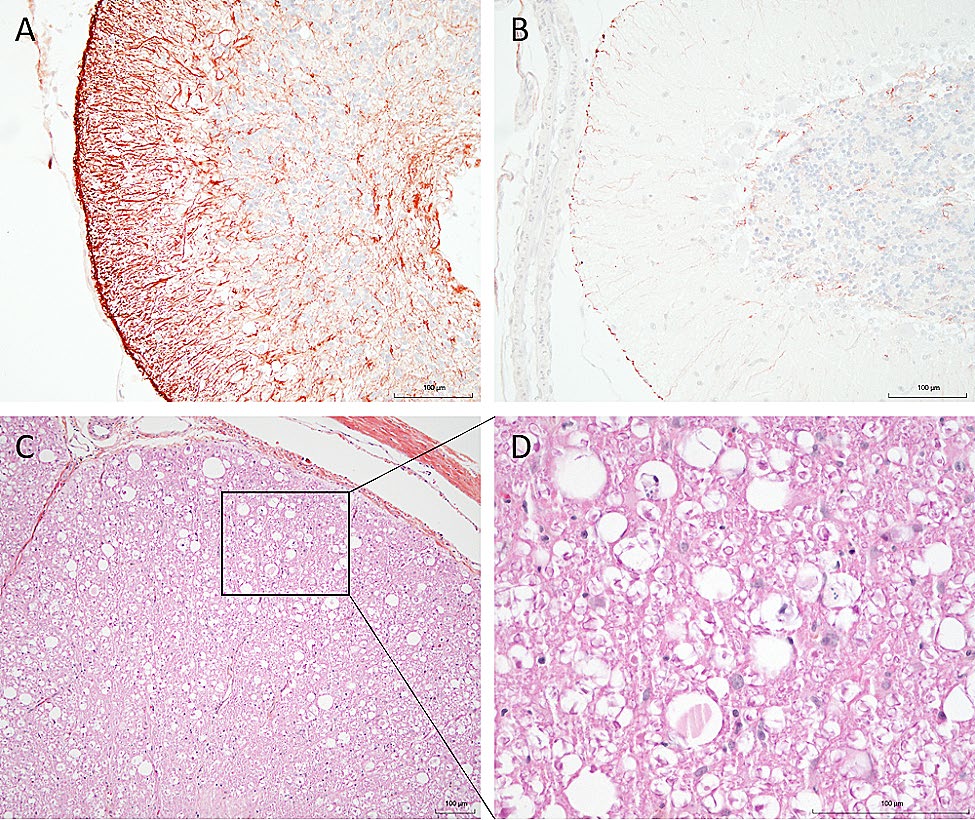
Bergmann胶质细胞中度到明显增生,突起辐射到分子层(下图AB)。小脑白质中偶见空泡。所有病例的组织病理学变化都符合小脑皮质变性。病例1的脊髓也出现了退行性病变。脊髓各节段均出现严重程度不等的双侧对称性沃勒氏变性(下图CD)。病变在外侧和腹侧漏斗部更为明显,而且往往局限于漏斗部,尤其是脊髓小脑升支和其他降支。
05 讨论
遗传性神经系统疾病在家养动物中非常罕见,尤其是在猫中[1]。大多数描述过的猫遗传性疾病都属于储积性疾病家族,包括神经节苷脂病[2]、神经细胞类脂质沉着病[3]等。
影响小脑发育的疾病虽然在猫中比较常见,但遗传性的小脑疾病中并不常见。例如,在子宫内或产后感染了猫泛白细胞减少症病毒的新生幼猫中,小脑发育不全是一种常见病[4]。
除了发育性小脑疾病外,主要影响小脑的疾病在猫中并不多见。在弓形虫病和猫传染性腹膜炎等感染性疾病中,所导致的脑膜脑炎可能会影响小脑,但受累范围相当广泛[5,6]。不过,也有一些关于潜在遗传性小脑皮质变性的报道[7,8]。
小脑皮质变性通常被称为小脑皮质非营养不良症,被认为是家畜最常见的神经退行性疾病之一[9]。它被定义为由于遗传或代谢缺陷导致完全分化的小脑细胞(最常见的是浦肯野细胞)过早变性[10]。
该病已在多种家养动物中出现[11],包括狗[12-18]、马[19-23]、山羊[24]、绵羊[25]、兔子[26]、奶牛[27]和猫[7,8,28-31]。虽然已对狗和马的遗传病因学和诊断进行了广泛研究[32,33],但在罕见的猫病例中,除尸体解剖外,很少对诊断标准进行评估。
本报告介绍了3例猫小脑皮质变性病例的临床表现、影像诊断和尸检结果,并对其他物种(狗)的诊断标准进行了比较分析。进一步证实了这种疾病可能存在遗传病因,因为其中两个病例是直系同胞,而第三个病例出生在同一个农场,两者之间相差几年。这就提出了一个问题,即该农场的猫群中存在潜在的遗传缺陷。
几乎所有小脑皮质变性病例的病理变化都非常相似。主要受影响的是浦肯野细胞,它们会发生进行性变性和丢失。其他经常观察到的特征包括小脑白质内的空泡化、色素溶解和轴突变性[11]。
值得注意的是,小脑皮质变性并不只导致浦肯野细胞的丧失,还可能继发于各种疾病(感染性或非感染性疾病)。在人类中,多发性硬化就是这种情况的一个例子。这种疾病会导致免疫介导的轴突脱髓鞘,从而影响神经元的完整性。在小脑中,局部脱髓鞘可引起不同程度的浦肯野细胞缺失,导致临床小脑共济失调[34]。
总之,本报告支持猫小脑皮质变性的潜在遗传因素。尽管在MRI检查中发现了主观的小脑异常,但在其他物种中用于诊断这种疾病的一些MRI客观测量方法在猫身上仍有应用前景。狗和猫的MRI形态分析也不尽相同,因此需要确定猫的特定临界值。小脑的死后评估结合出生后出现的临床症状仍是最终诊断的金标准。
文献来源:Giron C, Hélie P, Parent J, Boutin M, St-Jean G. Clinical, imaging and histopathological characterization of a series of three cats with cerebellar cortical degeneration. BMC Vet Res. 2024 Jun 19;20(1):263.
参考文献
1.Passantino A, Masucci M. Congenital and inherited neurologic diseases in dogs and cats: legislation and its effect on purchase in Italy. Veterinary World. 2016;9(5):437–43.
2.Ueno H, Yamato O, Sugiura T, Kohyama M, Yabuki A, Miyoshi K, et al. GM1 gangliosidosis in a Japanese domestic cat: a new variant identified in Hokkaido, Japan. J Vet Med Sci. 2016;78(1):91–5.
3.White C, Mortier J, Verin R, Maddox T, Goncalves R, Sanchez-Masian D. MRI findings of neuronal ceroid lipofuscinosis in a cat. JFMS Open Rep. 2018;4(1):2055116918757330.
4.Résibois A, Coppens A, Poncelet L. Naturally occurring parvovirus-associated feline hypogranular cerebellar hypoplasia– A comparison to experimentally-induced lesions using immunohistology. Vet Pathol. 2007;44(6):831–41.
5.Rissi DR. A retrospective study of the neuropathology and diagnosis of naturally occurring feline infectious peritonitis. J Vet Diagn Invest. 2018;30(3):392–9.
6.Del Vecchio OV, Grande C. Toxoplasma Gondii multifocal central nervous system infiltration in an apparently immunocompetent cat in Italy. Veterinary parasitology, regional studies and reports. 2021;25:100605.
7.Inada S, Mochizuki M, Izumo S, Kuriyama M, Sakamoto H, Kawasaki Y, et al. Study of hereditary cerebellar degeneration in cats. Am J Vet Res. 1996;57(3):296–301.
8.Willoughby K, Kelly DF. Hereditary cerebellar degeneration in three full sibling kittens. Vet Rec. 2002;151(10):295–8.
9.Vandevelde M, Higgins RJ, Oevermann A. Veterinary neuropathology: essentials of theory and practice. Chichester, West Sussex: Wiley-Blackwell; 2012.
10.Sisó S, Hanzlícek D, Fluehmann G, Kathmann I, Tomek A, Papa V, et al. Neurodegenerative diseases in domestic animals: a comparative review. Vet J. 2006;171(1):20–38.
11.Miller MA, Owen TJ, Bruyette DS, Scott-Moncrieff JC, Ramos-Vara JA, Weng HY, et al. Immunohistochemical evaluation of Canine Pituitary Adenomas obtained by Transsphenoidal Hypophysectomy. Vet Pathol. 2018;55(6):889–95.
12.Wade CM, Pan AYH, Taylor RM, Williamson P. Cerebellar Abiotrophy in Australian Working Kelpies is Associated with two major Risk Loci. Genes (Basel). 2022;13(10).
13.Bertalan A, Glass EN, Kent M, De LaHunta A, Bradley C. Late-onset cerebellar abiotrophy in a Labrador Retriever. Aust Vet J. 2014;92(9):339–42.
14.Sen C, Sharma AK, Randhawa CS, Gupta K. Cerebellar cortical Abiotrophy in Young Labrador-Retrievers. Top Companion Anim Med. 2017;32(1):20–3.
15.Berry ML, Blas-Machado U. Cerebellar abiotrophy in a miniature schnauzer. Can Vet J. 2003;44(8):657–9.
16.Sandy JR, Slocombe RE, Mitten RW, Jedwab D. Cerebellar abiotrophy in a family of Border Collie dogs. Vet Pathol. 2002;39(6):736–8.
17.Kent M, Glass E, deLahunta A. Cerebellar cortical abiotrophy in a beagle. J Small Anim Pract. 2000;41(7):321–3.
18.van Tongern SE, van Vonderen IK, van Nes JJ, van den Ingh TS. Cerebellar cortical abiotrophy in two Portuguese podenco littermates. Vet Q. 2000;22(3):172–4.
19.Scott EY, Woolard KD, Finno CJ, Penedo MCT, Murray JD. Variation in MUTYH expression in arabian horses with cerebellar Abiotrophy. Brain Res. 2018;1678:330–6.
20.Sadaba SA, Madariaga GJ, Botto CM, Carino MH, Zappa ME, García PP, et al. First report of cerebellar abiotrophy in an arabian foal from Argentina. Open Vet J. 2016;6(3):259–62.
21.Scott EY, Penedo MCT, Murray JD, Finno CJ. Defining trends in Global Gene expression in arabian horses with cerebellar Abiotrophy. Cerebellum. 2017;16(2):462–72.
22.Cavalleri JMV, Metzger J, Hellige M, Lampe V, Stuckenschneider K, Tipold A, et al. Morphometric magnetic resonance imaging and genetic testing in cerebellar abiotrophy in arabian horses. BMC Vet Res. 2013;9(1):105.
23.Blanco A, Moyano R, Vivo J, Flores-Acuña R, Molina A, Blanco C, et al. Purkinje cell apoptosis in arabian horses with cerebellar abiotrophy. J Vet Med Physiol Pathol Clin Med. 2006;53(6):286–7.
24.Koehler JW, Newcomer BW, Holland M, Caldwell JM. A novel inherited cerebellar Abiotrophy in a cohort of related goats. J Comp Pathol. 2015;153(2–3):135–9.
25.Milne EM, Schock A. Cerebellar abiotrophy in a pedigree Charollais sheep flock. Vet Rec. 1998;143(8):224–5.
26.Sato J, Sasaki S, Yamada N, Tsuchitani M. Hereditary Cerebellar degenerative disease (cerebellar cortical abiotrophy) in rabbits. Vet Pathol. 2011;49(4):621–8.
27.Kemp J, McOrist S, Jeffrey M. Cerebellar abiotrophy in Holstein Friesian calves. Vet Rec. 1995;136(8):198.
28.Biolatti C, Gianella P, Capucchio MT, Borrelli A, D’Angelo A. Late onset and rapid progression of cerebellar abiotrophy in a domestic shorthair cat. J Small Anim Pract. 2010;51(2):123–6.
29.Negrin A, Bernardini M, Baumgärtner W, Castagnaro M. Late onset cerebellar degeneration in a middle-aged cat. J Feline Med Surg. 2006;8(6):424–9.
30.Barone G, Foureman P, deLahunta A. Adult-onset cerebellar cortical abiotrophy and retinal degeneration in a domestic shorthair cat. J Am Anim Hosp Assoc. 2002;38(1):51–4.
31.Shamir M, Perl S, Sharon L. Late onset of cerebellar abiotrophy in a siamese cat. J Small Anim Pract. 1999;40(7):343–5.
32.Thames RA, Robertson ID, Flegel T, Henke D, O’Brien DP, Coates JR, et al. Development of a morphometric magnetic resonance image parameter suitable for distinguishing between normal dogs and dogs with cerebellar atrophy. Vet Radiol Ultrasound. 2010;51(3):246–53.
33.Henke D, Böttcher P, Doherr MG, Oechtering G, Flegel T. Computer-assisted magnetic resonance imaging brain morphometry in American Staffordshire Terriers with cerebellar cortical degeneration. J Vet Intern Med. 2008;22(4):969–75.
34. Redondo J, Kemp K, Hares K, Rice C, Scolding N, Wilkins A. Purkinje Cell Pathology and loss in multiple sclerosis cerebellum. Brain Pathol. 2015;25(6):692–700.