
健康犬猫的麻醉相关死亡风险分别为0.05%和0.11%,患病动物的风险要高得多。对于健康人来说,这个数值各不相同,但许多研究报告称大约为0.001%(即每10万人中有一人死亡)。
尽管在过去几十年中,由于麻醉药物、监测和培训方面的改进,小动物的麻醉相关死亡率有了显著改善,但仍落后于人类。许多猫狗的死亡归因于心血管疾病,因此,及时识别和治疗低血压可以提高存活率。在人类中,麻醉期间的低血压与心肌衰竭、谵妄、中风和肾损伤有关,因此通常会得到及时和积极的治疗。
如本系列第一部分所述,动脉血压在临床实践中很容易监测,但对无创测量结果的解释可能具有挑战性。动脉血压监测仪在英国兽医诊所的使用相对广泛,近一半的诊所至少拥有一台设备。
但事实上,只有约20%的诊疗机构在麻醉期间真正使用动脉血压监测仪。这一统计数字有些出人意料,但反映出了医院对员工使用此类设备的培训不足,或认为使用监测设备过于麻烦。但随着兽医麻醉教育的普及,这种情况可能会有所改善。
当动物发生低血压时,可能由于医生对病因缺乏了解,因此治疗可能会遇到困难。此外,针对动物患者的特许心血管支持药物和其他可用的处方药供应有限。
本文将介绍全麻期间发生低血压的病理生理学,以便让从业人员在发生低血压时更有信心地进行处理。本文还将讨论维持血压的药物建议,但至关重要的是进一步改进麻醉动物的血压监测。
01 低血压的定义
在人类文献中,术中低血压一词用于描述全麻期间出现的低血压。然而,在兽医学中,非手术治疗(如影像学检查)通常也需要进行全麻。因此,为清楚起见,本文将使用围麻醉期低血压(PAH)一词。包括在全麻期间任何时候发生的低血压,无论是手术还是检查。
PAH没有统一的定义,因为不同物种、年龄、合并症和麻醉医生之间可能引发治疗的动脉血压值各不相同。例如,平均动脉压(MAP)值低于60 mmHg可用于定义健康成年犬的低血压,但对于幼犬可能会使用较低的值,而对于疑似颅内病变或患有心肌疾病的犬则会使用较高的值。
同样,收缩期动脉压(SAP)低于90 mmHg和舒张期动脉压(DAP)低于40 mmHg时也可能需要治疗,即使MAP值可以接受。对于已有高血压(如肾病)的动物,治疗的触发因素可能是动脉血压的相对变化,而不是实际数值。在本文中,除非另有说明,否则MAP低于60 mmHg将被定义为PAH。
02 全麻期间低血压的病理生理学和处理方法
低血压是全麻期间经常出现的并发症。在最近的一项单中心研究中,18个月内所有接受麻醉的犬中有32%在麻醉过程中的某个阶段出现过低血压。PAH的危险因素如下:
- 老年动物
- 体况评分较高的动物
- 原有低血压或低血容量
- 低蛋白血症
- 硬膜外麻醉或脊髓麻醉
- 手术时间长
- 紧急外科手术
- 心脏病
- 使用抗高血压药物(如血管紧张素转换酶抑制剂、β受体阻滞剂)
- 存在原发疾病(如阿狄森氏病、肝病,尤其是伴有黄疸和低蛋白血症时)
- 妊娠
- 机械通气
- 低体重
- 畸形犬种
尽管PAH可能是轻微和短暂的,尤其是在诱导后不久,但持续性PAH被认为是一种急症,需要进行相应的治疗。外周动脉触诊有时被用作外周组织灌注充足的代用指标,但实际感受到的是脉压或收缩压与舒张压之间的差值。外周脉搏可能在MAP值低至40 mmHg时被触诊到,因此可能具有误导性。
动脉壁绷紧度可提供更多信息,如果软而塌陷,则可作为低血压的指标。不过,触诊非常主观,而且取决于操作者。为实现一致性并消除主观性,必须测量动脉血压。
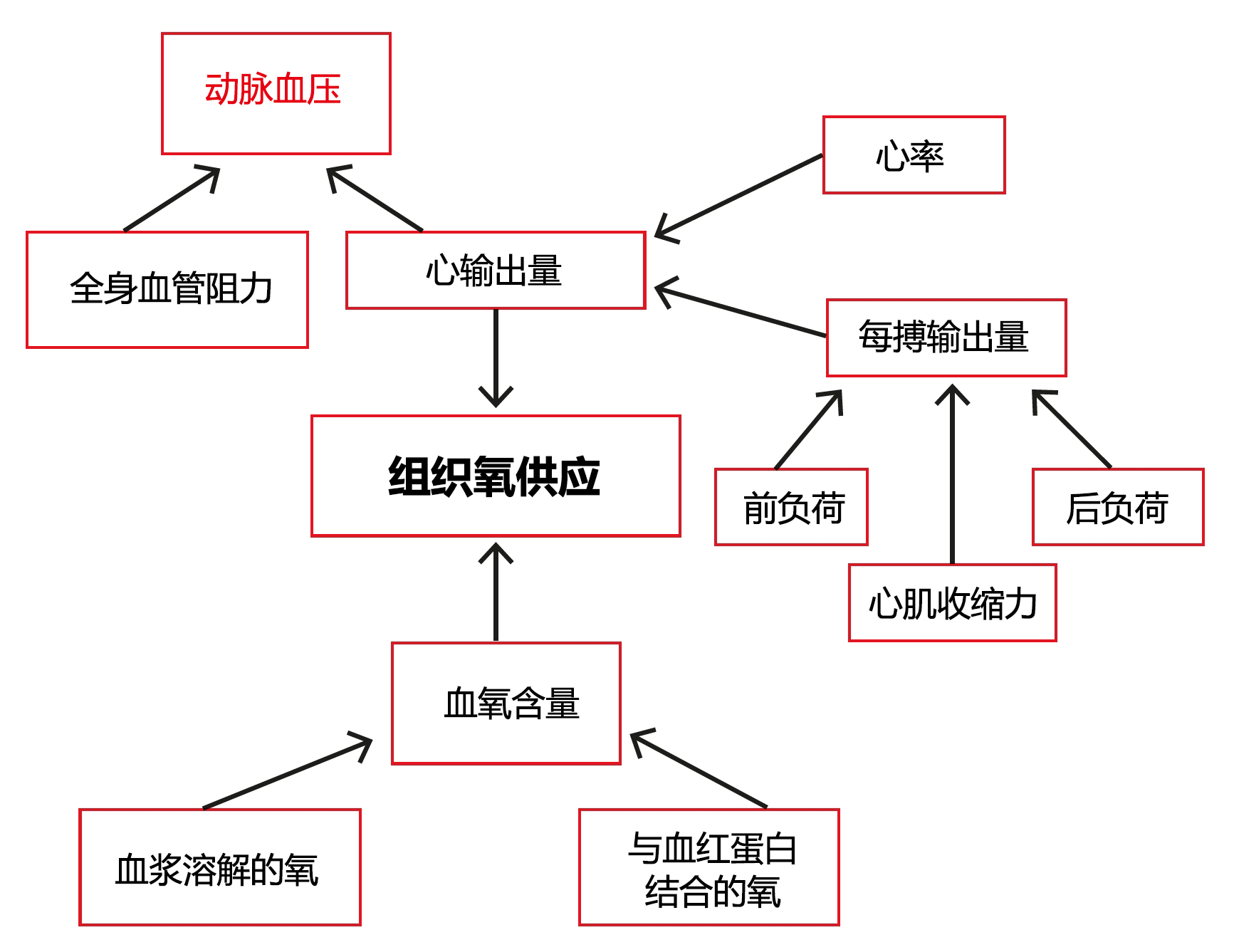
与全麻相关的低血压通常由多种因素造成。本系列第一部分概述了MAP的基本计算方法,即MAP=心输出量(Qt)×全身血管阻力(SVR)。虽然动脉血压是组织灌注的驱动压力,但它取决于Qt和SVR,其中Qt是心脏在一分钟内泵送的血量,而SVR是血管对循环血液施加的力。组织的供氧量取决于Q̇t和血液中的含氧量。
虽然可以测量Qt值,但对于兽医临床实践而言,测量方法一般都过于侵入性。随着技术的进步,这种情况可能会有所改变,但目前动脉血压的测量尽管存在种种缺陷,仍被用作组织血流的主要指标。
Qt是每搏输出量(SV)与心率(HR)的乘积。因此,低动脉血压一定是由等式右侧的任何因素(即低HR、SV或SVR)减少造成的。图1展示了这些因素之间复杂的相互作用,这些因素对组织氧输送起着重要作用。
1. 心动过缓
正常静息HR很难界定,因为不同品种、年龄和体型的狗,以及在家庭或医院环境中测量的HR都存在明显差异。在正常静息条件下,成年狗的HR在每分钟 70-120次/分之间变化。猫的HR范围在130-220次/分,具体取决于环境。新生幼崽和未成年动物的静息HR高于成年动物,他们的Qt与HR有关。在麻醉期间,应努力使未成年动物保持较高的HR。
在猫狗麻醉期间,心率降低的情况比较常见。应注意任何预先存在的心动过缓,并在认为适当时进行调查。心动过缓会在心电图轨迹出现一致的P波后伴有QRS-T波群,但HR较低。可能会出现缓慢性心律失常,如窦性心律失常,也可能会看到游走性起搏(P波形态变化)。窦性复律之间的长时间停顿可能会导致出现穿插的逸搏(室性复律),这是对低HR的正常反应,不应抑制这些逸搏。心动过缓可能是正常的生理现象(如运动量大的动物),但也可能是病理现象(如心脏病)。
某些犬种可能会因迷走神经张力高而导致静息HR过低,例如迷你腊肠犬和短头型犬猫。确定何时治疗心动过缓可能有些主观,通常要根据临床医生的经验。一般来说,如果HR较低,并且还发现了PAH,那么就应该进行治疗。
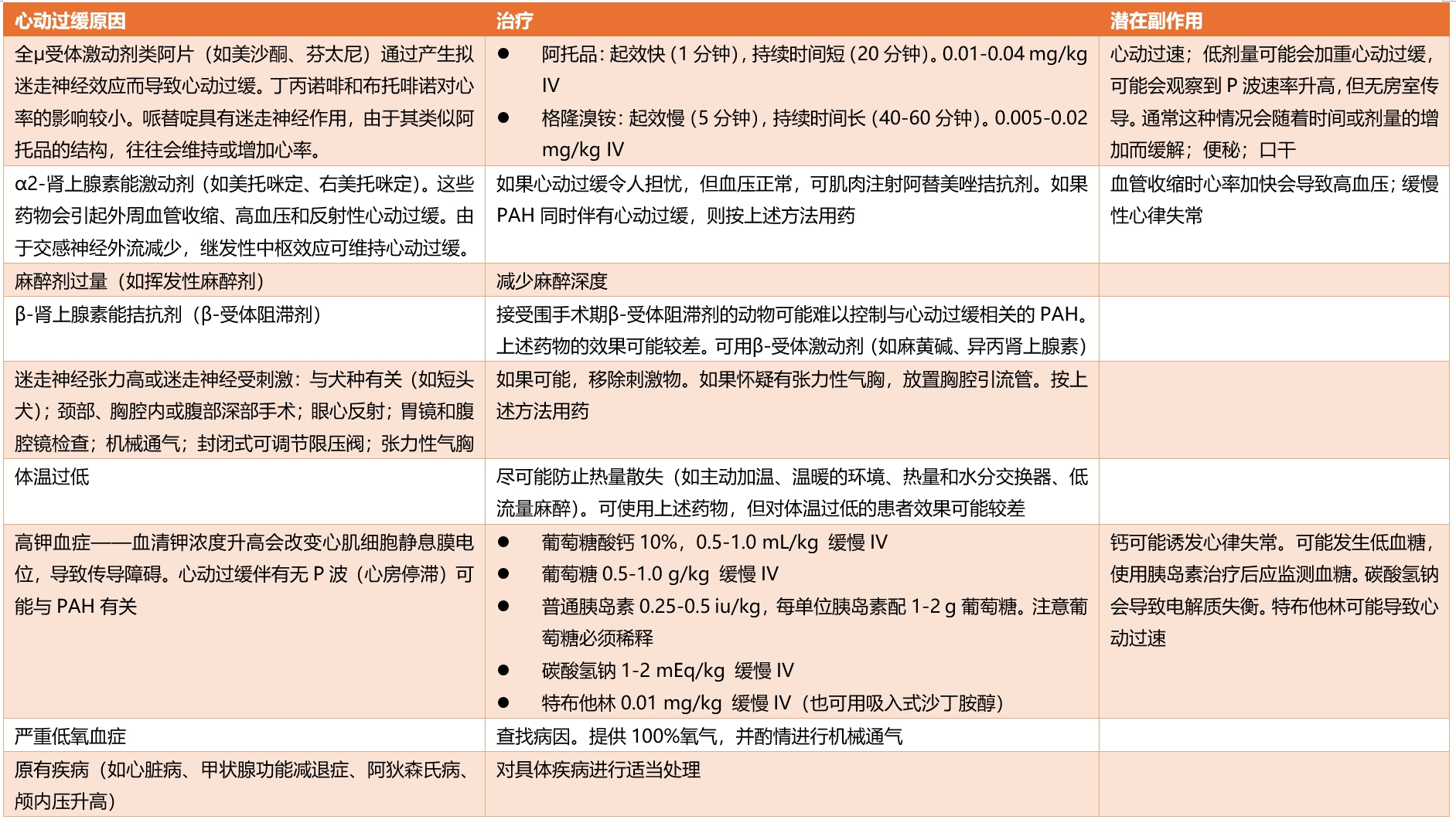
然而,在某些情况下,即使血压正常,HR过低也可能会引起关注,并可能需要治疗。HR过低可能会导致动物发生恶性心律失常或心搏过缓。表1列出了可能导致PAH的心动过缓的原因和相关治疗方法。
2. 每搏输出量(SV)
SV的定义是心脏每次收缩时射出的血液量。它与前负荷、收缩力和后负荷这三个因素密切相关,其中每个因素的改变都可能导致PAH。
(1)前负荷
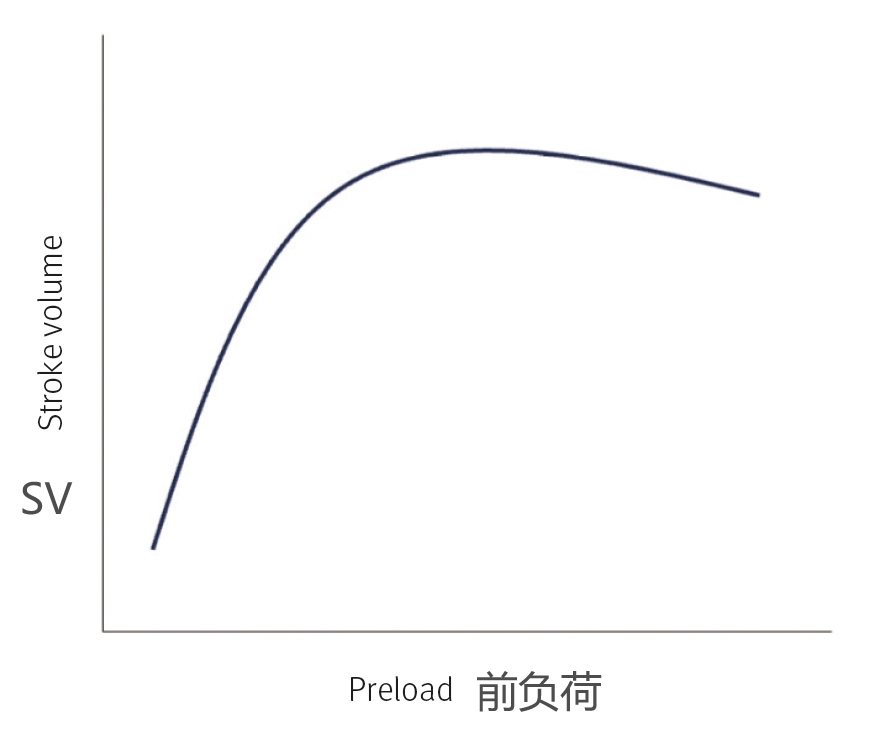
前负荷指的是舒张末期心肌内的扩张量,与返回心脏或静脉回流的血量有关。这可以用弗兰克-斯塔林曲线来说明(图2)。该曲线描述了舒张时进入心脏的血液量与收缩时心脏收缩强度之间的相关性。
根据这一原理,当心脏在舒张期充满较大的血量(前负荷)时,会拉伸心脏的肌肉纤维。这种拉伸增强了心肌细胞内肌动蛋白丝和肌球蛋白丝的排列,提高了肌纤维对钙的反应能力,从而使心脏在收缩时收缩更有力。过度拉伸时曲线会达到一个高点,而进一步拉伸时SV实际上会下降。
最常见的情况是,静脉回流减少与低血容量有关。这可能是相对的,也可能是绝对的。相对低血容量是指与血管扩张有关的低血容量,稍后将对此进行讨论。绝对低血容量是由液体流失引起的。
除了正常途径的少量液体流失(如尿液分泌)外,全麻期间的大量液体流失主要是由手术出血造成的。急性失血可能会导致HR升高,但这种生理反应在麻醉期间可能会有所减弱。
麻醉医生应通过评估吸血瓶中的集血量和/或计数和称重浸过血的棉布来监测失血量。应计算动物的血容量(正常值为狗80-90 mL/kg,猫50-60 mL/kg),对于以前没有贫血的动物,可使用晶体液补充20%的血容量。如果使用等渗晶体液作为补充,则应输入三倍于失血量的液体,以考虑到液体在体内的重新分布。
如果失血量超过计算总血量的20%,则应考虑输血。在手术出血期间,应注意不要过度增加血压,否则可能会使情况恶化。然而有时很难在组织灌注和氧气输送的需要与加重出血的风险之间取得平衡。
明显低白蛋白血症的患者,无论其病因如何,都会因胶体渗透压显著降低而无法维持血管内液体。这些动物有患PAH的风险。避免使用扩张血管的药物(如乙酰丙嗪或硬膜外局部麻醉剂)可以在一定程度上减轻这种风险。使用胶体或人类白蛋白可以恢复胶体渗透压,但使用这些液体还存在争议,应谨慎使用。
患有肥厚型心肌病 (HCM) 的猫心脏舒张功能会发生改变(即由于心肌增厚,心脏无法充分充盈)。虽然这只是对病情的过度简化,但前负荷会降低(尽管这些动物通常会出现贫血),并可能导致PAH的发生。应尽可能避免注入液体,因为这会诱发心力衰竭。
对于患有HCM的猫,应使用血管加压剂治疗PAH,因为SVR的增加有助于降低这些病例中动态阻塞的发生率。但是,后负荷增加可能会增加心肌做功,从而增加心肌需氧量,并可能诱发心律失常。应采用平衡的麻醉技术来防止或尽量减少这些猫发生PAH。
心动过速会对前负荷和SV产生不利影响。由于舒张期缩短,这就减少了心腔充盈的时间。然而,麻醉期间发生的心动过速导致PAH的情况并不常见。更常见的是心动过速可能是对低血压的生理反应,或者是对麻醉或镇痛不足的反应,并与血压升高有关。尽管心肌需氧量增加,但严重心动过速仍会导致冠状动脉灌注和供氧减少,因此应尽可能找出原因并加以治疗。
由于某种阻塞造成的静脉回流障碍也会导致前负荷降低,并可能导致PAH。静脉回流可能受到以下因素的影响:
- 仰卧位
- 机械通气
- 腹部或胸部血管的手术操作
- 气胸
- 肺栓塞
仰卧位
仰卧位,尤其是背侧卧位,是腹腔内脏压迫腔静脉的一种物理效应。任何动物都可能出现这种情况,但肥胖、妊娠或腹部病变(如腹水、胃扩张和胃下垂、肿瘤)会加重这种情况。处理方法是将动物稍稍偏向一侧,以尽量减少对腔静脉的影响,如果是胃扩张和胃内积气,则应尽快放气。
胃镜检查和腹腔镜检查也会产生类似的影响。在腹腔镜手术过程中,动物倾斜会对Qt和血压产生不同的影响,其生理交互作用非常复杂。不过,头向上倾斜可能比头向下姿势更不利于Qt。
机械通气
机械通气通过两种机制导致前负荷降低:
- 由于胸内正压,吸气时腔静脉(可能还有主动脉)受到挤压
- 吸气时对心脏本身的压迫阻碍了心脏的放松和充盈
如果发现机械通气导致PAH,则应尝试鼓励自主通气(适当降低麻醉深度)。如果必须进行机械通气,则应使用较短的吸气时间、较快的呼吸频率和较小的潮气量,以最大限度地缩短平均胸内压的持续时间并降低其幅度。使用呼气末正压可能会使情况恶化。已存在体液不足的患者更容易受到机械通气对心血管的影响,因此应酌情进行体液补充。
腹部或胸部血管的手术操作
对腹部或胸部血管进行手术操作会严重影响Qt,表现为前负荷下降导致的低血压。麻醉医生和外科医生之间的沟通至关重要,这样才能最大限度地减少静脉回流的中断。在某些大型外科手术(如胸腔内肿块切除术)中,手术过程中的血流中断可能会持续很长时间。麻醉医生能做的非常有限,只能提醒外科医生这种情况正在发生,最好分阶段切除肿块。
气胸
气胸如果在麻醉过程中未被发现,可能会迅速致命。胸腔内压力升高可引起迷走神经刺激和心动过缓,也会阻碍静脉回流和降低前负荷。麻醉期间出现的气胸与机械通气、气管创伤、某些局部麻醉技术和胸椎半切除术等有关。必须快速识别问题并进行胸腔引流。
肺栓塞
肺栓塞(即血块、脂肪或空气)可导致急性和危及生命的PAH。肺血管内的堵塞会对右心室的输出量产生重大影响,进而通过降低前负荷影响血流质量。其他表现还包括急性低氧血症和潮气末二氧化碳浓度降低。肺栓塞的治疗具有挑战性,死亡率很高。
使用液体疗法治疗低血压注意事项
静脉输液治疗可以挽救生命,是麻醉、手术和危重病人管理的重要组成部分。输液过少或过多都会对患者的预后产生不利影响,并导致发病和死亡。过去,无论怀疑的病因是什么,治疗PAH的方法通常是输注等渗晶体液。现在人们已经知道大量输液会损伤血管内皮糖萼层 (EGL),导致液体超负荷,从而直接造成危害。
EGL是一种保护性的蛋白质结构,位于血管内皮的两侧,控制着血管内空间和间质之间的液体流动。EGL受损会导致间质水肿,从而进一步影响组织的氧气输送。
液体栓塞还会刺激心房利尿钠肽的释放,从而导致EGL进一步脱落。不适当的液体疗法可能会导致肺部液体增加,并可能导致气体交换失调。
随着相关知识的不断进步,有关如何以及何时使用液体来控制手术和危重病人低血压的指南也会定期更新。所谓的“液体反应性”患者对液体疗法的反应是随着前负荷的增加而增加SV。这一现象基于弗兰克-斯塔林曲线,但需要注意的是,有液体反应的患者并不一定需要输液,应利用临床敏锐性和监测技术做出决定,只有在已知或怀疑有液体丢失的情况下才可给予液体输注。
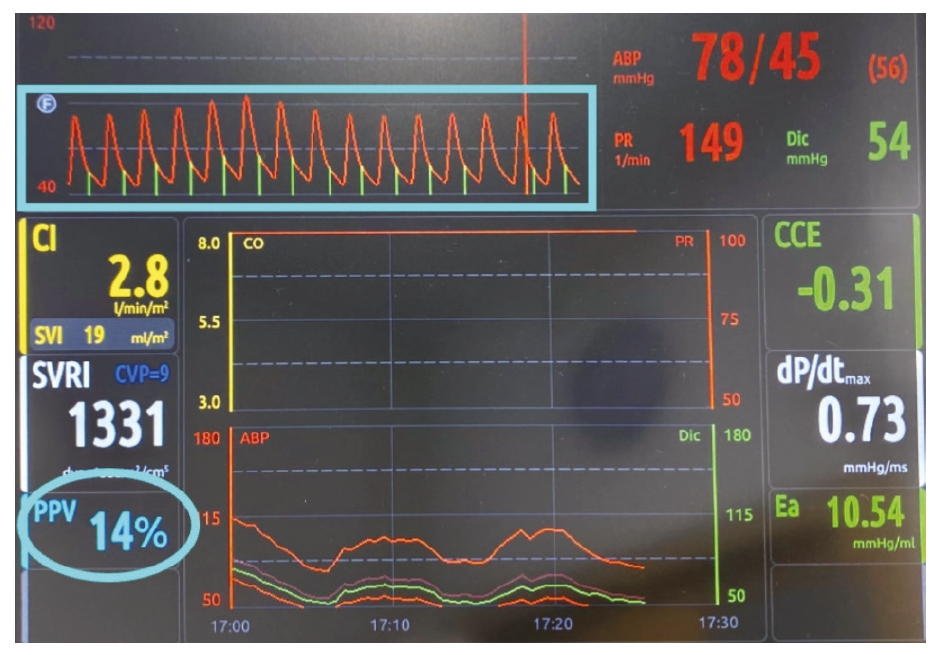
目标导向输液疗法(GDT)可用于预测哪些患者在输液后血流动力学会得到改善。脉压变异(PPV)、胸廓变异指数(PVI)或使用经食道超声心动图直接观察心腔均可用于估计SV的变化。PPV和PVI都是基于波形图(来自脉搏血氧仪探头)或动脉血压波形的呼吸变化(图3)。不过它们需要正压通气,而且在心律失常的情况下不准确,但比单纯的血压更好地显示Qt。虽然这种技术在兽医实践中的应用有限,但未来的发展很可能会变得更加可行。
在缺乏监测以指导GDT的情况下,如果怀疑PAH的病因是液体流失,则可以使用所谓的小型液体挑战。包括快速给予小剂量液体(3-5 mL/kg),然后评估反应(如心率下降和/或动脉血压上升)。遗憾的是,即使是这些小剂量液体也可能会损伤EGL,而且即使对小剂量液体做出了积极反应,也不总能代表需要输液。
(2) 收缩力
心肌收缩力(或肌力)是指心肌在收缩时收缩和产生力量的能力。它受多种因素影响,包括心肌的内在特性、神经激素、药物和电解质平衡以及患者的酸碱状态。如前所述,随着静脉回流的增加(弗兰克-斯塔林机制),收缩力会变得更强,但会达到一个高峰。因此,注入液体可能会增加收缩力。但对于血容量不足的动物应避免输注液体,因为这会产生不利影响。应通过使用正性肌力药物(如多巴胺或多巴酚丁胺)或治疗潜在病因来控制收缩力低下。下面将讨论导致收缩力低下的潜在原因。
心脏疾病
心脏疾病,如扩张型心肌病,会削弱心肌功能,导致收缩功能减弱和血流湍急。如果这些患者出现PAH,可通过药物控制血压。不应给动物输液,因为这可能会使动物陷入充血性心力衰竭。对于患有扩张型心肌病的动物,可以使用多巴酚丁胺等正性肌力药物。猫的严重HCM也会因心肌梗塞和肌肉瘢痕而导致收缩功能发生变化。一般来说,患有严重心脏病的动物不适合全麻。
麻醉药物
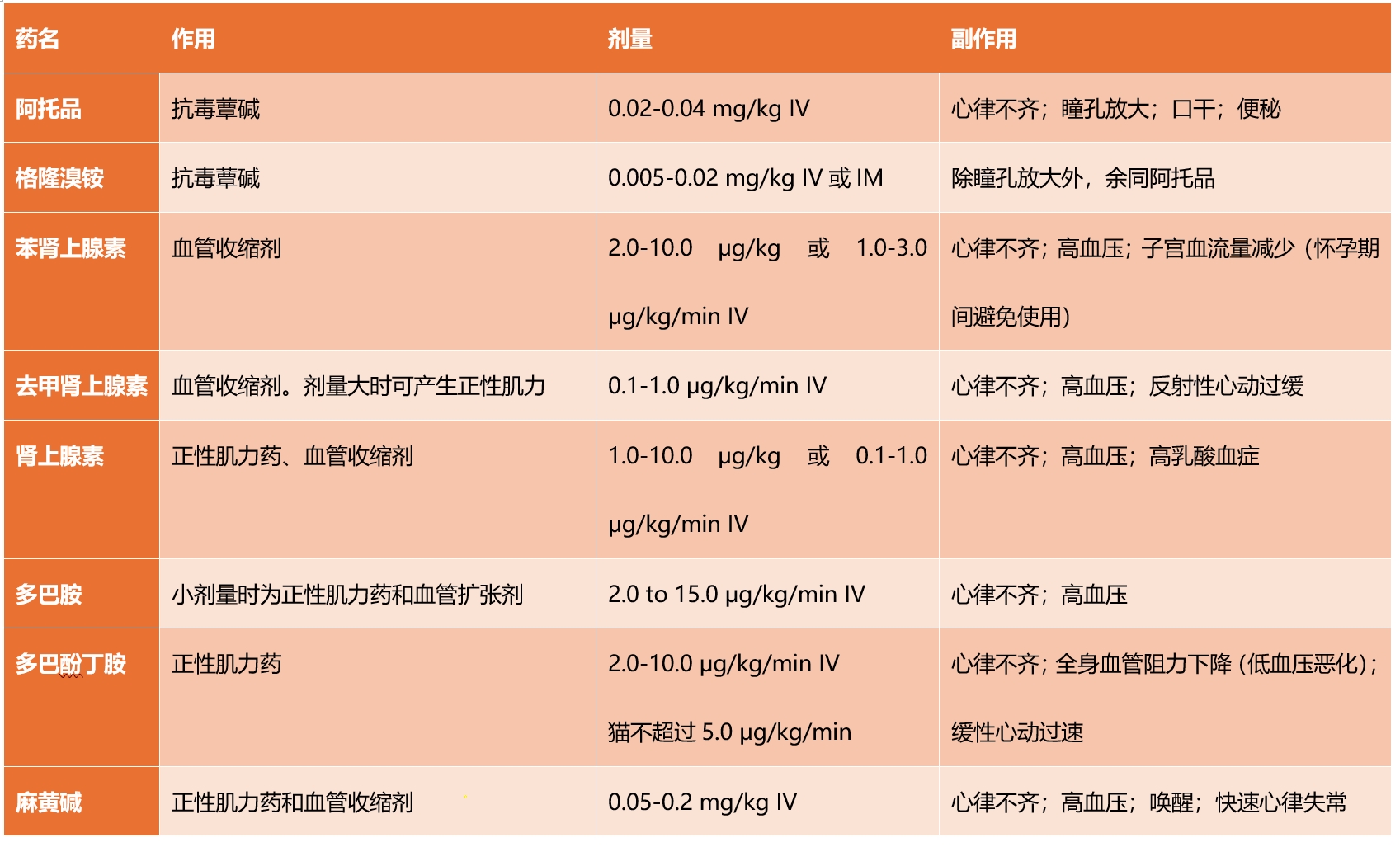
许多麻醉药物都有负性肌力作用,α2-肾上腺素能激动剂、异丙酚、阿伐沙龙和挥发性麻醉剂都会在一定程度上降低收缩力。乙酰丙嗪也可能导致收缩力下降。在健康动物中,这些药物的耐受性很好,但在有罹患PAH风险的动物中,这些药物可能会使问题更加严重。使用平衡麻醉技术有助于减少这些药物的剂量。如果需要血压支持,可以使用心血管支持药物(表2)。
心律失常
心律失常会影响心肌收缩力,麻醉前应妥善治疗原有的心律失常。对血压有影响的术中心律失常应使用抗心律失常药物进行控制。有些心律失常尽管会引起担忧,但并不需要治疗。房颤除非与心肌缺血并发,否则通常不会导致严重的血流动力学损害。
孤立的室性异搏很少需要治疗。二度房室传导阻滞很常见,尤其是在使用α2-受体激动剂或阿片类药物时。但如果伴有心动过缓和PAH,抗毒蕈碱药物会使心律失常消失。
酸中毒
严重的酸中毒会干扰心肌细胞功能和钙结合,从而降低心肌收缩力。麻醉期间的呼吸性酸中毒是由于通气不足和高碳酸血症造成的。尽可能降低麻醉深度,或通过人工气囊或机械呼吸机提供正压通气。代谢性酸中毒应在全麻前解决根本原因。如果麻醉时间紧迫,可使用碳酸氢钠控制严重酸中毒(即血液pH值低于7.1)。
新生幼崽和老年动物
新生幼崽的心肌收缩力发育不良,老年动物的结构变化会降低心脏的效率。这些患者的Qt值在某种程度上取决于HR,因为它们无法通过增加心肌收缩力来补偿,因此麻醉管理应旨在维持HR,以保持组织血流。应避免使用明显抑制HR的药物,但可以使用抗毒蕈碱药物来控制表现为PAH的心率下降。
(3)后负荷
后负荷是指心脏将血液泵出心室时必须克服的阻力。或者也可以将其描述为左心室壁在射血过程中产生的张力,或者更简单地说,心脏发现射血有多困难。血管收缩会增加后负荷并降低SV和Qt,但一般不会导致PAH,因此不再赘述。
关于二尖瓣疾病及其对心输出量影响的说明
二尖瓣疾病以及随之而来的血液从左心室逆流到左心房的情况很常见,尤其是在狗身上。虽然单独的二尖瓣狭窄不会影响前负荷、收缩力或后负荷,但由于血液逆流,二尖瓣狭窄会在一定程度上影响Qt值。
如果SVR因麻醉而发生变化,反流的血液量也会发生变化。当血管收缩导致SVR增加时,后负荷的增加将促使更多血液从左心室反流到左心房。相反,SVR下降则会降低后负荷,促进前向血流。在患有二尖瓣疾病的动物中,乙酰丙嗪可通过血管扩张来促进前向血流,α2激动剂则相对禁用,因为反流的血液会增加。二尖瓣疾病的重要性及其对PAH的影响在很大程度上取决于疾病的严重程度。
3. 全身血管阻力
血液流经全身循环时遇到的阻力称为SVR(或总外周阻力)。它是血管对循环血液施加的力,反映了血管的直径和长度以及血液的粘度。更简单地说,它是血管内血管收缩或扩张的程度,大部分阻力来自动脉血管。
SVR降低可导致低血压,这也是导致PAH的一个非常常见的原因,液体容量正常的动物血管扩张可能会导致“相对低血容量”(即相同容量的液体现在占据了更大的空间)。
如前所述,这种情况不应该用大量输液来治疗,因为这会产生有害影响,应该使用血管活性药物来控制。兽医学中可能会遇到SVR降低的原因如下:
(1)乙酰丙嗪
乙酰丙嗪通常作为麻醉预处理的一部分,通过阻断α-1肾上腺素能受体导致血管扩张。发生的PAH通常较轻,易于控制。在最近的一项研究中,使用乙酰丙嗪导致发生PAH的几率几乎增加了3倍。
(2)催眠诱导药物
丙泊酚和阿伐沙龙等催眠诱导药物会通过尚未完全明了的机制导致血管扩张。诱导后出现的PAH通常是轻微和自限性的。应通过使用适当的预处理药物和确保安静平和的环境来尽可能减少剂量。使用苯二氮卓类药物或阿片类药物的联合诱导技术也有助于减少诱导和气管插管所需的催眠药剂量。
(3)挥发性麻醉剂
用于维持全麻的挥发性麻醉剂可能通过多种细胞机制导致血管扩张。如前所述,它们还可能抑制收缩力,并抑制对PAH的压力感受器反应。平衡麻醉技术将有助于减少维持全麻所需的剂量。
(4)神经麻醉
使用局麻药进行神经麻醉(硬膜外或脊髓给药)会阻断交感神经,导致血管张力下降和广泛的血管扩张。
(5)过敏反应
导致PAH的过敏反应通常是突发且严重的,需要紧急干预。过敏性和非过敏性休克不易区分。某些药物(如静脉注射吗啡、抗生素、外周肌松剂、造影剂)可能更容易引发过敏反应。如果过敏反应很严重,可能会迅速致命。
如果知道致病药物,则应停止用药并给予支持性护理。肥大细胞肿瘤的手术操作也可能导致肥大细胞脱颗粒和组胺释放。
(6)脓毒性休克
脓毒性休克是一种复杂的疾病过程,可通过多种机制对Qt和SVR产生深远影响。收缩力会受到负面影响,但广泛的血管扩张和血管低反应性会迅速导致心血管衰竭和死亡。这些动物在麻醉期间表现出的PAH可能极难处理,必须采取综合疗法,以纠正体液平衡、解决血管瘫痪(血管对儿茶酚胺无反应)和治疗收缩力低下。此外,动物总是作为急诊病例出现,通常在正常工作时间以外进行麻醉,此时资源可能有限。这部分PAH患者的死亡率很高。
(7)血管紧张综合征
血管紧张综合征的特点是病理性低SVR,在许多疾病和创伤状态下都会出现。血管紧张综合征可用于休克,也可用于重大烧伤、多发性创伤、胰腺炎、过敏性休克和其他重大手术(如与重大心脏手术相关的手术)。血管紧张综合征的病理生理学非常复杂,可能涉及与危重疾病相关的皮质类固醇不足。一些患者可能会对外源性皮质类固醇和血管加压疗法产生反应。
(8)肾上腺皮质功能减退
肾上腺皮质功能减退症或阿狄森氏病是一种肾上腺皮质功能不全的内分泌疾病。糖皮质激素的缺乏可能会导致心动过缓、血管痉挛和随之而来的PAH。计划进行麻醉的动物应继续接受正常的类固醇替代治疗,并在麻醉期间补充氢化可的松。对于大型手术,应在术后继续输注氢化可的松。全麻期间发生急性阿狄森氏病危象可能会迅速致命。
(9)肾上腺皮质功能亢进
肾上腺皮质功能亢进症(库欣氏病)使用曲洛坦治疗。曲洛坦可抑制皮质类固醇的分泌,过度抑制可能导致与上述阿狄森氏病类似的临床症状。在计划进行麻醉前24-48小时应停止使用曲洛坦,因为在此期间皮质类固醇的分泌会得到恢复。
03 抗高血压药物
治疗动物高血压的药物有很多,包括血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、β-受体阻滞剂、钙通道阻滞剂、利尿剂和血管扩张药。其中许多药物已获得人类使用许可,但也可给动物患者使用。
不过,有关这些药物在动物体内的使用以及与麻醉药物相互作用的证据有限,而且都是从人体内推断出来的。这些动物患上难治性PAH的风险可能更大。表3总结了用于治疗动物高血压的药物,并就全麻前是否继续或停止治疗提供了指导。

04 麻醉期间突发严重低血压
如上所述, PAH的病理生理学是复杂和多因素的。如果在麻醉过程中突然出现低血压,可以采取一些措施,具体步骤如下:
- 呼救,因为情况可能危及生命,并在可能的情况下停止麻醉
- 检查脉搏、心率和心律
- 检查麻醉深度
- 寻找原因:
– 如果明显出现心动过缓,应查找原因(如迷走神经刺激),停止刺激并进行相应治疗。检查可调节的限压阀是否打开
– 如果出现心律失常,则进行治疗(如果发生心脏骤停,则进行除颤或心肺复苏)
– 如果发现严重出血,则开放液体并准备输血。考虑放置第二个静脉置管
– 注意刚刚使用的药物(如抗生素)是否可能导致过敏性休克。是否使用了正确剂量的正确药物
– 其他不常见的原因包括张力性气胸、肺栓塞
考虑使用血管加压药。注意有些血管加压疗法是通过输液进行的。不过麻黄碱和小剂量肾上腺素也可作为栓剂给药。
05 总结
PAH是全麻期间常见的并发症。兽医必须加强对血压的监测,以便及时发现并治疗PAH。血压生理学和PAH病理生理学是多因素和复杂的。了解PAH的基本机制将有助于临床医生实施适当的治疗计划。虽然PAH只是麻醉过程中的一种并发症,但识别和治疗PAH有助于降低动物麻醉相关死亡率。
参考文献:Teotino, G., Neale, A. and Auckburally, A. (2024), Arterial blood pressure. Part 2: causes and management of hypotension during general anaesthesia in cats and dogs. In Practice, 46: 289-301.